小麦秸秆溶解性有机质的光谱学分析
周向军 ,高茹霞 ,齐 婷
(1.天水师范学院 生物工程与技术学院,甘肃 天水 741001;2.甘肃省农业固体废弃物资源化利用重点实验室,甘肃 天水 741001)
农作物秸秆作为一种数量极大的可再生生物质资源,其资源化利用方式主要包括:肥料化、饲料化、能源化、原料化和基料化等[1]。其中,秸秆还田是实现农作物秸秆肥料化利用的重要手段之一。该模式不仅可避免秸秆焚烧所造成的环境污染,而且还具有能提高土壤微生物酶活性,改善土壤团粒结构[2],增加土壤孔隙度和土壤肥力等多重功能,因而正日益成为一种绿色的保护性耕作技术手段。溶解性有机质(Dissolved organic matter,DOM)是指能通过0.45 μm滤膜的碳基有机混合物[3]。秸秆源DOM作为土壤溶解性有机碳(Dissolved organic carbon,DOC)的重要来源之一,对于促进土壤养分循环和最终实现农田固碳等同样具有重要意义[4]。韦梦雪等[5]研究表明,水稻/油菜秸秆腐解释放的DOM浓度呈现一定的阶段性,腐解前期(10 d内)以小分子芳香性组分为主,蛋白质、纤维素、半纤维素类组分主要在腐解后期被降解;李艳等[6]利用三维荧光—平行因子法对玉米秸秆和牛粪发酵形成的DOM荧光组分进行分析,结果表明,秸秆/牛粪体积比为6∶4可作为堆肥参考值;范春辉等[7]利用紫外光谱和荧光光谱研究了pH对DOM光谱的影响,初步阐述pH对秸秆腐殖化过程DOM性质的影响。李婉秋等[8]针对秸秆生物质DOM的光谱特性及其与Cu2+的相互作用开展了相关研究,结果表明,生物质炭来源的DOM可对Cu2+的环境行为产生影响。
由于秸秆DOM化学结构复杂多样,难以进行有效的组分分离,导致其在农田土壤生态系统中的释放特征和荧光组分等仍缺少系统性研究,不利于进一步掌握秸秆还田腐解规律和养分释放特征等基本信息,同时,尽管前人相关研究均支持土壤微生物影响秸秆腐解以及光谱学可用于DOM化学表征这一观点,但目前尚不清楚小麦秸秆腐解过程DOM的释放特征及其荧光组分的类型变化,同时也需要进一步评估光谱学方法是否能用于小麦秸秆DOM的化学结构表征。目前,用于DOM研究的技术方法主要可分为色谱法和光谱法[9],其中,光谱学方法由于具有成本低、速度快、精确度相对较高和应用性较强等特点,能初步区分DOM化学结构的差异性,追踪不同腐解阶段秸秆残体的结构变化,因而逐渐成为科研人员的关注热点领域之一。常见的DOM光谱学研究方法主要有紫外可见光谱(UV-Vis)、红外光谱(FTIR)、三维荧光光谱(3D-EEM)和核磁共振(NMR)等[10]。其中,UVVis具有操作简便、样品用量少和灵敏度高等优点,通过DOM特征性参数可对其芳香化和腐殖化过程进行评估;3D-EEM能及时准确地提供DOM荧光组分的“指纹”信息[11];FTIR能提供DOM主要官能团的光谱学信息,从而可实现对DOM化学结构变化进行跟踪的目的[12];NMR虽然对DOM化学结构的解析度较高,但对仪器平台和试验成本等均要求较高。
本研究利用总有机碳法、UV-Vis、FTIR和3D-EEM技术,对不同腐解阶段小麦秸秆DOM的释放特征、光谱学特性和荧光组分等进行解析,为进一步了解小麦秸秆腐解过程中DOM的结构变化和腐解机制等提供理论参考。
1 材料和方法
1.1 试验材料
小麦秸秆采自甘肃省天水市秦州区郊区农田。
1.2 试验设备
UV-2600紫外分光光度计(岛津(中国)有限公司);F-7000荧光分光光度计(日立(中国)有限公司);Nicolet IS5傅里叶红外光谱仪(赛默飞世尔科技公司);Centrifuge 5810R离心机(德国艾本德公司);Multi N/C2100 TOC分析仪(德国耶拿分析仪器有限公司);FD-1D-50真空冷冻干燥机(北京博医康实验仪器有限公司)。
1.3 试验方法
1.3.1 菌液制备及小麦秸秆腐解 小麦秸秆风干粉碎过筛得粒径约1 mm秸秆粉末,备用。采用五点取样法采集农田黄绵土,过0.84 mm筛,按15 g/100 mL加入蒸馏水,振荡5 h后上清液在4 000 r/min离心10 min,收集菌液。称取小麦秸秆粉5.00 g,加入少许石英砂和50 mL蒸馏水,分散后加入菌液10 mL,室温120 r/min恒温避光振荡。考虑到60 d后腐解体系pH逐渐不利于微生物生长,故在 0、1、3、5、10、15、20、30、45、60 d分别取样5 mL并及时补充水分。8层纱布过滤,采用Centrifuge 5810R离心机在8 000 r/min离心10 min,上清液经0.45 μm滤膜过滤即为DOM[13]。
1.3.2 DOM测定 样品酸化至pH值2.0以除去溶解性无机碳,采用Multi N/C2100 TOC分析仪测定DOC14]。DOM浓度通常被认为是DOC浓度的 2倍[15]。
1.3.3 紫外光谱分析 在250~500 nm范围内,利用UV-2600紫外分光光度计测定DOM的紫外吸收光谱。

式中,aλ和Aλ分别为波长λ处吸收系数(m-1)和吸收度,l为光程(m)。
1.3.4 红外光谱分析 DOM经过FD-1D-50真空冷冻干燥机冷冻后,采用Nicolet IS5傅里叶红外光谱仪在1 000~3 600 cm-1范围内测定红外光谱。
1.3.5 三维荧光光谱分析 以超纯水为空白,采用F-7000荧光分光光度计在光源150 W氙灯,PMT电压700 V条件下,设定Ex为220~400 nm,Em为250~550 nm,波长步长10 nm,狭缝5 nm,扫描速度1 200 nm/min[16]进行测定。采用紫外吸收度值进行荧光内滤效应校正。

式中,FC和F为校正前后的荧光强度,AEx和AEm为激发/发射波长处的吸光度。
1.4 数据分析
试验采用Origin 8.0作图和SPSS 16.0进行最小显著性差异法(LSD)统计分析,P<0.05为显著差异。
2 结果与分析
2.1 DOM的释放特征分析
小麦秸秆腐解释放DOM的浓度变化如图1所示。

图1 小麦秸秆腐解过程DOM浓度变化Fig.1 Change of DOM concentration in decomposition process of wheat straw
从图1可以看出,小麦秸秆腐解释放DOM具有明显的阶段性,基本可分为3个阶段:在腐解初期(0~5 d),DOM浓度呈波动趋势;在腐解中期(5~20 d),DOM浓度快速降低(P<0.05),表明其生成速度低于分解速度;在腐解后期(20~60 d),DOM浓度又逐渐增加(P<0.05),其生成速度高于分解速度。分析原因认为是:在腐解初期,一方面新鲜小麦秸秆可快速释放生物利用性较高的氨基酸、有机酸、单糖等亲水性小分子化合物,另一方面该类化合物也可作为底物进而诱导土壤微生物大量繁殖,因而,DOM浓度出现波动趋势;在腐解中期,淀粉类碳水化合物、蛋白质、脂类等易降解生物大分子进入快速分解期,甚至最终被矿化后以CO2和CH4形式释放,因而,DOM浓度不断降低;在腐解后期,小麦秸秆进入缓慢分解期,纤维素、半纤维素、木质素等难降解性化合物逐渐被土壤微生物酶系所降解,同时微生物代谢产物及其残体也成为DOM来源,故DOM浓度又逐渐增加。
2.2 DOM的紫外光谱及其特性分析
2.2.1 紫外光谱 小麦秸秆腐解释放DOM的紫外光谱如图2所示,小麦秸秆不同腐解阶段DOM的紫外吸收光谱具有一定的相似性,且吸收强度几乎均随波长增加而逐渐降低,这表明不同腐解阶段DOM组分的化学结构具有一定相似性。在217~220 nm(peak 1)范围内出现吸收峰是由无机离子如溴化物和硝酸盐等以及肽类化合物的π-π*跃迁引起的。当腐解至第3 天后,217~220 nm的吸收峰先紫移后红移,原因可能是DOM与水溶液间的氢键作用得到增强,同时水分子具有的偶极矩使DOM极性增强而发生溶剂化作用[17],因而,DOM发生红移。研究还发现,当腐解1 d后,在270~280 nm(peak 2)和325 nm(peak 3)附近较弱的吸收峰几乎完全消失。

图2 小麦秸秆腐解过程DOM的紫外光谱分析Fig.2 UV spectrum analysis of DOM in decomposition process of wheat straw
2.2.2 吸光度比值分析E2/E3代表DOM在λ250和λ365处的吸收度比,与其芳香化程度成反比[18]。从图3可以看出,在0~3 d范围内,E2/E3先降低后增加,随后E2/E3逐渐下降。当腐解第15天后,E2/E3缓慢增加后又下降,但在整个腐解过程中E2/E3值范围变化不大。E2/E4代表DOM在λ240和λ420处的吸收度比值,与DOM缩合度成反比[19]。从图3可以看出,在0~3 d范围内,E2/E4先降低后增加,随后E2/E4急剧下降(P<0.05)。当腐解20 d后,E2/E4先增加后降低。原因是腐解中期生成的部分DOM产物相互作用形成分子量较大的腐殖质类物质,在腐解后期其分解和形成处于动态变化过程。E2/E4和E2/E3变化趋势较为相似,结合E2/E3与芳香化程度成反比以及E2/E4与DOM缩合度成反比这一观点,可认为DOM芳香化程度与其缩合度具有相关性。

图3 小麦秸秆腐解过程E2/E3和E2/E4分析Fig.3 Analysis of E2/E3 and E2/E4 values in decomposition process of wheat straw
2.2.3 SUVA254特征分析 SUVA254是DOM在λ254处的吸收系数与DOM浓度之比,与芳香性成正比[20]。从图4可以看出,在0~3 d范围内,SUVA254值迅速降低(P<0.05),表明DOM芳香化程度降低,原因与腐解初期大量繁殖的土壤微生物促进芳香类腐殖质降解有关。在3~20 d范围内,SUVA254值逐渐增加(P<0.05),其原因是腐解中期秸秆水解又重新形成了部分芳香性DOM化合物。在20~60 d范围内,SUVA254值先明显降低(P<0.05)后略有增加(P>0.05),说明木质素源芳香类化合物开始被土壤微生物降解形成部分芳香类化合物。

图4 小麦秸秆腐解过程SUVA254值变化Fig.4 Change of SUVA254 values in decomposition process of wheat straw
2.3 红外光谱分析
小麦秸秆腐解过程DOM的红外光谱分析结果如图5所示。
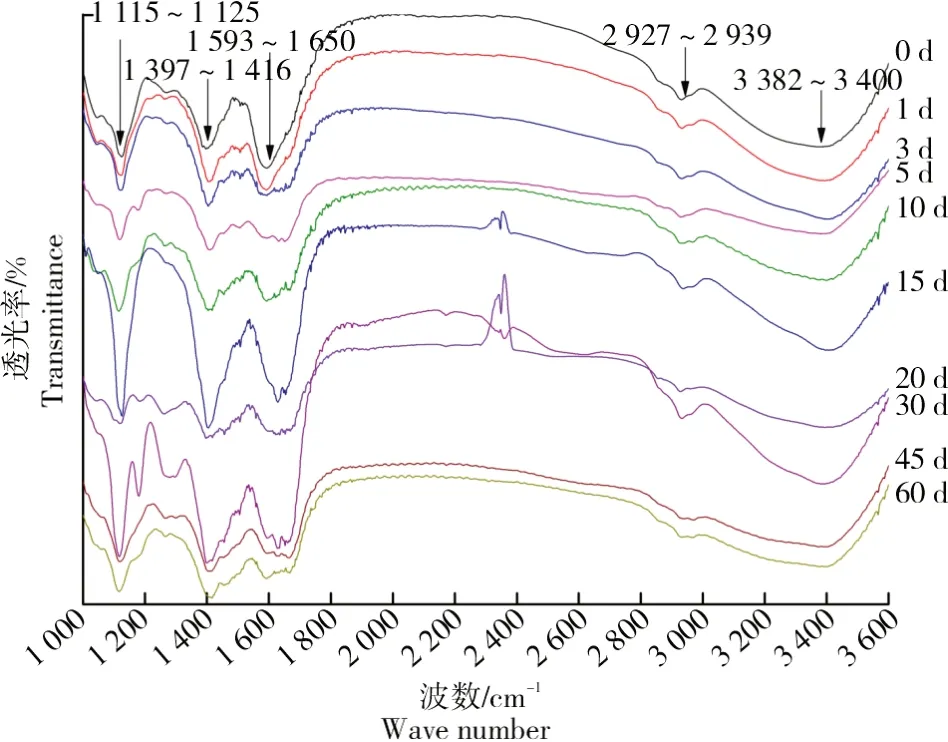
图5 小麦秸秆腐解过程DOM的红外光谱分析Fig.5 Analysis of infrared spectroscopy of DOM in decomposition process of wheat straw
在不同腐解阶段,小麦秸秆DOM均出现5个主要吸收峰:3 382~3 400、2 927~2 939、1 593~1 650、1 397~1 416、1 115~1 125 cm-1,但其相对吸收强度有所差异,表明在不同腐解阶段DOM的组成和含量有所不同。其中,3 382~3 400 cm-1处的宽峰归属为形成氢键的O-H、N-H伸缩振动,如纤维素、半纤维素、淀粉类化合物和单糖等化合物,以及水分子中O-H的伸缩振动[21];2 927~2 939 cm-1处的弱峰归属为脂肪族或碳水化合物中-CH2中CH的反对称伸缩振动[22];1 593~1 650 cm-1处的强峰归属为COO-反对称伸缩振动、酰胺II带中N-H、芳香环骨架以及C=O、C=C的伸缩振动[23];1 397~1 416 cm-1处的强峰归属为C-N的伸缩振动、苯环C-H的弯曲振动以及蛋白质降解产生的NH4+、NO3-和-COO-吸收[24];1 115~1 125 cm-1处的强峰归属为碳水化合物、醇类、羧酸类和酯类中CO-C的不对称伸缩振动[25]。综上所述,小麦秸秆含有脂肪族、酰胺类、含氧/氮基团和芳香类等化合物。
腐解初期:3 382~3 400 cm-1处的吸收峰逐渐降低,主要原因是具有分子间氢键的含O-H类化合物被逐渐分解。2 927~2 939 cm-1处的峰强和峰形变化不明显,原因是多种化合物均在此区域有红外吸收。腐解中期:3 382~3 400 cm-1处的吸收峰先增强后减弱,表明淀粉类、脂类化合物等被土壤微生物所分解,从而将更多含-OH、-NH2类化合物暴露在溶剂体系,随后DOM又被微生物作为底物而消耗。腐解后期:3 382~3 400 cm-1处的峰强度有所增强,1 630~1 650 cm-1处出现多个混杂峰,表明木质素、单宁、蜡质开始被降解生成小分子聚糖类化合物。另外,纤维素化合物具有高度的结晶性和致密结构以及存在分子间氢键作用,因而,一般不易被分解,但当腐解至第45天后,1 506~1 507 cm-1处的弱吸收峰彻底消失,表明小麦秸秆的纤维素结构逐渐受到破坏,木质素包裹作用减弱[26],与图4中腐解45 d后SUVA254值缓慢增加的结论一致。第45、60天的DOM峰强和峰形较为相似,表明未降解的部分碳氢类化合物、有机酸、酰胺类以及碳水化合物等以木质素源芳环为核心发生聚合作用形成聚合度较高的芳香类腐殖质,使DOM结构更加复杂化。
2.4 三维荧光光谱及荧光组分分析
3D-EEM可同时提供荧光强度随激发波长和发射波长变化的关系,故根据荧光基团的光谱信息,可推测不同腐解阶段小麦秸秆DOM的结构组成。DOM的荧光峰位置及荧光类型如表1所示。

表1 不同腐解过程DOM的荧光峰类型Tab.1 Fluorescence peak types of DOM in different decomposition processes
根据鲁遥等[27]研究结果,λEx/λEm=230~270 nm/370~460 nm、λEx/λEm=300~360 nm/370~440 nm范围内荧光峰,主要与胡敏酸C=O、-COOH和结构稳定的有机化合物等有关[28];λEx/λEm=350~440 nm/430~510 nm范围内荧光峰,主要与胡敏酸的腐殖化程度有关;λEx/λEm=290~310 nm/400~450 nm范围内荧光峰,主要与类富里酸的微生物降解产物有关[29]。
在腐解初期后半阶段,类富里酸的分解速度大于类胡敏酸,原因是类富里酸主要由碳水化合物和不同分子量大小的脂肪族化合物组成,因而,容易被土壤微生物矿化而分解。在腐解中后期(15~20 d),类胡敏酸逐渐被大部分降解,原因是类胡敏酸主要由类多糖、脂肪族木质素类、长链脂肪族化合物等组成,且难降解性芳香类化合物的比例高于类富里酸,因而,主要在腐解中后期被降解[30]。在腐解后期,3D-EEM出现了类富里酸荧光峰,该荧光峰基本归属为芳香类化合物且与COOH、C=O和酚羟基的含量密切相关,原因与木质素及其降解产物如酚类、醌类及脂肪族类化合物相互聚集形成类富里酸有关[31]。研究还发现,小麦秸秆腐解初/中期几乎均存在类蛋白峰,原因是类蛋白峰的出现与该腐解阶段土壤微生物的代谢比较旺盛有关,同时也有秸秆添加量较多有关[32]。
3 结论与讨论
本研究结果发现,除在腐解初期发生波动外,DOM浓度在腐解中、后期呈V型趋势,具有明显的阶段性。这与韦梦雪等[5]关于油菜和水稻腐解过程DOM浓度呈W型变化有所不同。原因是秸秆DOM的释放过程是一个土壤微生物代谢和腐解中间产物相互转化共同控制的复杂过程,不同腐解阶段的DOM组成和存在状态均具有一定的异质性[33]。如小麦秸秆与油菜/玉米秸秆DOM不仅在分子大小、亲/疏水性和C/N等秸秆腐解内在因素方面存在差异,而且也与土壤微生物种类、丰度以及秸秆颗粒大小等外在因素有关[34]。另外,小麦秸秆腐解过程中存在腐解中期速度较快、腐解后期速度较慢等特点,这与韦梦雪等[5]关于油菜和水稻腐解规律基本一致,其原因在于活化后的土壤微生物活性较高,首先以秸秆有机质为底物进行快速分解,随后难降解性组分分解形成DOM并发生部分团聚性的腐殖化过程。
本研究结果发现,DOM的紫外吸收均随波长增加而下降,最大吸收峰位于270~280 nm且在325 nm附近出现肩峰,这一结果类似于余旭芳等[11]关于小麦秸秆堆肥过程中水溶性有机物的UV-Vis光谱变化状况,但与范春辉等[7]关于玉米秸秆紫外吸收峰位于229 nm有一定差异,这主要与腐解体系有机质的复杂性有关。研究发现,270~280 nm范围内的吸收峰在腐解中后期消失,原因是部分芳香类DOM组分通过土壤微生物酶降解或化学聚合作用而不断减少[35]。有研究表明,尽管E2/E3和E2/E4等特征性参数常用来比较DOM的腐殖化程度、分子量大小和缩合度等指标,但该值易受溶液体系中各种无机离子的干扰[36]。本研究E2/E3和E2/E4的范围存在较大差异即证明了这一点,但E2/E3和E2/E4的变化趋势基本一致,表明DOM芳香化程度与其缩合度具有相关性。本研究结果还发现,小麦秸秆DOM的芳香性呈波动变化趋势,且腐解10 d后,其芳香性高于腐解初期。
本研究结果发现,在腐解初期和中期,3 382~3 400、2 927~2 939 cm-1处的吸收强度逐渐下降,表明碳水化合物和脂类含量逐渐降低,最终以CO2形式释放。当腐解15 d后,1 593~1 650 cm-1处吸收强度发生起伏变化并逐渐蓝移至1 650 cm-1处,以及1 400~1 420、1 120~1 130 cm-1处的吸收峰明显增强后减弱,表明部分羧酸酯类化合物不断发生分解生成羧酸盐,同时蛋白质类化合物也被降解后形成CO2、硝酸盐或铵盐等。研究还发现,当腐解15 d后,1 629~1 654 cm-1处开始出现尖锐的双峰,表明酰胺类化合物以及难降解的芳酮类化合物部分形成[37]。上述结果表明,小麦秸秆在不同腐解过程中并不是单纯降解某一类化合物,而是同时也伴随着其他化合物的分解或转化。刘佳琪等[38]对高粱和玉米秸秆腐解过程进行红外光谱分析,发现腐解过程中碳水化合物含量降低,氨基酸等小分子化合物被分解,羧基含量增多且芳香类化合物增多,这与小麦秸秆腐解过程具有一定的相似性。总体而言,氨基酸等亲水性小分子化合物首先被降解,随后以分解淀粉类多糖、蛋白质、脂类等生物大分子为主,羧基酸盐含量增多,最后以降解纤维素、半纤维素和木质素类化合物为主。
三维荧光光谱发现,小麦秸秆腐解初期存在类蛋白、类富里酸和类胡敏酸3种荧光峰,腐解中期类胡敏酸荧光峰逐渐消失,类富里酸荧光峰逐渐出现,而腐解后期仅存在类富里酸峰,与韦梦雪等[5]关于油菜秸秆仅在腐解初期具有类蛋白荧光组分,以及水稻秸秆始终未检测到类蛋白质荧光组分这一结果不同,这表明尽管小麦秸秆中蛋白质类属于易降解性化合物,但由于小麦秸秆添加量较多等原因,在腐解初期、中期均发现类蛋白峰的存在,同时也表明土壤微生物代谢较为活跃旺盛,腐解过程中新生成了大量类蛋白化合物。本研究还发现,随腐解过程的进行,胡敏酸类化合物逐渐消失而富里酸类化合物进一步形成,原因可能是小麦秸秆的过量添加使微生物分解作用增加,延缓了富里酸向胡敏酸的转化进程[39],同时也不利于以杂环结构为基础的类胡敏酸缩聚成核。
本研究结果表明,除腐解初期发生波动外,小麦秸秆DOM释放过程基本呈V型分布,整体表现为:腐解前期波动、腐解中期降解较快和后期降解较慢的特点。小麦秸秆DOM释放过程可分为3个阶段:腐解初期(0~5 d)、腐解初期(5~20 d)和腐解后期(20~60 d),DOM释放过程呈现明显的阶段性。紫外光谱表明,随腐解过程的进行,小麦秸秆DOM中芳香性化合物先降低后整体逐渐增加,E2/E4和E2/E3变化趋势相同,也表明DOM芳香化程度与其缩合度具有相关性。红外光谱表明,亲水性小分子化合物首先被释放,然后小麦秸秆以释放易降解性生物大分子为主,最后以释放难降解性生物大分子为主,但整个腐解阶段秸秆有机质的降解不存在明显的界限。三维荧光光谱表明,腐解初期DOM含有类蛋白、类胡敏酸和类富里酸化合物,腐解中期类富里酸的消耗速度快于其他化合物,而腐解后期则类蛋白、类胡敏酸的消耗速度快于类富里酸形成速度。

