1例仔猪混合感染PRRSV、PCV与大肠杆菌的诊断及基因组比较分析
李剑静
广西岑溪市动物疫病预防控制中心,广西岑溪 543200
广西某大型猪场存栏猪4 300 头,2021 年10月20 日开始进猪,每次进猪500 头左右,持续进猪十多天,进场小猪体重在7.5 kg 左右,进场后的小猪3~4 d 开始发病,每天死亡15 头左右,死亡小猪不食、消瘦,没有其他明显临床症状,死亡时间持续半个月,共死亡286 头。通过实验室检测发现本次仔猪主要以猪蓝耳病病毒(PRRSV)、猪圆环病毒(PCV2、PCV3)型、大肠杆菌等混合感染为主。
PRRSV 病毒属于冠状动脉科的球形病毒,全长15 kb 左右,是一种有囊膜的单股正链RNA 病毒,由于该病毒主要在肺部集聚,所以感染此病毒的仔猪容易出现呼吸道疾病的症状,临床上难以辨别。顾瑞恒[1]对猪场进行PRRSV 病毒的检测、分离与测序鉴定发现,该病毒主要是在编码GP2、GP3、GP4 与GP5 的基因上易发生碱基的插入、替换与缺失,这为本病的检测治疗带来了挑战。PCV 病毒属于圆环病毒科的正二十面体病毒,全长1.7 kb 左右,是一种单股环状负链DNA 病毒,该病毒亚型种类较多,我国主要以2 型与3 型为主,此病毒大多由呼吸道感染,由于PCV 病毒结构简单编码蛋白少,因此致病性不强,但该病毒抵御外界环境的能力强,常与其他病菌混合感染宿主,加重仔猪病情。
1 材料与方法
1.1 材 料
1)病料来源。广西岑溪某猪场病死的仔猪,剖解后取出心、肝、脾、肺、肾、十二指肠、血样、淋巴结等至实验室检测。
2)试验器材。酒精灯、镊子、解剖剪、接种环、无菌培养皿、高压蒸汽灭菌锅、冰箱、超净工作台、移液枪、恒温细菌培养箱、摇床、天平、光学显微镜、实时荧光PCR 仪、凝胶成像系统、电泳仪等。
3)试剂。国测生物猪蓝耳病毒/猪伪狂犬病毒/猪瘟病毒/猪圆环病毒II 型实时荧光RT-PCR 联检试剂盒、病毒DNA/RNA 提取试剂盒、100 bp Ladder、2*Es Taq MasterMix(Dye)、ddH2O、反转录试剂盒、麦康凯琼脂培养基。
1.2 方 法
1)细菌的培养鉴定。用点燃的酒精棉球在肺脏、肾脏表层进行消毒灭菌,选取病变较为明显的部位剪开,用灭菌的接种环蘸取病变组织部位,划线于麦康凯琼脂培养基,培养24 h。
2)病料DNA/RNA 的提取。将肺脏的病变部位剪取小部分,置于无菌的研钵中,加入1 mL 的生理盐水研磨,直至组织样品破碎,然后将研磨好的组织样品装入2 mL 的EP 管中反复冻融3 次,使病菌细胞破裂,便于细菌DNA/RNA 的提取。参考国家标准GB/T 19915.4-2000 的方法,将EP 管中反复冻融的样品在12 000 r/min 离心5 min,用移液枪吸取上层液体,置于1.5 mL 的EP 管中加入蛋白酶K后,按照北京康为世纪生物科技有限公司的病毒DNA/RNA 提取试剂盒的说明,提取病料样品的DNA/RNA,置于-20 ℃的冰箱中备用。
3)RNA 反转为cDNA。将上一步提取的病料RNA 病毒按照反转录试剂盒步骤进行反转,为下一步PCR 试验提供模板。将反转录好的样品按照国测生物猪蓝耳病毒/猪伪狂犬病毒/猪瘟病毒/猪圆环病毒II 型实时荧光RT-PCR 联检试剂盒说明步骤进行。猪圆环Ⅲ型病毒检测则按照普通PCR 步骤进行。
2 结果与分析
2.1 仔猪病原菌的检测
1)实时荧光RT-PCR 检测。通过实时荧光RTPCR 检测(表1、图1 所示),PRRSV、PCV 检测结果为典型的“S”型曲线,猪蓝耳病毒的CT 值与猪圆环病毒II 型的CT 值均大于阳性对照值,因此可以判定本次病料中含有猪蓝耳病病毒与猪圆环病II 型病毒[2]。

图1 实时荧光RT-PCR 检测结果
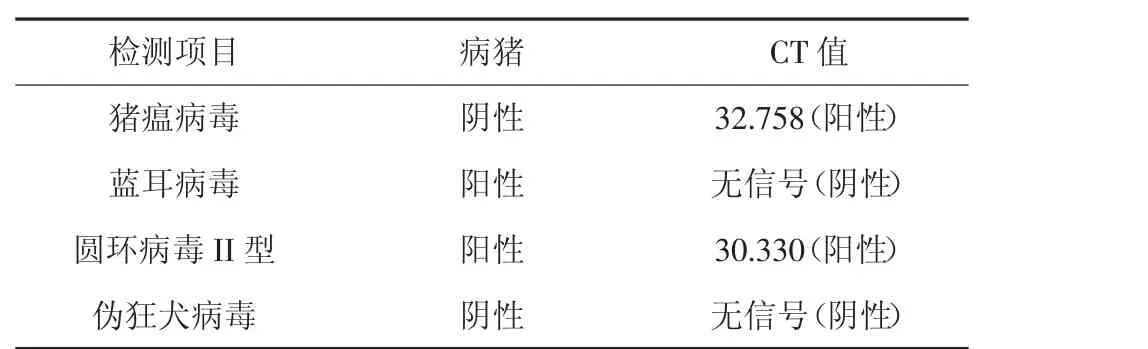
表1 病料检测结果
2)普通PCR 检测。对PCV3 型病毒进行普通PCR 检测,检测结果为阳性。
3)细菌分离鉴定。在麦康凯琼脂培养基上生长为桃红色,圆形菌落、边缘整齐、表面光滑,如图2和图3 所示,革兰氏染色镜检为红色短杆状。综合外观与镜检结果判定为大肠杆菌。
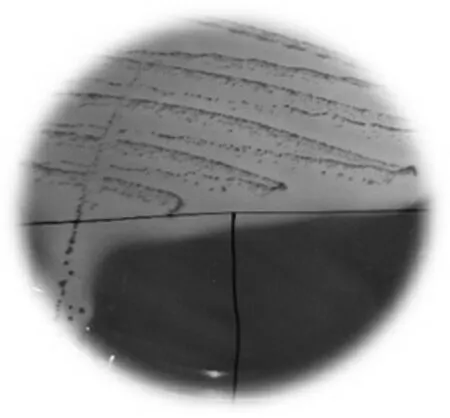
图2 大肠杆菌分离培养结果

图3 大肠杆菌革兰氏染色镜检结果
综合以上的实验检测,本次发病仔猪主要以PRRSV、PCV2、PCV3 以及大肠杆菌混合感染为主。因此,必须采取综合防控措施进行防治。
2.2 PRRSV、PCV 病毒全基因组比较
1)PRRSV 病毒基因组分析。
①动脉炎病毒属全基因组共线性分析。将PRRSVR-2332 毒株的全基因组与动脉炎病毒属的全部21 株病毒进行比较发现,PRRSVR-2332 毒株在1 000、5 900、12 200 bp 处存在150 bp 长度的大片段相似性(图4)。说明该病毒属的毒株在这3个区域附近存在保守序列,不易发生突变,可进行检测引物的设计[3]。

图4 动脉炎病毒属全基因组共线性分析
②PRRSV 病毒ORF 编码区。通过对PRRSVR-2332 毒株全基因组注释分析(图5),可以很直观地看出该病毒一共编码8 个蛋白,分别为ORF1a、ORF1b、GP2、GP3、GP4、GP5、M 与N 蛋白为主。而ORF1a、ORF1b 蛋白主要为性质稳定核蛋白,GP3、GP4、M 蛋白为主要的膜蛋白,N 蛋白是核衣壳蛋白,其中GP2、GP5 蛋白为糖基化包膜蛋白,糖基化蛋白主要与PRRSV 病毒表面的受体及抗原特异性有关[4]。
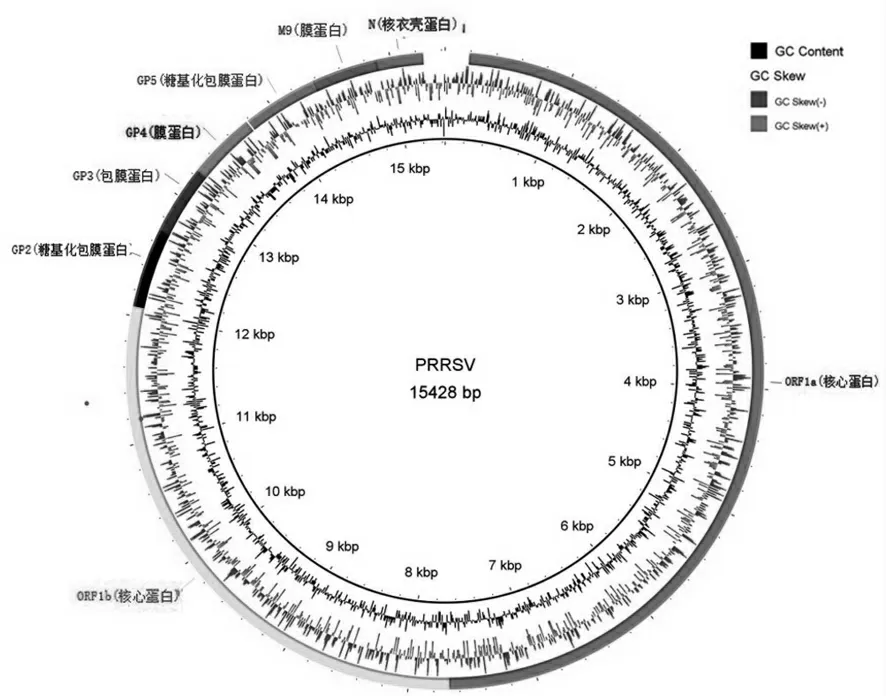
图5 PRRSV 病毒全基因组注释
③PRRSV 病毒ORF 编码区基因比较。对PRRSV 全基因组8 个编码区GC 含量比较分析(图6~图13),编码ORF1a、ORF1b、GP2、GP3、GP4、GP5、M 与N 蛋白区域的GC 含量分别为54.6%、52.96%、46.31%、50.72%、48.42%、50.09%、51.42%、50.81%。GC 含量的高低又间接反映出基因组区域的稳定性[5]。通过比较发现,可以在稳定性较高的ORF1 区域设计引物,用于鉴定该病毒。

图6 ORF1a 编码区GC 含量

图7 ORF1b 编码区GC 含量

图8 GP2 编码区GC 含量

图9 GP3 编码区GC 含量

图10 GP4 编码区GC 含量

图11 GP5 编码区GC 含量

图12 M 蛋白编码区GC 含量

图13 N 蛋白编码区GC 含量
④几种不同PRRSV 病毒糖基化包膜蛋白编码基因区域比较。通过对几种不同PRRSV 病毒编码糖基化包膜蛋白区域的基因进行比较分析(图14~图15),编码GP2 蛋白的9 种基因在其中出现大片段的变异,GP2 对应的基因区域的GC 含量也是最低,这就导致GP2 区域的基因不断出现变异,增加了免疫系统的识别负担与治疗、检测的难度[6]。而对编码GP5 糖基化包膜蛋白的17 种毒株的区域基因进行比较,发现该区域相比GP2 蛋白区域要稳定得多,因此免疫细胞可以更好地识别与记忆,避免了该毒株的免疫逃逸,同时可以利用该区域相对稳定的抗原特异性蛋白制作抗原抗体复合物的快速检测试剂进行PRRSV 的快速鉴定。

图14 11 种不同PRRSV 病毒GP2 编码区基因比较

图15 17 种不同PRRSV 病毒GP5 编码区基因比较
2)PCV 病毒基因组分析。
①PCV 病毒3 种血清型基因组比较。通过对PCV 病毒3 种血清型全基因组比较(图16),发现PCV1、PCV2 2 种病毒全基因组发生了倒置,PCV1、PCV2、PCV3 毒株分别在610、880、1 650 bp 处出现相同片段。因此,猜测PCV3 可能是由其他种类的病毒变异而来,与PCV1、PCV2 的亲缘关系较远[7]。
②62 株PCV2 型毒株基因组比较。通过对2022年1-5 月发布在NCBI 上所有PCV2 型毒株进行全基因组比较(图17),发生在中国的3 株PCV2 型毒株出现明显的大片段的变异。这是因为PCV 病毒无囊膜,基因片段小,所以更容易发生变异[8]。

图17 62 株PCV2 型毒株基因组比较
3 讨 论
大肠杆菌由于亚种较多,有致病性与非致病性,因此常规的生化试验无法准确地判断其种类,目前临床上以菌体表面抗原种类的血清型鉴定为主,但随着研究技术的不断发展,这种检测技术存在着巨大的缺陷,细菌之间存在可移动元件,菌株之间相互传递遗传信息,导致菌株之间的同种菌株鉴定更加困难。罗干[9]对107 株分离的致病性大肠杆菌进行血清学鉴定,主要以O 型为主,又对107 株致病性大肠杆菌进行了16 种毒力基因的检测,共检测出11 种毒力因子。其中,有3 种毒力基因(yij-P:96.26%,ibe-B:85.98%,omp-A:100%)的检出率在85%以上。因此,对O 型致病性大肠杆菌的鉴定以毒力因子基因的检测进行分类会更加细致。
猪繁殖与呼吸综合征病毒是一种烈性、传染性高的病毒。于芳[10]对我国9 个省分离得到的12 株PRRSV 病毒进行全基因组比较关联分析,发现EUtype PRRSVs 毒株的高频基因组重组区主要为GP2~GP4 存在复杂的插入缺失多样性,这与本试验的分析相一致,而ORF 只存在较少的突变碱基。因此,基因组分析与试验验证表明ORF 区是较为保守的,可用于引物设计,进行PRRSV 病毒的检测。
猪圆环病毒由于基因组片段较小,只有2 个开放阅读框,且无囊膜,因此外界的环境因素容易导致其发生变异。王东源[11]从疑似病猪的肺脏组织中的PK-15 细胞成功分离出PCV2 型病毒,经过对分离病毒的全基因组鉴定、同源比较发现与病毒株FJ594471-1C01 亲缘关系较近,但在个别碱基上发生突变。因此,这种基因组小、无囊膜、编码蛋白少、无基因修复能力的病毒,更容易发生突变,对这种病毒的检测鉴定就更加困难。
从基因组层面对PRRSV、PCV 进行比较分析,通过共线性分析发现PRRSV 病毒编码GP2 蛋白对应的基因区域易发生突变;对2022 年1-5 月62 份PCV 基因组进行分析发现中国出现3 个变种。本研究通过对PRRSV-2332 型、PCV2 型与PCV3 型毒株进行全基因组共线性分析比较,找出基因组中的保守大片段与易于突变的片段,提取保守片段进行引物设计来快速鉴定病毒,设计突变区引物用以检测病毒是否发生变异[12]。该方式为变异病毒检测提供了一定的理论依据。

