一株生防木霉的鉴定及环境pH与对羟基苯甲酸对其防病效果的影响
孙小涵,田彦梅,顾 欣 ,刘文辉,赵 岩,杨 娜
(宁夏大学 农学院,银川 750021)
西瓜枯萎病是西瓜的重要土传病害,病原菌是尖镰孢菌西瓜专化型(Fusariumoxysporumf.sp.niveum,FON)。发病初期,植株萎蔫;发病后期,根部腐烂,整株枯死[1]。该病害对生产危害性大,可造成瓜田连片发病甚至绝收,且病原菌在土壤存活期长,对西瓜栽种具有持续性影响[2]。因此,有效防控枯萎病对保障西瓜生产具有重要 意义。
生物防控方法因对环境友好,成为当前土传病害防控的主要研究方向,高效生防菌的获得成为关键。木霉属(Trichodermaspp.)真菌种类丰富、分布广泛、环境适应性强,有广谱抗性,成为应用最广泛的生防真菌之一[3]。据报道,对致病性尖镰孢菌具有生防作用的木霉有哈茨木霉(Tharzianum)[4]、绿色木霉(T.viride)[5]、长枝木霉(T.longibrachiatum)[6]和康氏木霉(T.koningii)[7]等,抑菌机制涉及竞争作用、重寄生作用、抗生作用和诱导抗性作用等[8]。其中空间和营养竞争作用是木霉菌迅速形成根际生态优势、发挥抑菌作用的重要基础[9]。因此,分离筛选具有强竞争优势、能发挥高效生防作用的木霉菌株很有必要。
西瓜枯萎病在酸性和碱性土壤中均有发生,连作田中发病率更高[10]。研究表明,FON和木霉的生长均受环境pH的影响[11-12]。室内培养条件下,FON和木霉的最适生长pH范围分别为 4~9[13]和5.5~7.5[14]。土壤pH过高可导致FON和木霉的数量减少[15-16]。因此,环境pH直接影响生防木霉的防控效果。对羟基苯甲酸 (p-hydroxybenzoic acid,PHBA)是西瓜、水稻、甜瓜等多种作物根分泌物的重要组分[17-18]。西瓜连作可导致土壤中根分泌物积累,而对土壤微生物产生影响。研究表明,PHBA对FON的产孢、萌发及菌丝生长均具有“低浓度促进、高浓度抑制”作用[19]。ZHOU等[20]从营养角度探讨土壤中添加PHBA等有机物对木霉的影响,认为少量PHBA有提高土壤中木霉丰度的趋势。以上研究阐述了环境pH和PHBA对FON和木霉生长繁殖及拮抗效果的部分影响趋势,然而PHBA积累和pH双因素叠加对木霉生防效果的影响未见报道。
本研究对前期从宁夏西瓜根际土壤中分离的西瓜枯萎病生防木霉M3菌株进行鉴定,明确其分类地位;采用平板试验和盆栽试验,探明不同pH和PHBA质量浓度下FON和M3菌株的生长情况,明确pH与PHBA共同作用下M3菌株对FON的抑菌率及防病效果的变化规律,为研制高效的西瓜枯萎病生防菌剂及其有效应用奠定基础。
1 材料与方法
1.1 材 料
菌种:M3菌株和FON由宁夏大学农业微生物学实验室提供,分别从宁夏西瓜健康植株根际土壤和患病植株中分离获得。其中,FON经回接试验验证其为西瓜枯萎病病原菌,M3菌株为其拮抗菌。
培养基:马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基,用于菌种活化、对峙培养和菌种保藏;马铃薯葡萄糖(Potato dextrose,PDB)培养基,用于菌种液态发酵培养。
西瓜品种:‘金城五号’。
盆栽土壤:宁夏兴仁镇西瓜田旁边的非耕作土,取土深度距地表1~2 m,pH 8.3,过2 mm筛,备用。
1.2 方 法
1.2.1 M3菌株的分类鉴定 用PDA培养基 25 ℃,相对湿度65%倒置培养M3菌株,约6 d,菌丝长满平板(直径90 mm,下同),转接于新的PDA平板,25 ℃,RH 85%,12 h光照/12 h黑暗倒置培养5 d,观察菌株同心轮纹的有无、颜色及形态特征。镜检菌丝、孢子梗和孢子形态特征。鉴定依据为Rifai[21]和Bissett[22]修订的木霉种群分类系统。
取活化4 d的M3菌落组织,用SDS法提取DNA[23]。以提取的DNA为模板,选用ITS(TCCTCCGCTTATTGATATGC)、延伸因子TEF1(CATCGAGAAGTTCGAGAAGG)、RPB2(TTGKAAAGAARCGTCTGGAT)[24]对M3菌株进行PCR扩增。将PCR产物经1%琼脂糖凝胶电泳并凝胶成像,切胶回收DNA片段。纯化的PCR产物送北京六合华大基因科技有限公司测序,获得M3菌株ITS、TEF1和RPB2基因序列。利用NCBI(https://www.ncbi.nlm.nih.gov/)中木霉属基因信息,通过MEGAX软件比对并手工矫正,构建M3菌株的系统发育树,确定其分类地位。
1.2.2 pH和PHBA质量浓度对FON和M3菌落生长的影响 采用两因素多水平试验。用过滤除菌的1 mol·L-1NaOH和1 mol·L-1HCl将培养基pH分别调为5、6、7、8、9,添加PHBA使终质量浓度分别为0、50、100、200、400、800 mg·L-1,共制备30种梯度培养基。一部分用于最终pH的检测,其余制备梯度平板。在梯度平板中心打1个直径5 mm的孔,放入直径相同的M3或FON菌碟1个,28 ℃,RH 65%倒置培养60 h,测量菌落半径。每个处理设5个重复。
1.2.3 pH和PHBA质量浓度对M3菌株拮抗FON的影响 采用对峙培养试验。梯度平板制备方法同“1.2.2”。在梯度平板上打2个直径5 mm的孔,两孔相距3.5 cm,各放入1个FON和M3菌碟,培养条件同“1.2.2”。测量FON菌落半径,计算不同处理下M3菌株对FON的抑菌率。以不放M3菌碟为对照。每个处理设5个重复。抑菌率计算公式如下:
抑菌率=(对照FON菌株半径-对峙培养FON菌株半径)/对照FON菌株半径×100%
1.2.4 土壤pH和PHBA质量浓度对M3拮抗FON的影响 采用盆栽试验。将FON和M3菌株分别接种于PDB培养基,28 ℃,180 r·min-1培养5 d。血球计数板法检测孢子数量。用无菌水制备FON孢子悬液,浓度为6.7×103mL-1,M3孢子悬液浓度为107mL-1、108mL-1和109mL-1。土壤经121 ℃、30 min灭菌制成无菌土。用无菌 1 mol·L-1H2SO4和1 mol·L-1NaOH调节土壤pH分别为5、6、7、8、9,随后添加PHBA使土壤中PHBA质量浓度分别为0、50、100、200、400、800 mg·L-1,混合均匀。FON孢子悬液和无菌土以1∶1(质量比)混匀制成病菌土。M3孢子悬液和无菌土以1∶60(质量比)混匀制成M3接种土。每个营养钵(口径10 cm,底径 6.5 cm,高10 cm)装M3接种土300.0 g,均匀拌入病菌土3.0 g。每钵定植健康、1片真叶的西瓜幼苗1株。每7 d浇1次Hogland营养液4倍稀释液,每次每钵200.0 mL。根据土壤湿度,2~3 d每钵浇无菌水300.0 mL。保持充足光照,温度约20 ℃。每处理18株,培养30 d,记录瓜苗发病等级,计算发病率、病情指数和防治效果。
瓜苗发病等级标准:0级为茎内维管束内外无症状;1级为茎内维管束变色部分<25%;2级为茎内维管束变色部分25%~50%;3级为茎内维管束变色部分50%~75%;4级为茎内维管束变色部分>75%,部分叶片萎蔫;5级为整株萎蔫枯死。
发病率、病情指数和防治效果计算公式如下:
发病率=发病株数/调查总株数×100%
病情指数=∑(病级株数×代表数值)/(调查发病总株数×最高级值)×100
防治效果=(对照发病率-处理发病率)/对照发病率×100%
1.3 处理与统计分析
采用Microsoft Excel 2010软件处理数据并制作图表。采用SPSS 17.0统计软件进行方差分析和相关性分析,在P<0.05水平上进行差异显著性检验。
2 结果与分析
2.1 M3菌株的形态学鉴定
菌株生长迅速,初为白色,卷毛状菌丝。随着培养时间增加,产孢簇逐渐变为绿色,老熟时呈暗绿色;分生孢子梗瓶状,较细且稍有弯曲,分枝呈轮状排列,大多1~3轮,较短且无分枝(图1-a,1-b)。分生孢子浅绿色,壁光滑,椭球形,(2.5~3.5) μm×(2.2~3.0) μm(图1-c)。培养96 h,菌落出现墨绿色与白色相间的同心轮纹(图1-d),背面无色(图1-e)。培养7 d的菌落呈墨绿色,表面毡毯状,上有少量白色菌丝(图1-f)。依据形态特征,初步鉴定M3菌株为哈茨木霉(T.harzianum)。
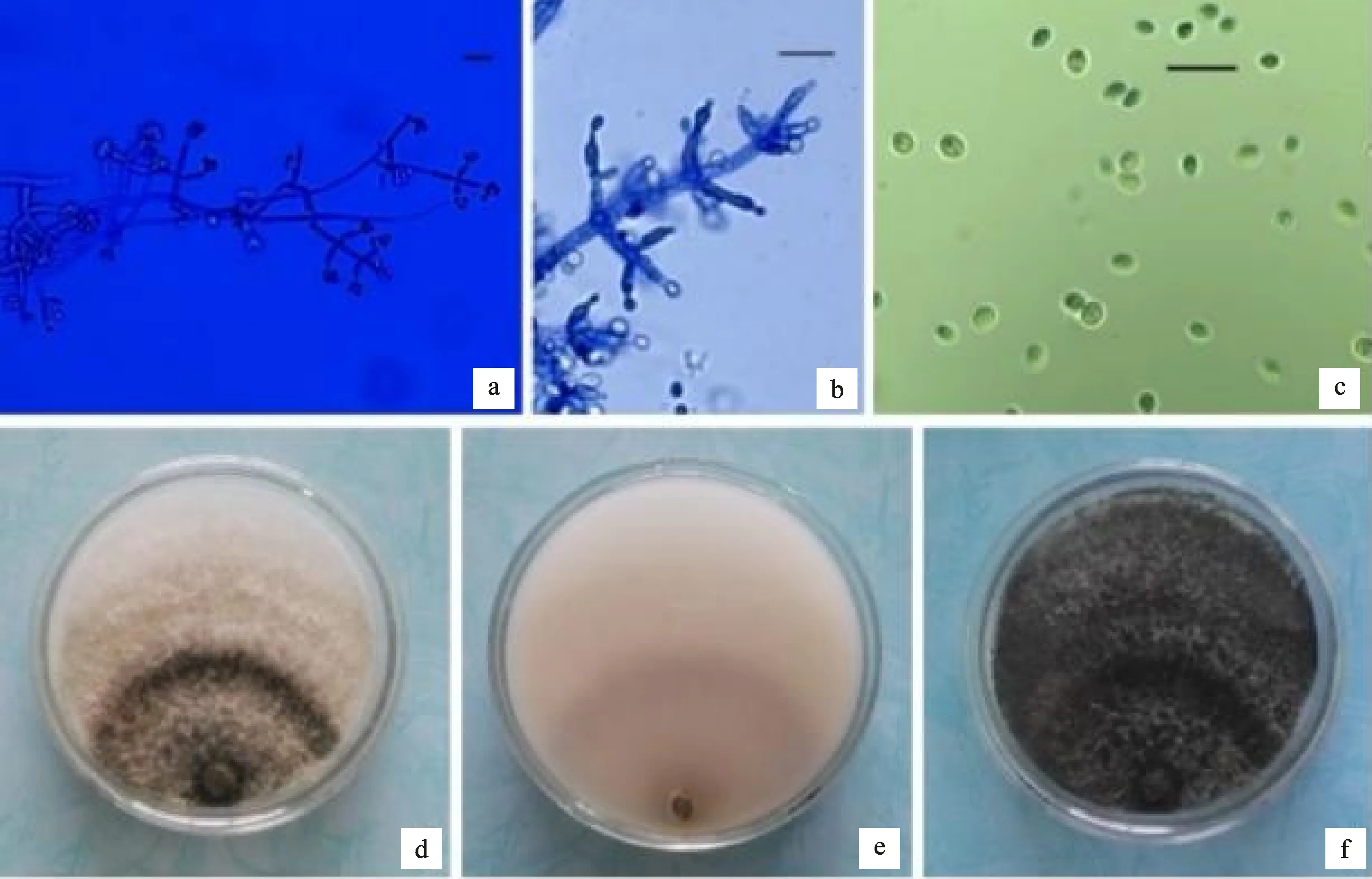
a、b.分生孢子梗;c.分生孢子;d.菌落正面(培养96 h);e.菌落背面(培养96 h);f.菌落正面(培养7 d);标尺为10 μm
2.2 M3菌株的分子生物学鉴定
将M3菌株ITS(登录号JX473715)、TEF1(登录号MT809679)及RPB2(登录号MT809710)序列在NCBI中进行比对,构建系统发育树如图2。M3菌株的ITS-TEF1-RPB2序列与哈茨木霉同源性达到100%。由此确定M3菌株为哈茨木霉。
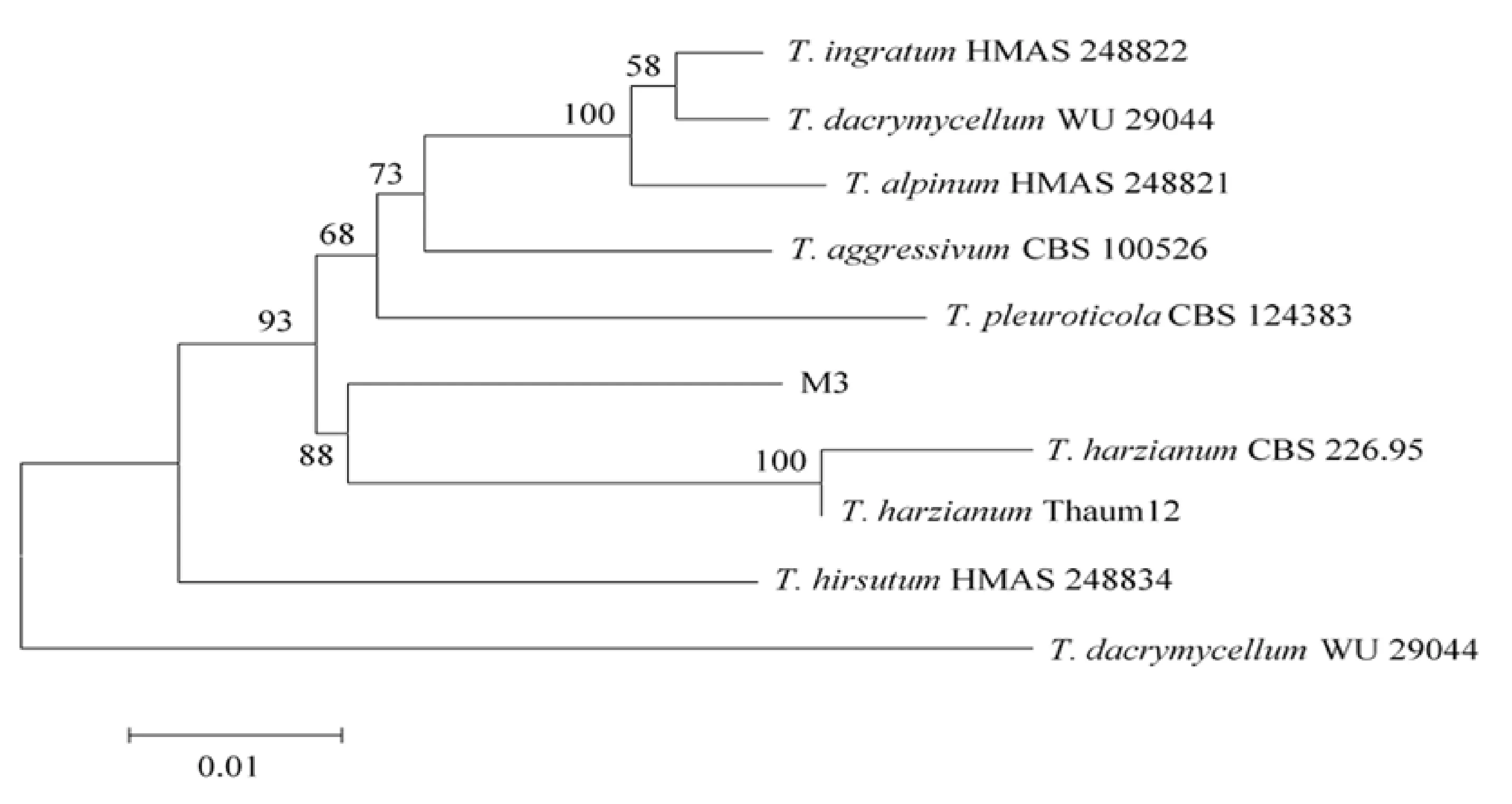
图2 基于M3菌株 ITS-TEF1-RPB2序列构建的系统发育树Fig. Phylogenetic tree of strain M3 based on ITS-TEF1-RPB2 sequence analysis
2.3 pH和PHBA质量浓度对FON和M3菌落生长的影响
PDA培养基初始pH 6.4。添加PHBA后,培养基pH与初始值相比未发生变化或变化不显著。因此,添加PHBA视为对培养基pH无影响。
如图3,培养基pH和PHBA质量浓度对FON和M3菌落生长具有不同影响。在PHBA质量浓度相同时,FON菌落半径由大至小为pH 8>pH 7>pH 9>pH 6>pH 5,M3菌落为pH 6>pH 5>pH 7>pH 8>pH 9。两菌株都存在最适生长pH,分别为8和6。当pH相同时,随着PHBA质量浓度增加,两菌的菌落半径均呈现先增加后降低的现象,但是菌落半径峰值对应的PHBA质量浓度不同。50 mg·L-1处理的FON和M3菌落半径较对应的CK分别增加1.64%~2.45%和0.62%~1.19%,100 mg·L-1处理分别增加3.84%~4.13%和1.58%~2.20%,200 mg·L-1处理分别增加6.56%~7.81%和 3.23%~3.93%,400 mg·L-1处理分别增加 -3.76%~-2.52%和6.56%~7.64%,800 mg·L-1处理分别增加-12.89%~-7.14%和 -7.19%~-5.04%。FON菌落在PHBA 200 mg·L-1处理中生长最佳,高于或低于该值的处理,菌落半径显著降低,且pH 5~9时变化趋势在各组内表现一致。M3菌株也有类似规律,但是其菌落在400 mg·L-1处理中生长最佳。由此可知,FON最适生长条件为pH 8,PHBA质量浓度200 mg·L-1;M3菌株最适生长条件为pH 6,PHBA质量浓度400 mg·L-1。说明M3菌株较FON更喜弱酸性环境,对PHBA积累环境的适应能力强于FON。
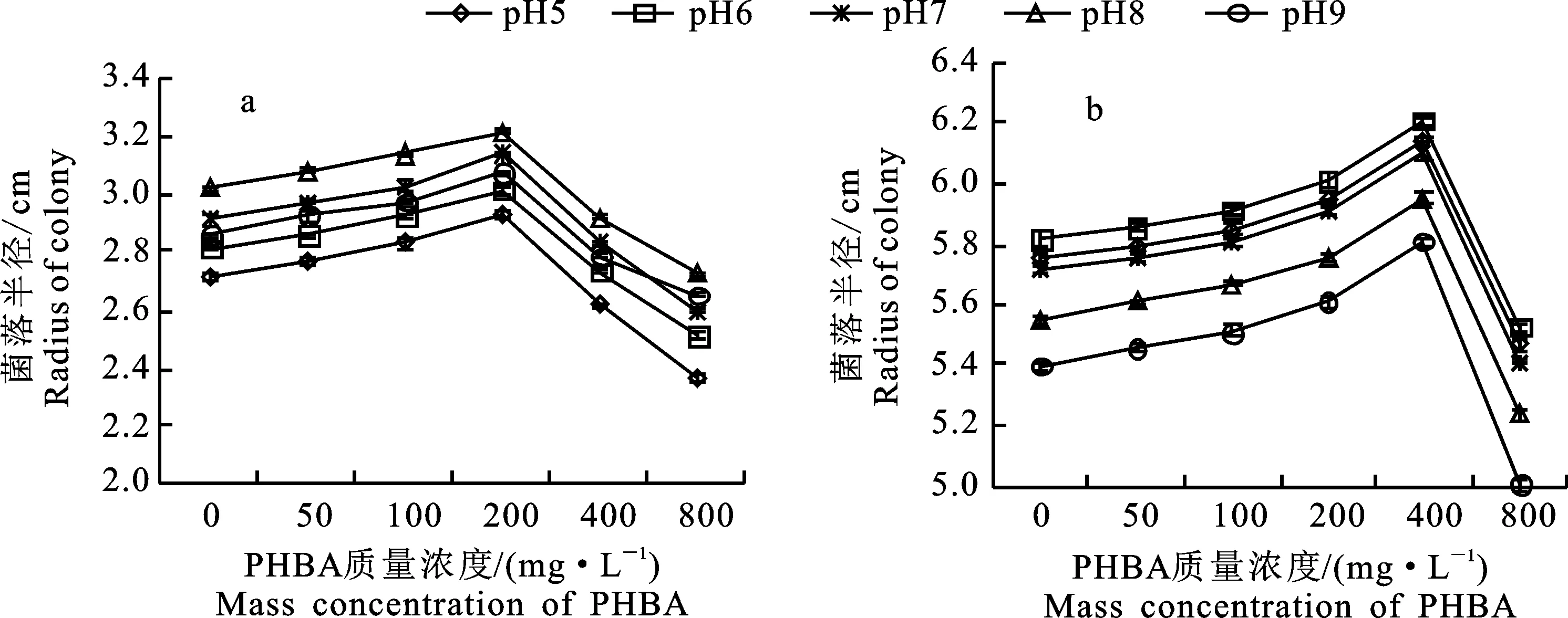
a.FON菌落半径;b.M3菌落半径a.FON colony radius; b.M3 colony radius
单独培养时,M3菌落的生长速度显著高于FON。在M3菌株生长最适宜的pH 6、400 mg·L-1处理中,M3菌落半径较FON多 127.11%,达3.47 cm(最高值);在FON生长最适宜的pH 8、200 mg·L-1处理中,M3菌落的半径仍然较FON多93.15%,为2.99 cm(最低值)。说明M3菌株在生长速度上较FON具有显著优势。
2.4 pH和PHBA质量浓度对M3拮抗FON的影响
将FON和M3菌株对峙培养,在pH、PHBA和M3菌株的共同作用下,FON菌落生长变化趋势与非对峙培养相似。如图4-a,FON菌落半径的峰值仍然位于200 mg·L-1,且pH 8最有利于FON生长。但是在M3菌落的影响下,FON生长受到显著抑制。pH 8、200 mg·L-1处理的菌落半径峰值仅为1.20 cm,较对应的单独培养降低62.62%;pH 5、800 mg·L-1处理的菌落半径最低,仅为0.85 cm,较单独培养降低 64.14%。由图4-b可知,在pH 5~9、PHBA质量浓度0~800 mg·L-1时,M3菌株对FON的抑菌率为62.60%~65.80%,没有显著波动。说明pH和PHBA共同作用下,M3菌株的抑菌率无显著变化。

图4 不同pH和PHBA质量浓度对M3菌株拮抗FON的作用Fig.4 M3 antagonizing FON under effects of pH and PHBA mass concentration
2.5 土壤pH和PHBA质量浓度对M3生防效果的影响
由表1可知,不同土壤pH和PHBA质量浓度影响下植株的发病率、病情指数具有差异,M3菌株对西瓜枯萎病的防治效果也不同。pH 9、未添加PHBA与pH 8、800 mg·L-1两个处理的发病率最高,均为77.78%。以pH 9、未添加PHBA为对照,计算其他各处理的防治效果。经对比可知,除pH 6外,在同一pH组中,PHBA 400mg·L-1处理的植株发病率和病情指数均为最低,M3菌株的防治效果均为最高。在pH 6组中,除高质量浓度800 mg·L-1显著影响防治效果外,其他各处理均具有最高水平的防治效果,达85.72%。在pH 8~9组中,未添加PHBA及800 mg·L-1处理的植株发病率、病情指数均为组内较高水平,而M3菌株的防治效果均为组内较低水平。

表1 不同土壤pH和PHBA质量浓度下M3菌株对西瓜枯萎病的防治效果Table 1 Control effect of M3 on watermelon wilt under different soil pH and PHBA mass concentration

表2 土壤pH和PHBA质量浓度与M3菌株防治效果的相关性Table 2 Correlation analysis of soil pH and PHBA mass concentration and control effect of M3
2.6 土壤pH和PHBA质量浓度与M3菌株防治效果的相关性分析
根据皮尔逊相关性分析可知,土壤pH与发病率、病情指数和防治效果均具有极显著相关性,即pH越高,枯萎病发病率和病情指数越高,而防治效果越受到抑制。PHBA质量浓度与病情指数具有显著相关性,但是与发病率和防治效果的相关性不显著。由此可知,M3菌株的防治效果主要受土壤pH的影响;PHBA的积累主要影响病情指数。
3 讨 论
本研究明确了真菌M3菌株为哈茨木霉。利用哈茨木霉防治西瓜枯萎病一直被学者们所关注[25]。田程等[26]分离获得一株对西瓜枯萎病菌具有生防作用的哈茨木霉T2-16,抑菌率 60.00%。木霉菌的菌丝体通常生长迅速,有利于与病原菌进行空间和营养竞争[27]。在本研究中,M3菌株表现出较强的竞争能力,于不同pH和PHBA含量的环境中,其生长速率均显著高于FON,使FON菌落半径较CK减少62.60%~65.80%,表明M3菌株具有较强的竞争优势,对FON具有较好的抑菌能力。
环境pH作为非营养因素可直接影响真菌的生长、繁殖及与其他生物的关系[28]。通常,木霉和尖镰孢菌生长的最适pH分别为3~7和 4~9[29-30]。本研究获得与此相似的结论,哈茨木霉M3菌株和FON的最适pH分别为6和8,为在实际生产环境中利用M3菌株开展生物防治提供了依据。
PHBA是植物根系分泌的一种酚酸类物质,可以被微生物分解利用[31]。郝文雅等[17]研究表明,PHBA对FON菌丝生长、产孢和孢子萌发具有促进作用,其最适PHBA质量浓度为400~800 mg·L-1。本研究获得相似的结论,FON菌株生长具有最适PHBA质量浓度,但该菌株为200 mg·L-1,可能是不同菌株生物学特性差异所致。同时,研究发现PHBA对哈茨木霉M3的菌丝生长具有低浓度促进、高浓度抑制的作用,最适PHBA质量浓度400 mg·L-1。Chen等[32]认为哈茨木霉对PHBA具有较强的降解能力。对比可知,哈茨木霉M3菌落生长的最适PHBA质量浓度显著高于FON,说明其对PHBA积累环境具有较好的耐受性。这可能与M3菌株对PHBA的降解和利用能力较强有关。哈茨木霉和病原菌对PHBA利用能力差异性的机制研究有待进一步探索。
连作土壤环境复杂。土壤中根系分泌物PHBA积累与pH共同作用于根系和根际微生物,故考虑两种因素对生防木霉的叠加作用。作为探索,试验设计的PHBA质量浓度范围涵盖并超过实际连作土壤的情况[33],但是M3菌株的抑菌率几乎未受PHBA质量浓度变化的影响。盆栽试验验证了室内研究结果,M3菌株在土壤pH 6、PHBA质量浓度低于800 mg·L-1的环境中对西瓜枯萎病的防治效果最佳。Abeyratne等[34]研究表明土壤pH为6时,木霉产生大量抗真菌化合物如几丁质酶等,形成较强的拮抗能力,对植株幼苗生防效果最佳。但是,随着土壤pH增加,M3对西瓜枯萎病的防治效果有降低趋势。可能在高pH土壤中,木霉调节转运蛋白、信号相关蛋白、胞外酶和参与各种代谢反应的蛋白质的基因,降低了木聚糖酶、纤维素酶和半纤维素酶等的活性,并阻碍膜运输蛋白的运输能力,影响了其对病原菌的防治效果[35]。相关性分析也表明,土壤pH较PHBA对M3生防效果的影响更为显著。因此,酸性土壤条件更有利于M3菌株的生防 作用。
研究表明,土壤pH增加可促进镰孢菌对植株的侵染,导致植株发病率增高[36]。本研究发现,pH 8、PHBA 800 mg·L-1和pH 9、未添加PHBA两组处理的发病率最高,并非预期的pH 8、200 mg·L-1。说明在植株根际环境,FON对植株的侵染主要受土壤pH的影响。原因可能是土壤pH诱导FON产生胞外酶降解植物细胞壁,同时促进蛋白酶、脂肪酶等毒力因子的分泌,致使植株发病率升高[37]。PHBA对西瓜枯萎病病情指数具有一定影响,相关机制有待深入研究。
4 结 论
经形态学和分子生物学鉴定,确定M3菌株为哈茨木霉。在培养基中,M3菌株和FON均存在最适pH和最适PHBA质量浓度,分别为6、400 mg·L-1和8、200 mg·L-1。在pH和PHBA共同作用下,M3菌株对FON的抑菌率稳定在62.60%~65.80%;土壤环境中,M3对西瓜枯萎病的防治效果达85.72%,主要受环境pH的影响。总之,该菌株具有较好的生防应用潜力,研究结果为相关菌剂的研制与应用奠定了基础。

