香茅醛对金黄色葡萄球菌的抑制作用
张卯,张业辉,李惠,肖性龙,余以刚*
(1.华南理工大学食品科学与工程学院,广东广州 510640)(2.广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东广州 510610)
金黄色葡萄球菌(Staphylococcus aureus,S.aureus)是一种常见的食源性致病菌,属于革兰氏阳性菌,广泛分布于自然界中,在水、空气、土壤、灰尘中都可发现,约20%的健康人群持续携带[1]。S.aureus具有强致病性,可引起肺炎、假膜性肠炎、心包炎、败血症等多种疾病[2]。此外,S.aureus具有耐高温性及耐盐性,在食品中易生长繁殖,消费者在食用被S.aureus污染的食物后容易引起以呕吐,腹泻为主要症状的食物中毒反应[3]。2020年,欧盟报告了由S.aureu导致的食源性疾病爆发共43次,造成402人次感染[4]。可见,食品中的S.aureus污染已成为世界范围内食源性疾病爆发的重要原因之一[5]。因此,寻找有效抑制食品中S.aureus生长的方法,从而提高食品货架期和食品质量安全是非常有意义的。
近年来,天然抗菌剂如精油、酚类、醛类等天然化合物及其衍生物因其来源广泛和广谱抗菌的特性成为研究焦点。香茅醛(Citronellal,CIT)是一种含氧单帖醛类化合物,其作为一种天然物质广泛存在于香辛料及植物精油中,已被纳入我国《食品安全国家标准食品添加剂使用标准》(GB 2760-2014)作为香辛料使用。CIT具有杀虫、抗氧化、免疫调节等多种生物功能[6]。且已有部分研究表明,CIT具有抗菌活性。Choi等[7]研究发现CIT对蜡状芽孢杆菌、单核增生李斯特菌等具有良好的抗菌效应,其对蜡状芽孢杆菌的最小抑菌浓度(MIC)仅为1.25 μg/mL。此外CIT还具有显著的抗真菌作用[8]。虽然前人已经描述了 CIT的活性功能,但对CIT对S.aureus的抑菌活性及作用方式知之甚少。因此,本文研究了CIT对S.aureus的抑菌活性及作用方式,以期为扩大CIT在食品工业中的应用,保障食品安全提供理论依据。
1 材料与方法
1.1 材料与主要试剂
S.aureus(ATCC 6538)由华南理工大学食品科学与工程学院食品安全与检测实验室提供。胰酪大豆胨液体培养基(TSB)、胰酪大豆胨琼脂培养基(TSA),购于广东环凯微生物科技有限公司;细菌基因组DNA提取试剂盒购于天根生化科技有限公司。
1.2 主要仪器与设备
En Spire酶标仪,美国Perkinelmer公司;S-3700N扫描电子显微镜,德国蔡司公司;KDC-40恒温培养箱,科大创新股份有限公司中佳分公司;SHZ-88A高温高压灭菌锅,江苏太仓市实验设备厂;超净工作台,上海博讯实业有限公司;Z-2000原子吸收分光光度计,日本日立;GelDoc XR+凝胶成像仪,美国伯乐Bio-rad公司。
1.3 实验方法
1.3.1 金黄色葡萄球菌菌悬液的制备
S.aureus菌种在TSA平板上于37 ℃培养24 h活化,挑取单菌落于 TSB中培养至稳定期,无菌 TSB调整菌悬液至合适浓度,用于下述实验。
1.3.2 香茅醛对金黄色葡萄球菌的最小抑菌浓度及最小杀菌浓度的测定
采用微量肉汤梯度稀释法测定CIT对S.aureus的MIC。在96孔板每孔中加入100 μL无菌TSB后,在第一孔中加入100 μL CIT母液(25.60 mg/mL),充分吸打混匀,移取100 μL混合液于下一孔中进行连续2倍稀释。稀释完成后,加入 100 μL菌悬液(~6 log CFU/mL)充分混匀,得到CIT终浓度为6.40、3.20、1.60、0.80、0.40、0.20、0.10、0.05 mg/mL 的系列培养体系。其中,未加菌悬液的孔为阳性对照,不含CIT的孔为阴性对照。上述混合物在37 ℃下孵育 24 h,无可见菌体生长的最小 CIT浓度被定义为MIC值[9]。分别从上述无肉眼可见菌体生长的孔中取100 μL混合菌液加入20 mL TSB培养基中,摇床培养24 h,无肉眼可见菌体生长的最小CIT浓度为MBC值。
1.3.3 香茅醛对金黄色葡萄球菌的杀菌曲线的测定
CIT对 S.aureus的时间-杀菌曲线参考 Pobiega等[10]的方法进行测定。将CIT溶液与S.aureus菌悬液(~6 log CFU/mL)混合均匀,使 CIT最终浓度为1/2 MIC、1 MIC和2 MIC。未加CIT溶液的体系为对照组(CK)。将上述混合物置于摇床中培养24 h(37 ℃,180 r/min)。分别在0、0.5、1、2、4、6、8、12、24 h时取样。生理盐水梯度稀释后,取合适梯度样品接种于TSA平板上,37 ℃培养24 h后计数。绘制时间-杀菌曲线。
1.3.4 胞外K+浓度测定
胞外K+浓度测定参考Cao等[11]的方法进行适当修改。取5 mL菌悬液(~8 log CFU/mL)离心后收集菌体沉淀。用无菌生理盐水洗涤菌体2次后,重悬于50 mL含有不同浓度CIT的生理盐水,使CIT最终浓度为1/8 MIC、1/4 MIC和3/8 MIC。未加CIT溶液的体系为对照组(CK)。将上述混合物置于摇床中培养8 h。分别在0、0.5、1、2、4、6、8 h时取样,离心后取上清液过0.22 μm滤膜待测。使用原子吸收分光光度计测定样品中的K+浓度。
1.3.5 碘化丙啶(PI)染色实验
参照Wu等[12]的方法进行碘化丙啶(PI)染色实验。取5 mL菌悬液(~8 log CFU/mL)离心后弃去上清液。菌体沉淀用等量生理盐水清洗 2次后重悬于5 mL含有不同浓度CIT的PBS缓冲液(0.1 mmol/L,pH值7.2),混合均匀,得到CIT终浓度为1/4 MIC、1/2 MIC、1 MIC和2 MIC的混合体系。未加CIT溶液的体系为对照组(CK)。将上述混合物 37 ℃孵育4 h。孵育后,将样品离心,菌体沉淀用生理盐水清洗2次,重悬于5 mL PBS缓冲液中。随后,加入PI染液(1 mg/mL),混合均匀,37 ℃避光孵育30 min。随后,使用酶标仪在495 nm激发波长和625 nm发射波长下测定荧光光谱。
1.3.6 香茅醛对金黄色葡萄球菌细胞形态的影响
使用扫描电子显微镜观察CIT处理下S.aureus细胞形态的变化。参考Wang等[13]的方法,取1 mL菌液(~8 log CFU/mL),离心后弃去上清液,加入1 mL含CIT的PBS缓冲液重悬菌体沉淀,得到CIT终浓度为1/2 MIC、1 MIC和2 MIC的培养体系。不含CIT的体系为对照组。将上述混合物37 ℃孵育8 h。孵育后,离心,菌体沉淀用PBS缓冲液清洗2次。重悬于1 mL 2.5%戊二醛溶液,4 ℃过夜固定。随后,将固定后的菌悬液离心弃去上清液,PBS缓冲液清洗2次。按φ=10%、30%、50%、70%、90%的乙醇溶液浓度顺序梯度脱水,最后用1 mL 100%乙醇重悬菌体沉淀。取扫描电子显微镜载物台,贴导电胶,将盖玻片贴于导电胶上,取5 μL菌液于盖玻片上,晾干,喷金,扫描电镜下观察。
1.3.7 香茅醛对金黄色葡萄球菌DNA的影响
使用细菌基因组DNA提取试剂盒提取S.aureus基因组DNA。采用琼脂糖凝胶电泳及紫外可见光光谱的测定来探究CIT处理对S.aureus基因组DNA的影响。将 GelRed荧光染料与琼脂糖溶液混合后制胶。S.aureus基因组DNA溶液与不同浓度的CIT溶液等体积混合后,避光孵育30 min,然后在琼脂糖凝胶上进行电泳分离DNA片段。使用凝胶成像仪观察DNA条带。使用TE Buffer对基因组DNA进行2倍梯度稀释。取200 μL CIT溶液(0.69×10-2mmol/L)与等体积不同浓度的DNA溶液混合均匀。37 ℃孵育30 min。不含 DNA溶液的为对照组(CK)。使用紫外可见分光光度计测定基因组DNA片段与CIT混合液的紫外吸收光谱。
1.4 数据处理
所有的实验均重复三次。使用IBM SPSS Statistics 25软件对数据进行统计学意义分析。数据的处理采用单因素方差分析和Duncan多重比较。p<0.05有统计学意义。
2 结果与讨论
2.1 香茅醛对金黄色葡萄球菌的抑菌活性
CIT对S.aureus的 MIC和 MBC值均为0.80 mg/mL。Srisukh等[14]报道,CIT对3株S.aureus的MIC为1.10 mg/mL,与本研究的结果相似。抑菌物质的抑菌活性可能与其结构有关。含氧单萜被认为是精油中主要的抑菌活性成分之一,抗菌活性较高的唇形科精油中含有大量的含氧单萜[15,16]。此外,菊科植物精油中包括CIT在内的非芳香单萜已被证明具有比精油更高的抑菌活性[17]。
2.2 香茅醛对金黄色葡萄球菌的时间-杀菌曲线
CIT对S.aureus的抑菌效果可通过 CIT对S.aureus的作用速度来反映。CIT处理对S.aureus的时间-杀菌曲线如图1所示。在 24 h内,CK组的S.aureus活菌数随着培养时间的延长而持续增加,在24 h后达到9.66 log CFU/mL。在1/2 MIC浓度的CIT处理下,随着培养时间的延长,S.aureus的活细胞数量呈现先减少后增加的趋势,且在处理 24 h后,S.aureus活细胞数量达到9.31 log CFU/mL,与CK组相比,没有明显差异,说明0.5 mg/mL浓度的CIT不足以抑制S.aureus的生长。而在1 MIC浓度处理下,S.aureus活菌数量随培养时间的延长而迅速下降,2 h后S.aureus活菌数量与初始值相比减少约1.74 log CFU/mL,与 CK组的差值约为2.66 log CFU/mL,4 h后检测不到活菌。CIT在2 MIC浓度下,在0.5 h内对S.aureus具有完全抑制作用。结果表明,CIT对S.aureus有快速杀菌作用。郭丹[18]探究了包括CIT在内的11种天然化合物及其衍生物对四种食品腐败菌(大肠杆菌、S.aureus、表皮葡萄球菌、绿脓杆菌)的抑制作用,发现CIT对四种食品腐败菌均具有良好的抑制效果,与其他10种化合物相比,CIT对S.aureus的抑制效果最好。因此,有必要进一步探究CIT对S.aureus的作用方式。
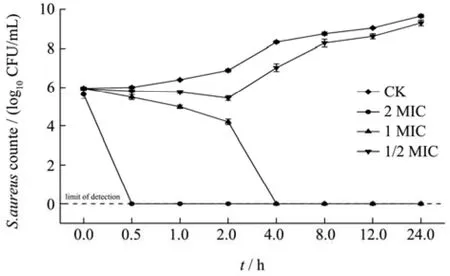
图1 CIT处理对S.aureus的时间-杀菌曲线Fig.1 The time-kill curves of S.aureus treated with CIT
2.3 香茅醛处理对金黄色葡萄球菌的膜损伤作用
天然抑菌化合物可以通过非特异性结合膜或特异性靶点如膜蛋白和膜脂改变细胞膜的通透性,导致胞内大分子及小分子的泄露,进而导致细胞死亡[19]。胞外K+浓度的变化可以反映出胞内小分子的泄露情况。PI作为一种核酸染色剂,只能穿透细胞膜受损的细胞与核酸结合,导致荧光强度增加[20],PI与DNA相互作用引起的荧光强度的差异可以评估细胞内大分子的泄露情况。
胞外K+泄露实验结果如图2a所示。S.aureus培养上清液中K+初始浓度约为0.41 mg/L。随着培养时间的延长,CK组的K+浓度缓慢上升,8 h后达到1.85 mg/L。而经1/4 MIC及3/8 MIC浓度的CIT处理后,上清液中的K+浓度急剧增加,8 h后1/4 MIC及3/8 MIC处理组的K+浓度上升到2.54 mg/L和2.63 mg/L,与对照组相比,分别升高0.69 mg/L和0.78 mg/L,具有显著性差异(p<0.05)。表明CIT处理会影响细胞膜通透性导致胞内小分子物质泄出量增加。不同浓度CIT处理下,PI染色实验结果如图2b所示。PI在620 nm处发射出最大荧光强度,CK组的荧光强度为1 049.48 A.U.,经 1 MIC及 2 MIC处理组的荧光强度分别为1 446.40 A.U.和6 376.31 A.U.,与对照组相比,分别升高了396.92 A.U.和5 326.83 A.U.。可见经2 MIC浓度的CIT处理后,荧光强度远高于CK组,说明该处理组S.aureus的细胞膜遭到破坏,DNA大量泄出并与PI结合,导致荧光强度升高。枯茗醛处理S.aureus也会导致PI荧光强度显著增加[21]。此外,Du等[22]研究发现,在2 MIC植物乳杆菌素GZ1-27处理下,耐甲氧西林S.aureus培养上清液中K+的渗漏量在60 min达到峰值并趋于稳定,最大泄出量为0.90 mg/mL,比对照组升高0.80 mg/mL,说明GZ1-27可以增加细菌细胞膜的通透性,从而导致 K+的外泄。而该研究中K+泄出浓度远高于本研究,可能是抑菌剂浓度不同导致的差异。实验结果表明CIT可以引起S.aureus膜损伤,导致胞内小分子及大分子物质泄出。
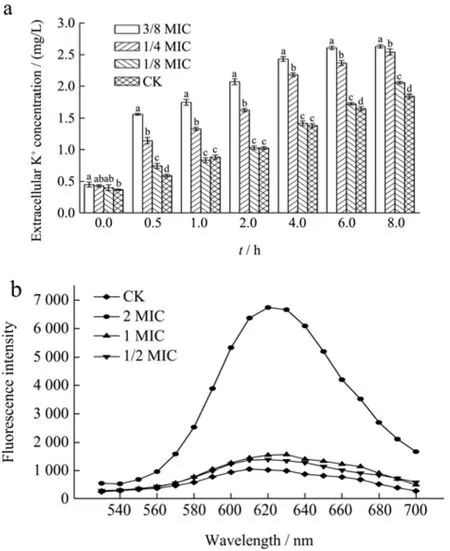
图2 a:CIT对S.aureus细胞上清液K+浓度的影响;b:CIT处理下,PI与S.aureus基因组DNA相互作用的荧光光谱Fig.2 a: Effects of CIT on K+ concentrations in supernatant of S.aureus cells; b: Fluorescence spectra of interaction between PI and S.aureus genomic DNA treated by CIT
2.4 香茅醛处理对金黄色葡萄球菌细胞形态的影响
经CIT处理后的S.aureus的细胞形态变化如图3所示。对照组的细胞表面完整光滑,排列紧密成葡萄串状,具有正常的细胞形态。经CIT处理后,细胞形态发生明显的改变。1/2 MIC处理下大部分细胞形态与对照组一致,表面完整光滑,少部分细胞表面完整但出现凹陷。随着CIT处理浓度的升高,1 MIC处理下,细胞变形更严重,大部分细胞出现皱缩及塌陷,一部分细胞膜出现破损。而暴露于2 MIC浓度下的细胞出现大面积破损,细胞呈现聚集粘连状态,细胞周围出现大量絮状物,细胞内容物完全泄出。研究表明,抑菌剂穿透细胞膜的难易程度与其亲脂性密切相关,如类黄酮的亲脂性是其抗革兰氏阳性菌的关键因素[23]。CIT作为一种小分子天然醛,具有很强的亲脂性,更容易穿透细胞膜,增强其在生物体内的生物活性。肉桂醛处理S.aureus也出现了类似的情况,经肉桂醛处理后的S.aureus,细胞形态因皱缩和变形而发生改变,部分S.aureus细胞还发生了分裂[24]。此外,Cao等[25]研究发现柠檬醛处理可导致副溶血性弧菌细胞破裂。上述实验结果及研究表明,CIT处理可以造成S.aureus的细胞形态改变,导致细胞破裂,且随着CIT浓度的增加,细胞膜损伤也越严重。这些结果也与之前的膜损伤实验结果一致,进一步证明CIT可通过影响细菌细胞膜的功能与结构发挥抑菌效果。
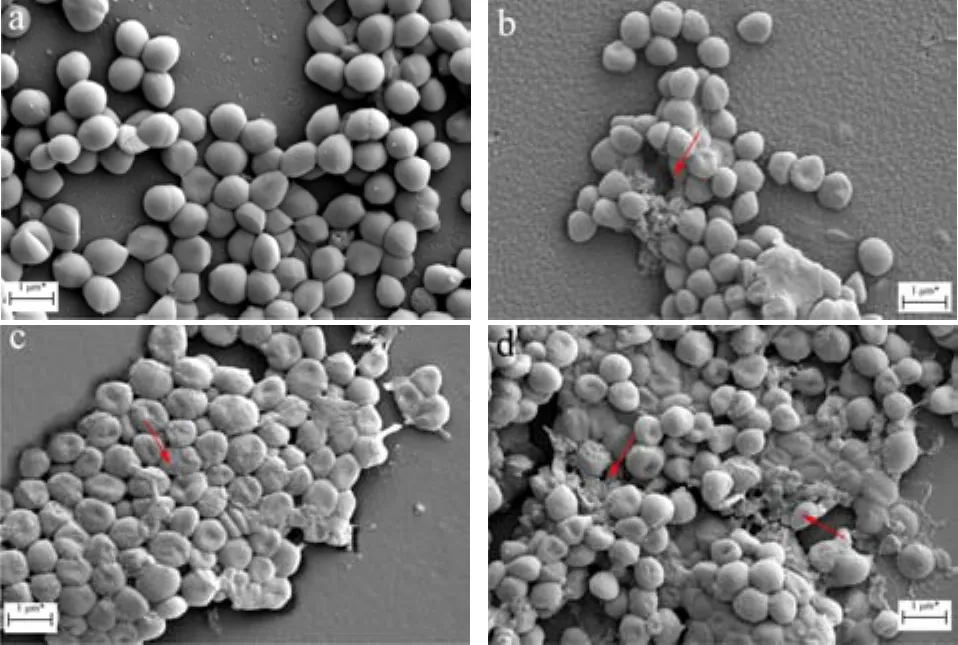
图3 不同浓度CIT处理对S.aureus细胞形态的影响Fig.3 Effects on the morphology of S.aureus cells treated by different concentrations of CIT
2.5 香茅醛与金黄色葡萄球菌基因组DNA相互作用的方式
CIT除作用于细菌细胞膜外,还可能作用于细胞内大分子物质如DNA,通过改变DNA结构进而影响其生物活性,达到抑菌效果。如图4a所示,随着CIT浓度的增加,DNA条带无明显改变。表明CIT不能直接导致基因组 DNA片段断裂。小分子化合物与DNA的非共价键结合主要分为两种主要模式,即嵌入模式和沟槽结合[26]。图4b为CIT与S.aureus基因组DNA相互作用的紫外光谱图,如图所示,CIT在259 nm处有一吸收峰,随着体系中DNA的量逐渐增大,吸收峰也随之增大,分别为0.12 A.U.、0.16 A.U.、0.24 A.U.、0.35 A.U.和 0.57 A.U.,最大差值为 0.45 A.U.,没有明显的红移或者蓝移现象发生,但有明显的增色现象。一般情况下,小分子化合物与DNA的相互作用会导致紫外吸收带出现红移或蓝移现象,产生减色或增色效果。研究表明,当小分子与DNA沟槽紧密结合时,会破坏DNA双螺旋结构,导致DNA双螺旋结构部分解旋,碱基暴露,紫外吸收带则会产生增色效应[27]。由此推测,CIT可能通过沟槽结合模式与S.aureus基因组DNA相互作用,改变DNA结构。Wang等[28]发现百里香酚也可与S.aureus基因组DNA的小沟结合并诱导DNA分子聚集。而Hu等[29]的研究发现,柠檬醛与耐甲氧西林S.aureus基因组DNA作用后,添加2 μL和4 μL DNA的样品的相关峰强度分别下降了7.37%和22.20%,与本文实验结果相反,这可能是由于柠檬醛与DNA之间的结合方式不同。减色效应、吸收带红移现象被认为是小分子嵌插到DNA双螺旋结构中,并与碱基相互作用所导致的[30]。
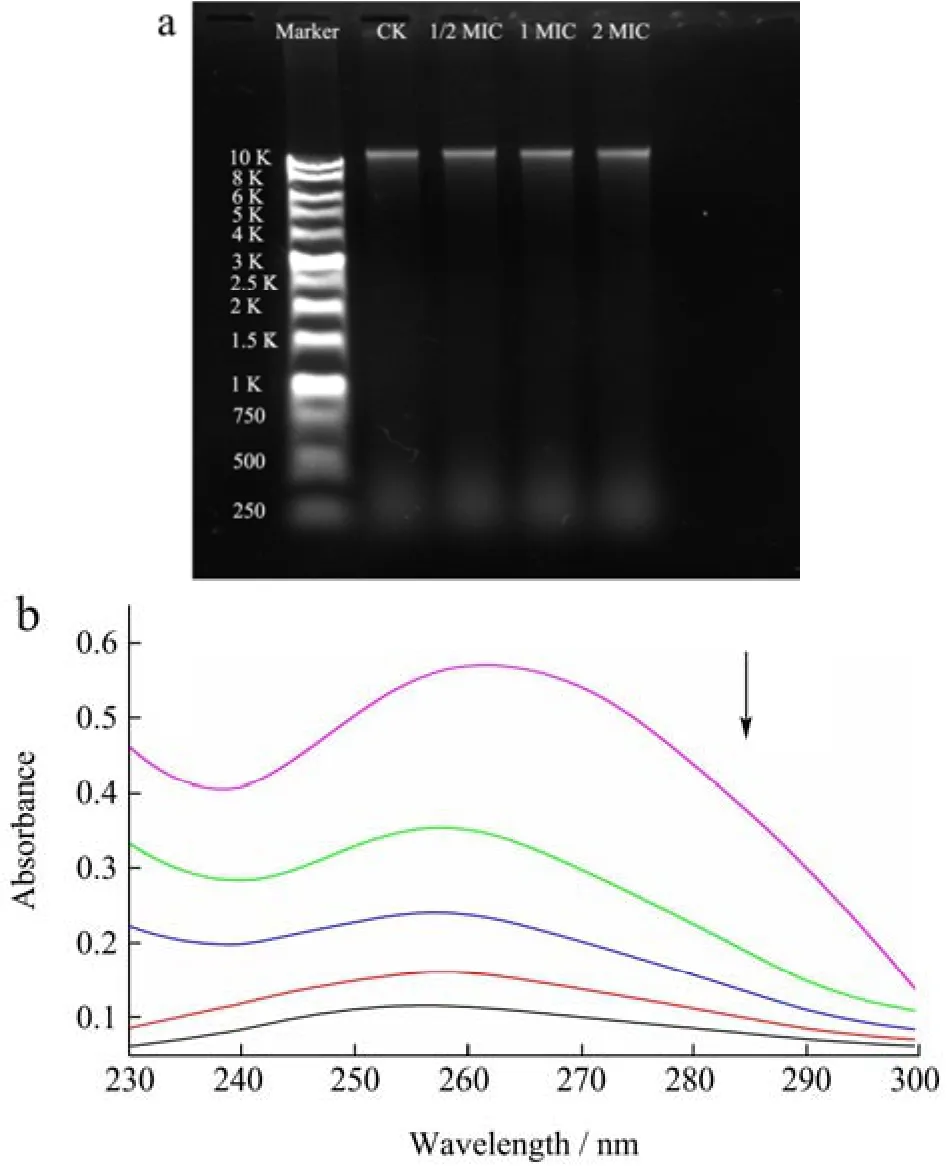
图4 CIT与S.aureus基因组DNA作用方式Fig.4 Interaction between CIT and S.aureus genomic DNA
3 结论
本文研究了CIT对S.aureus的抑菌效果。结果发现CIT对S.aureus有较强的快速杀菌作用。经CIT处理后,S.aureus的细胞膜通透性显著降低,胞内小分子及大分子物质泄出量显著增加,细胞形态结构及细胞膜完整性遭到严重破坏,影响S.aureus的正常生理代谢活动,进而导致其死亡。CIT除作用于细菌细胞膜外,还可作用于细胞内大分子物质DNA,CIT可能通过沟槽结合,改变DNA结构,干扰DNA的正常生物功能,从而抑制细胞生长甚至导致细胞死亡。本研究为扩大CIT在食品工业中的应用提供了理论基础。

