虎杖煮散工艺研究
朱树强 卢 泳,2 甘国兴,2 蔡燕华
1.广东省清远市中医院,广东 清远 511500;2.广东省鲜药民族医药工程技术研究中心,广东 清远 511500
虎杖是蓼科植物虎杖PolygonumcuspidatumSieb.et Zucc.的干燥根茎和根,具有利湿退黄、清热解毒、散瘀止痛、止咳化痰等功效[1]。近年来,研究发现虎杖的主要药效成分为虎杖苷、白藜芦醇、大黄素和大黄素甲醚,具有抗细菌、抗真菌、抗病毒活性,对心肌损伤有一定的保护作用[2-3]。随着广大人民群众越来越接受中医药,中药材的使用量不断增加,中药材特别是道地中药材的供应出现了短缺。煮散是将饮片经粉碎加工为粗粉后与水共煮去渣取汁而成,具有节省药材、节省煎煮时间、方便患者使用的优点,能缓解医院中药代煎候药时间较长、中药饮片费用高等问题[4]。本文将考察虎杖煮散工艺的主要影响因素,为其优选安全有效的煮散工艺,探索虎杖煮散饮片的科学性,为虎杖饮片形态改革提供一种新的思路。
1 仪器与试药
1.1 仪器 高效液相色谱仪:Waters e2695液相色谱仪,2489UV紫外检测器,Empower3数据分析软件(美国沃特世公司);梅特勒-托利多电子分析天平(梅特勒-托利多公司);PS-100A型超声波清洗器(东莞市洁康超声波设备有限公司);TG16-WS型高速台式离心机(湖南湘仪实验室仪器开发有限公司);电热恒温鼓风干燥箱XMTD-8222(上海精宏)。
1.2 试药与试剂 虎杖饮片(广州市志宁药业有限公司,产地:安徽;批号:180801),经清远市中医院药学部黄玉明副主任中药师鉴定为虎杖正品饮片。虎杖苷对照品(批号:111575-201603;含量:87.3%),大黄素对照品(批号:110756-201913;含量:96.0%),购于中国食品药品检定研究院。色谱纯乙腈(德国 Merk 公司),分析纯甲醇和甲酸(广州化学试剂厂),蒸馏水。
2 方法与结果
2.1 虎杖苷和大黄素含量测定方法的建立
2.1.1 色谱条件 色谱柱:phenomenex Kinetex® XB-C18(4.6 mm×250 mm,5 μm);流动相:乙腈(A)-0.1%甲酸(B),梯度洗脱:0~15 min,15%~20%A;15~25 min,20%~40%A;25~38 min,40%~60%A ;38~43 min,60%A;43~45 min,60%~15%A;45~53 min,15%A;流速1.0 mL·min-1;检测波长254 m和306 nm;柱温35 ℃;进样量:10 μL。色谱图如图1所示。
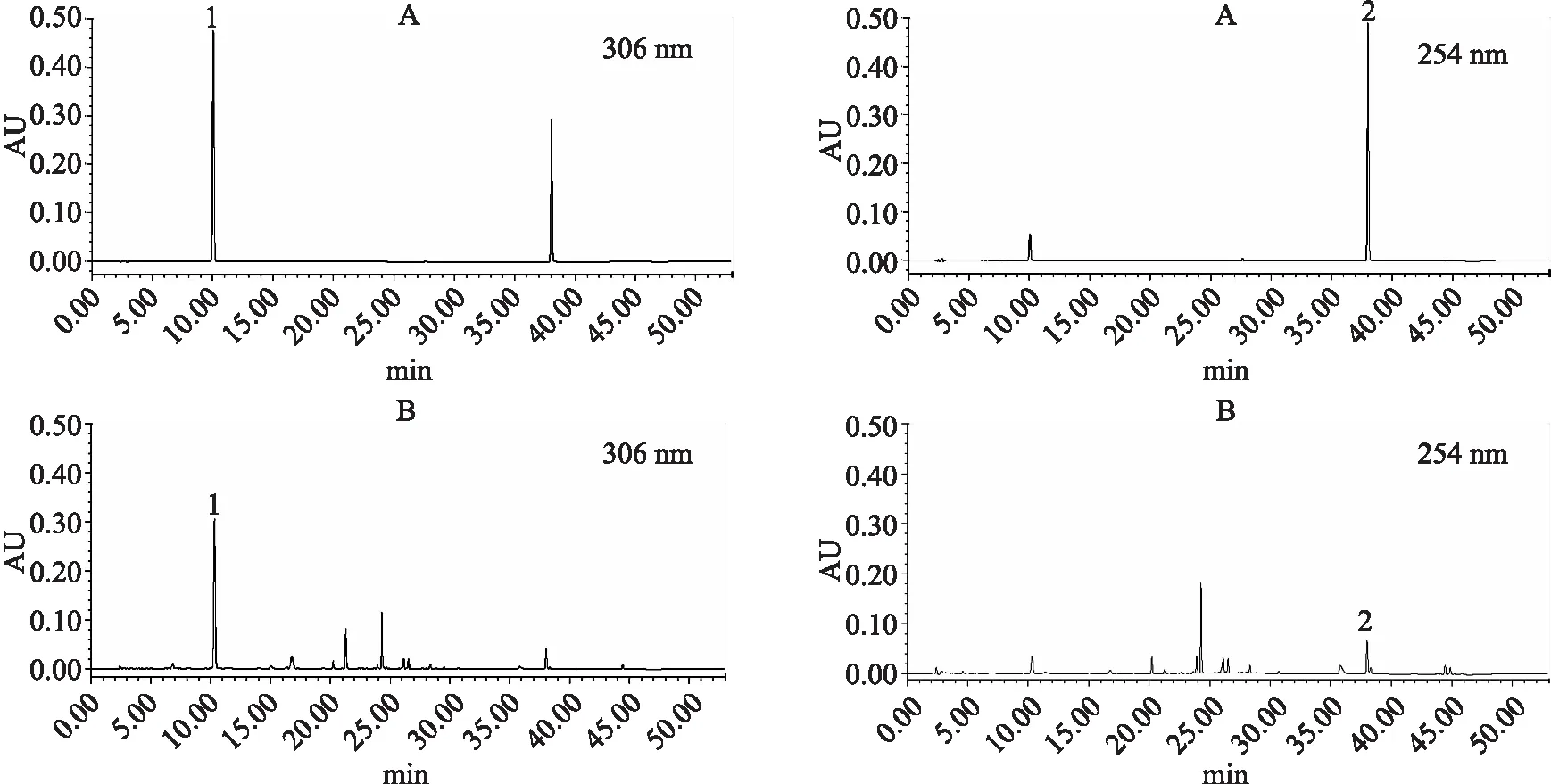
A.对照品溶液;B.虎杖饮片;1.虎杖苷;2.大黄素
2.1.2 对照品溶液制备 分别精密称取适量虎杖苷和大黄素对照品,加入甲醇溶解,配成每1 mL含虎杖苷351.12 μg,含大黄素410.50 μg的混合对照溶液。
2.1.3 供试品溶液制备
2.1.3.1 饮片供试品溶液的制备 取虎杖粉末0.15 g,精密称定,置100 mL锥形瓶中,加入精密吸取的50 mL甲醇,密塞,称重,水浴中超声处理30 min,放冷至室温,称重并加甲醇补足重量,摇匀,过滤,用0.45 μm的微孔滤膜过滤,滤液即为饮片供试品溶液。
2.1.3.2 煎煮液供试品溶液制备 取煎煮液样品溶液,精密吸取5 mL滤液置10 mL容量瓶中,加入甲醇定容,8000 rp·min-1离心10 min,滤过,即得。
2.1.4 线性关系的考察 分别精密量取混合对照品溶液0.4 mL、0.5 mL、1.0 mL、2.0 mL、3.0 mL、4.0 mL,按上述色谱条件进样,测定峰面积。以进样量为横坐标(X),峰面积为纵坐标(Y),进行线性回归,回归方程及线性范围见表1。结果虎杖苷和大黄素的相关系数均为0.9999,虎杖苷在70.34~703.45 ng,大黄素在41.05~820.99 ng范围内呈线性关系,表明虎杖苷和大黄素进样量与峰面积之间均具有良好的线性关系。
随着种植密度的不断增加会导致玉米兴玉101的叶绿素A与叶绿素B的含量逐渐减少,同时也会对净光合速率与净同化率造成较为严重的影响,光合作用中的关键酶PEPcase与RuBPCase活性逐渐降低。与此同时,随着种植密度的不断在增加会导致叶肉细胞膜结构出现破裂或损坏的情况,细胞内的叶绿体数量也会逐渐减少。通常情况下叶绿体的结构属于梭形,但由于种植密度的增加对玉米兴玉101光合作用产生影响导致叶绿体的形状变为椭圆形,最终导致叶绿体膜结构出现不完整的情况。除此之外,由于种植密度的增加导致玉米兴玉101的光合作用受到影响最终会导致玉米成熟期被延长,整体光合作用下降导致玉米的产量降低。

表1 线性关系考察
2.1.5 精密度试验 取“2.1.2”项下对照品溶液,按上述色谱条件重复进样6次,测定各成分峰面积,计算其RSD值。结果显示,虎杖苷RSD为0.50%,大黄素RSD值为0.32%,表明仪器精密度良好。
2.1.6 重复性试验 精密称取同一虎杖样品6份,按“2.1.3.1”项下方法制备饮片供试品溶液,按上述色谱条件进样,测定各成分的含量,计算RSD值。结果显示,虎杖苷、大黄素的平均含量分别2.08%、0.49%,RSD分别为1.16%,2.51%,表明本方法重复性良好。
2.1.6 稳定性试验 取同一饮片供试品溶液,按上述色谱条件,分别于0 h、2 h、4 h、8 h、12 h、24 h进样测定各成分峰面积,计算其RSD值。结果显示虎杖苷峰面积的RSD为3.64%,大黄素峰面积的RSD为3.56%,表明供试品溶液在24 h内稳定性良好。
2.1.7 重复性试验 精密称取同一虎杖样品6份,按“2.1.3.1”项下方法制备饮片供试品溶液,按上述色谱条件进样,测定各成分的含量,计算RSD值。结果显示,虎杖苷、大黄素的平均含量分别2.08%、0.49%,RSD分别为1.16%,2.51%,表明本方法重复性良好。
2.1.8 加样回收率试验 精密称定已测含量的虎杖样品9份(虎杖苷1.24%;大黄素0.61%),每份0.15 g,加入虎杖苷和大黄素对照品适量,按“2.1.3.1”项下方法制备供试品溶液,按上述色谱条件进样,计算各成分的回收率。虎杖苷和大黄素的平均回收率分别为102.25%、101.05%;RSD分别为0.88%、0.95%。结果表明方法准确度良好。
2.2 干膏率的测定 精密吸取煎煮液50 mL,置于已恒定质量的蒸发皿中,水浴蒸干,于105 ℃干燥至恒重,迅速精密称定质量,计算干膏率。
2.3 虎杖煮散工艺的考察
2.3.1 煮散粒径考察
2.3.1.2 饮片煎煮液制备 称取虎杖饮片100 g,加 8 倍量水浸泡 30 min,煎煮30 min,过滤,药渣加 6 倍量水煎煮 30 min。合并滤液,浓缩成200 mL,得0.5 g·mL-1药液。
2.3.1.3 煮散煎煮液制备 分别称取不同规格的煮散饮片100 g,加10倍水浸泡5 min,煮沸15 min,过滤,浓缩成400 mL溶液,得0.25 g·mL-1药液。
2.3.1.4 煮散粒径选择 分别精密吸取饮片和不同粒径饮片煮散汤剂50 mL置于蒸发皿中,水浴蒸干,105 ℃干燥至恒重,称定质量,计算干膏率。饮片的平均干膏率为(21.16±0.07)%、5~10目饮片煮散的平均干膏率为(17.39±0.06)%、10~24目饮片煮散的平均干膏率为(20.95±0.71)%,24~65 目饮片煮散的平均干膏率为(19.41±0.42)%。不同粒径的干膏率有一定的差异,其中10~24 目和 24~65 目干膏率与饮片的相近,为了保持与临床汤剂相同的疗效,因此认为 10~65 目的为最佳粒径范围。
2.3.2 煎煮时间考察 称取5份50.0 g虎杖煮散饮片,加入10倍量水,浸泡5 min,分别煎煮5 min、10 min、15 min、20 min、25 min,用100目筛过滤后浓缩至200 mL,测定汤剂相对密度。结果5 min的相对密度为1.0174,10 min的相对密度为1.0186,15 min的相对密度为1.0207,20 min的相对密度为1.0213,25 min的相对密度为1.0206。15 min、20 min、25 min的相对密度相当,所得汤剂均小于300 mL。故选择5 min、10 min、15 min进行正交试验。
2.3.3 加水量考察 称取5份50.0 g虎杖煮散饮片,分别加入8倍、10倍、12倍、14倍、16倍水,浸泡5 min,煎煮10 min,用100目筛过滤,分别得汤剂230 mL、320 mL、430 mL、500 mL、630 mL。根据汤剂服用量300~600 mL,选择10倍、12倍、14倍水进行正交试验。
2.3.4 浸泡时间考察 称取5份50.0 g虎杖煮散饮片,加入10倍量水,分别浸泡0 min、5 min、10 min、15 min、20 min,煎煮10 min,用100目筛过滤。静置后观察汤剂分层情况,根据分层情况选择浸泡0 min、5 min、10 min进行正交试验。
2.3.5 虎杖煮散煎煮工艺正交试验 在单因素试验基础上,考察煎煮时间(A)、加水量(B)、浸泡时间(C)对成分含量与干膏率的影响,每个因素考察3个水平,由上述单因素试验结果,各因素考察水平定为煎煮时间5 min、10 min、15 min,加水量10倍、12倍、14倍,浸泡时间0 min、5 min、10 min。按L9(34)正交表进行试验。以虎杖苷含量(30%)、大黄素含量(30%)及干膏得率(40%)计算综合加权评分,优选虎杖煮散工艺。因素水平设计见表2。
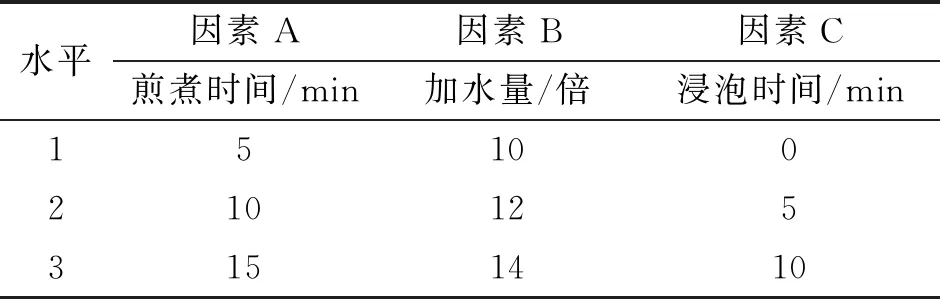
表2 因素水平设计表
根据虎杖饮片煮散正交试验结果,进行评分。评分标准为虎杖苷含量(30%)、大黄素含量(30%)和总固体(40%)进行综合评分[综合评分=(X/Xmax ×0.3+Y/Ymax ×0.3+Z/Zmax ×0.4) ×100%)]。直观分析见表3。由表3 可知影响因素大小顺序为加水量>浸泡时间>煎煮时间,优选工艺为A 2 B3 C 1 。根据正交试验得出优选煎煮工艺为 A2 B3 C1 ,即加 14倍量水、浸泡 0 min 、煎煮 10 min 。
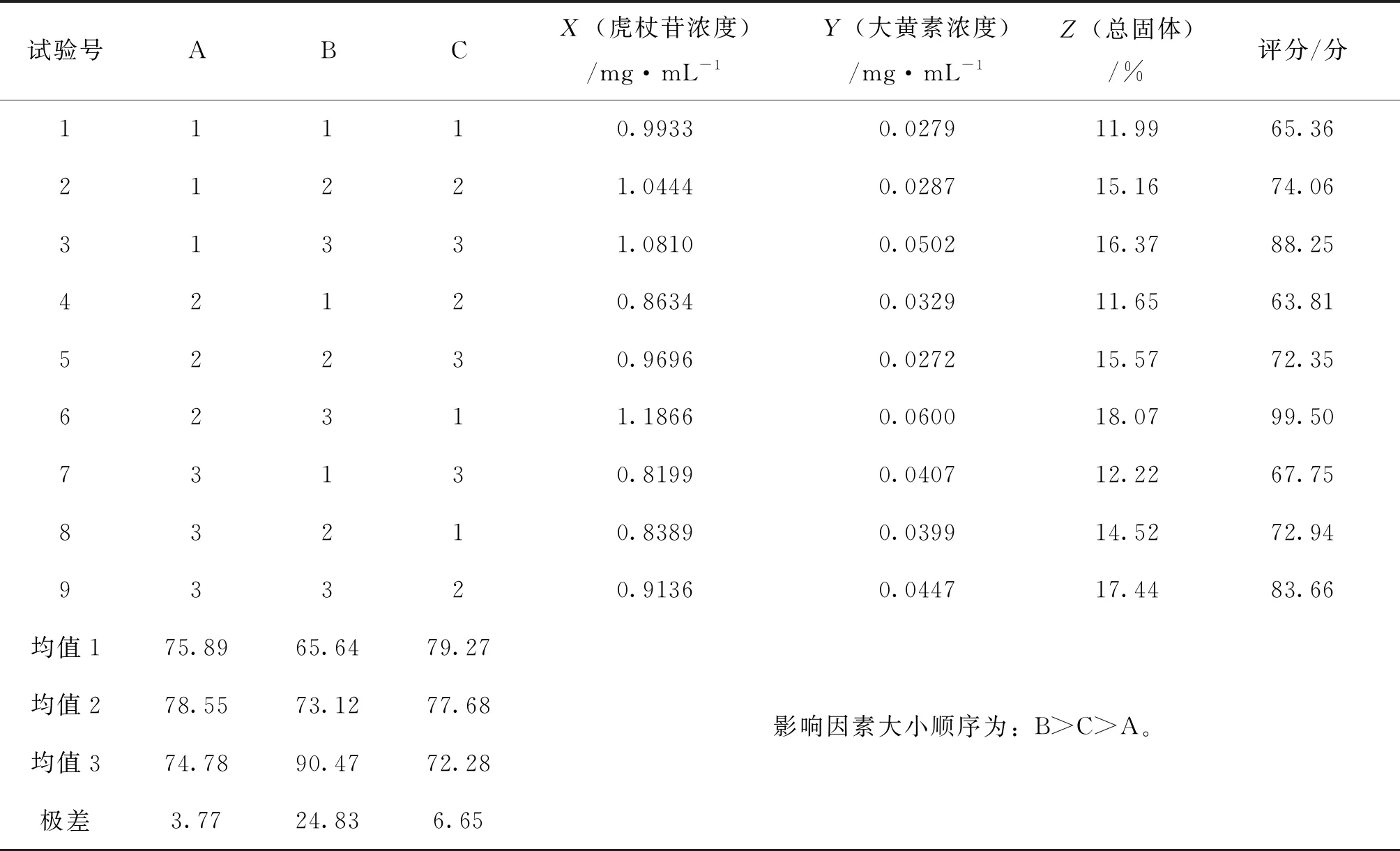
表3 正交试验表
2.8.3 验证试验 为考察所选因素水平中最佳工艺的稳定性及可行性,按照最佳工艺条件进行3次验证试验,工艺流程图如图2。结果提示,3 批虎杖饮片煮散中的虎杖苷浓度、大黄素浓度和总固体的RSD均<1.1%。表明所选虎杖饮片煮散工艺稳定可行。结果见表4。

图2 虎杖煮散工艺流程图
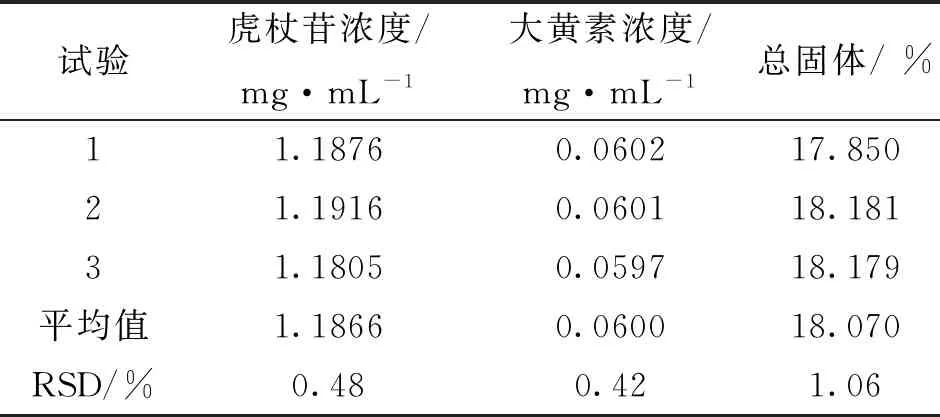
表4 验证试验结果
2.9 煮散剂量选择 称取虎杖饮片150 g,按“2.6.2”方法制备汤剂,取煮散饮片按照“2.7”项下优选的方法制备汤剂。以虎杖苷含量(30%)、大黄素含量(30%)和总固体(40%)为评价指标,筛选虎杖煮散饮片临床剂量。结果表明,75.0 g煮散饮片,与150 g饮片的分数接近,因此推荐虎杖饮片与煮散饮片的临床剂量比为2∶1。结果见表5。
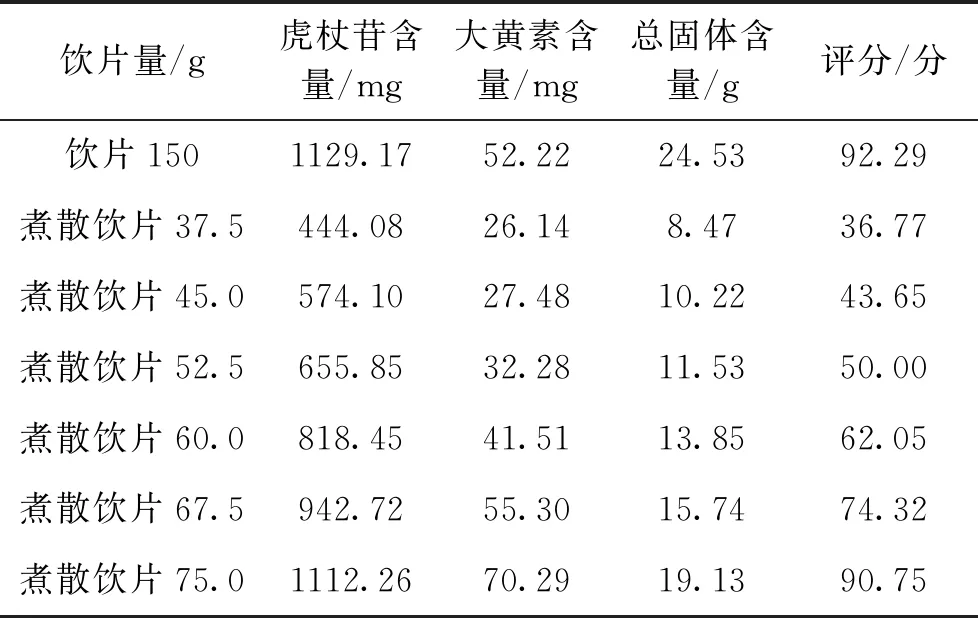
表5 虎杖煮散饮片剂量选择
3 结论
虎杖煮散工艺为:饮片粉碎至10~65目制备煮散饮片,称取煮散饮片,加入14倍量的饮用水,煎煮10 min。虎杖煮散饮片用量为传统饮片的1/2。
4 讨论
4.1 色谱条件选择 本研究在2020年版中国药典一部项下虎杖中虎杖苷与大黄素的含量测定方法基础上,先考察了254 nm和306 nm波长下的色谱峰,发现虎杖苷和大黄素在这两个波长条件下色谱峰的相应值差异较大,因此,选择254 nm和306 nm作为含量测定的吸收波长。考察甲醇-0.1%磷酸(80∶20,V/V)和乙腈-水(23∶77,V/V)流动相系统[5-6],发现目标色谱峰分离度不好。为了提高色谱峰分离度并使出峰时间合理,采用乙腈-0.1%甲酸水溶液梯度洗脱的方法,通过改变流动相比例,优选出乙腈-0.1%甲酸水溶液梯度洗脱系统作为虎杖苷和大黄素含量测定的流动相。
4.2 虎杖煮散工艺和剂量选择 本研究首先考察了虎杖煮散饮片粒径,通过考察出膏率,发现10~24目和24~65目的煮散饮片出膏率与饮片的相近,而且没有出现粘锅糊底现象,因此选择10~65目作为虎杖煮散饮片粒径。通过单因素考察,选择浸泡时间、加水量、煎煮时间的3个水平进行正交试验,以虎杖苷含量(30%)、大黄素含量(30%)和总固体(40%)为评价指标进行加权评分,进一步优选虎杖煮散工艺,确定虎杖煮散工艺为加14倍量水、浸泡0 min、煎煮10 min。使用该工艺煮散,不需要浸泡,煎煮时间大幅减少,大大减少了候药时间,体现了煮散快的特点。文献[7-8]报道,煮散剂量与饮片剂量比在1/4~1/2之间,因此本研究选择25%、30%、35%、40%、45%、50%的比例考察饮片煮散剂量,发现50%的饮片煮散的评分与饮片相近,因此推荐虎杖饮片煮散与饮片临床剂量比为1∶2。

