真空辅助加压腌制对草鱼块品质的影响
夏雨婷,吴伟伦,章 蔚,汪 超,石 柳,吴文锦,丁安子,乔 宇,李 新,汪 兰,
(1.湖北工业大学生物工程与食品学院,湖北 武汉 430068;2.湖北省农业科学院农产品加工与核农技术研究所,湖北 武汉 430064)
2020年,我国淡水产品总产量高达3088.9万 t,其中草鱼产量达557.1万 t,位居前列[1]。草鱼又名鲩、草根,是我国淡水养殖和加工的主要鱼种[2]。草鱼是一种低脂、高蛋白的优质食物,其内脏粗脂肪质量分数最高为26.90%,蛋白质量分数最低为7.73%,是提取鱼油的良好来源[3]。除鱼肉外,草鱼其他部位也具有重要的利用价值,可以提高草鱼的附加值,如草鱼鱼鳞可以提取胶原蛋白、制备生物活性肽等[3-4]。目前草鱼多以鲜活销售为主,草鱼加工制品多以预制鱼片的形式销售,但由于其富含蛋白质和水分而不易贮藏[5]。
腌制是水产品常用的保存方法之一[6],具有延长产品货架期、改善色泽并形成独特风味、提高食品品质的作用[7]。传统的腌制方法包括干腌和湿腌。干腌法操作简单,腌制品耐贮藏,但腌制品多存在含盐量高、鱼肉质地硬和贮藏过程中脂肪容易氧化导致腐败变质等问题。湿腌法能够提高腌制品的腌制均匀性,但水分含量高,产品易腐败,腌制品的食用安全性无法保障[8]。国内外学者为缩短腌制时间、改善腌鱼品质,采用盐水注射[9]、滚揉[10]、超高压[11]、超声波[12]等方法辅助腌制,但这些方法仍存在生产成本高、产品品质差、产品易被污染的缺点[13]。真空辅助腌制较其他腌制技术,具有腌制速率快、时间短、盐分渗透均匀、产品质量高等优点[14]。近年来,真空辅助滚揉、真空辅助浸渍、真空脉冲等真空辅助腌制技术已被广泛应用于鱼类和肉类加工中。研究表明真空辅助腌制可提高腌制速率,促进腌制液的渗入。李慧等[15]研究大头菜的真空辅助浸渍腌制过程,发现浸渍液盐添加量20%的真空浸渍组大头菜各指标变化速率最快,氯化物质量分数增加了11%。真空辅助腌制也可提高肉制品的嫩度并改善肉品的色泽。陈星等[16]研究腌制方式对鸭肉腌制速率及品质的影响,结果表明真空滚揉腌制鸭肉的亮度(L*值)升高,红度(a*值)和黄度(b*值)降低,剪切力和硬度降低。
目前,已报道的腌制技术很多,但真空辅助加压腌制还鲜有报道。本实验以草鱼为研究对象,探究真空辅助加压腌制对草鱼块微观结构、质地和水分分布的影响,旨在提高腌制水产品的品质,为水产品腌制新型技术提供理论参考。
1 材料与方法
1.1 材料与试剂
鲜活草鱼(体质量≥2 kg)购于湖北省武汉市白沙洲生鲜市场。
食盐(食品级加碘盐) 湖北盐业集团有限公司;质量分数4%多聚甲醛固定液﹑苏木素-伊红染液、冷冻切片包埋剂 武汉谷歌生物科技有限公司;其余试剂均购于国药集团化学试剂有限公司。
1.2 仪器与设备
便携式pH计、电子分析天平 梅特勒-托利多仪器(上海)有限公司;CR-400色差计 日本Konica-Minolta公司;TA-XT Plus质构仪 英国Stable Micro Systems公司;GL-25MS高速冷冻离心机 上海卢湘仪离心机仪器有限公司;UV-2550分光光度计 日本岛津公司;HH-6数显式恒温水浴锅 常州国华电器有限公司;T18高度分散均质机 德国IKA公司;NMI20-025V-I成像系统 日本尼康公司;NMI20-025V-I核磁共振分析仪 苏州纽曼分析仪器股份有限公司。
1.3 方法
1.3.1 草鱼预处理
鲜活草鱼购买后快速运送至实验室,重击头部致死后,去头、尾、鱼磷、鱼皮及内脏,洗净后沥干水分,取其背肉,剪切成长10 cm、宽10 cm,质量约为90 g的正方形鱼块,备用。
1.3.2 腌制与熟制处理
称取鱼肉质量2.5%的食盐均匀涂抹在鱼肉表面,立即将鱼肉分别放入真空盒(22 cmh 22 cmh 18 cm)中,分别在鱼块正上方放置0、1、2、3 个腌制石(10 cmh 10 cmh 3 cm,2300 g)分别进行常压腌制和真空辅助加压腌制。其中,不放置腌制石且不抽真空处理的常压腌制组记为F组;真空(真空度0.08 MPa)未施加压力的腌制样品记为Z-0组,按照式(1)计算压强P。压强为2.3、4.6、6.9 kPa的真空(真空度0.08 MPa)辅助加压腌制样品分别记为Z-1、Z-2、Z-3组。将处理好的样品立即放入4 ℃冷库中腌制24 h。

式中:F为鱼肉所受压力/N;S为鱼肉受力面积/cm2。
草鱼块腌制24 h后取出,测定相关指标。鱼肉熟制条件:鱼肉样品按照测定条件剪切成鱼块,保鲜袋密封,置于85 ℃水浴锅中水浴25 min后冷却至室温。
1.3.3 食盐质量分数测定
取草鱼背部鱼肉,参照GB/T 12457-2008《食品中氯化钠的测定》中的直接沉淀滴定法测定食盐质量分数。
1.3.4 产品得率测定
称取新鲜鱼肉质量记为m1/g,吸干表面水分,分别于腌制0、2、4、6、8、12、24 h再次称取腌制鱼肉样品质量,记为m2/g。产品得率按式(2)计算。
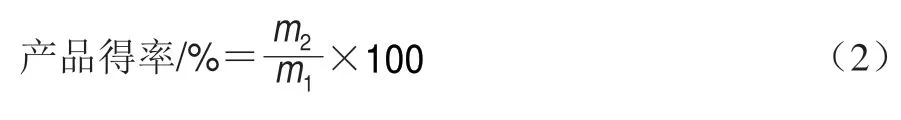
1.3.5 组织微观结构观察
参照张芸等[17]的方法并加以修改,沿着垂直于鱼肉肌纤维方向取样(1 cmh 2 cmh 6 mm),将其于4%多聚甲醛固定液中固定24 h以上。固定完成后取出进行修整,依次放入质量分数15%和30%蔗糖溶液中脱水。脱水完成后吸干表面水分,置于包埋台上,组织周围滴加冷冻切片包埋剂,然后将其放在冰冻切片机上速冻包埋,切片,厚度为8~10 μm,苏木素-伊红染液染色,然后置于光学显微镜下观察组织微观结构,利用Case Viewer和Image J软件处理图像。
1.3.6 色泽测定
采用色差仪,测定样品表面的L*、a*、b*值。每组样品重复测定6 次并记录。白度按照式(3)计算。
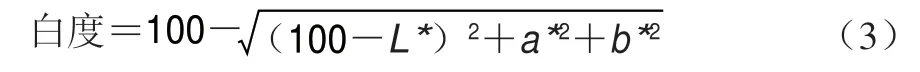
1.3.7 剪切力测定
参照章蔚等[18]的方法并加以修改,将鱼肉修剪为2 cmh 2 cmh 2 cm的鱼块后置于质构仪A/CKB探头下,剪切力测定参数:力臂25 kg、压缩变形50%、测前速率5.0 mm/s、测中速率1.0 mm/s、测后速率5.0 mm/s。
1.3.8 质构特性测定
取草鱼背部肉块(1.8 cmh 1.7 cmh 1.0 cm),采用质构仪分别测定生、熟鱼肉的硬度、回复性、内聚性、弹性和黏性。将样品置于P/36R探头下,测试条件:测前速率2 mm/s、测试速率0.5 mm/s、测后速率2 mm/s、测试深度5mm、触发力5 g、计算阈值为20 g。每组样品每个平行重复测定9 次,结果取平均值。
1.3.9 硫代巴比妥酸反应物值测定
参考陈方雪等[19]的方法并加以修改,准确称取鱼肉样品5 g,加入20 mL体积分数10%三氯乙酸溶液和20 mL蒸馏水,静置1 h,8000 r/min、4 ℃离心10 min,取上清液于比色管中,加入5 mL 0.02 mol/L硫代巴比妥酸溶液,沸水浴20 min,取出,流动水冷却5 min,采用分光光度计在532 nm波长处测定吸光度。硫代巴比妥酸反应物(thiobarbituric acid reactive substance,TBARS)值用每千克样品中所含丙二醛质量表示,单位为mg/kg。
1.3.10 挥发性盐基氮含量测定
参照GB 5009.228-2016《食品中挥发性盐基氮的测定》中的自动凯氏定氮仪法测定总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量。
1.3.11 pH值测定
将鱼肉剁碎,称取1.0 g装入15 mL离心管,加入9 mL蒸馏水,置于4 ℃冰箱静置30 min,用精密pH计测定上层澄清液pH值并记录。每个样品做3 次平行实验,结果取平均值。
1.3.12 水分质量分数的测定
参照GB 5009.3-2010《食品中水分的测定》中的直接干燥法测定水分质量分数。
1.3.13 汁液渗出率测定
取10 g鱼肉样品记为m1/g,装入保鲜袋,置于85 ℃水浴锅中水浴25 min后,冷却至室温,用滤纸擦去表面水分并称质量,记为m2/g。汁液渗出率按照式(4)计算。
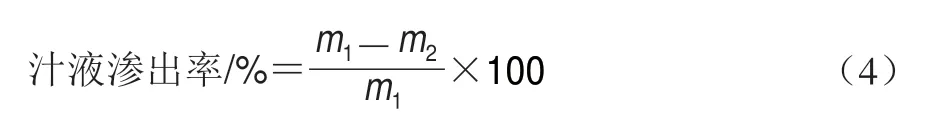
1.3.14 离心损失率的测定
称取2 g鱼肉样品,裁剪大小为4 cmh 4 cm的纱布,称质量,记为m1/g;用纱布包裹鱼肉,称取纱布和鱼肉总质量,记为m2/g。用3 张大滤纸包裹纱布和鱼肉,置于离心管中,1500 r/min常温离心10 min,再次称质量,记为m3/g。离心损失率按式(5)计算。
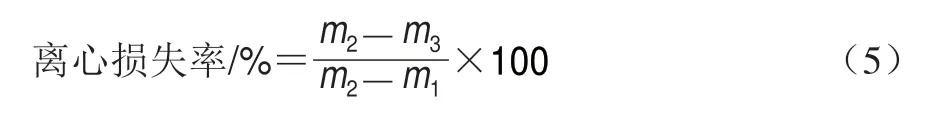
1.3.15 水分分布测定
参照周俊鹏等[20]的方法,将生、熟鱼块样品切成2 cmh 2 cmh 2 cm,采用核磁共振分析仪测定其水分分布。测定参数:共振频率21.3 MHz、磁体强度0.55 T、线圈直径60 mm、磁体温度32 ℃;使用Q-FID序列及标准品进行仪器校正,然后使用CPMG脉冲序列采集样品自旋-自旋弛豫时间(T2)信号。CPMG序列参数:采样频率100 kHz、模拟增益20.0 dp、90°射频脉宽8.00 μs、数字增益为3、采样点数399998、增益参数为1、重复采样间隔时间4000 ms、累加次数为4、180°射频脉宽16.00 μs、回波时间0.400 ms、回波个数10000。每组平行3 次,每个平行测定3 次。
1.3.16 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
参考Laemmli[21]的方法稍作修改,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)分析。取2 g鱼肉加18 mL 5% SDS(0.05g SDS加入1 mL ddH2O),均质1min,90 ℃水浴1 h,常温离心(17000hg、20 min)取上清液,稀释约50 倍,用5% SDS调整上清液蛋白质量浓度至1.5 mg/L,取10 μL上清液加入50 μL上样缓冲液,使蛋白质量浓度调至1 mg/L,混匀并沸水浴加热3 min,待冷却至室温后,取上清液5 μL上样,5%浓缩胶、电压80 V,12%分离胶、电压120 V。
1.4 数据处理与分析
数据使用Excel软件进行处理,采用SPSS 20.0软件中的Duncan法和Pearson法分别进行差异显著性分析和相关性分析,P<0.05表示差异显著,用GraphPad Prism 5.0软件作图。
2 结果与分析
2.1 不同腌制处理对草鱼肌肉品质的影响
2.1.1 食盐质量分数
鱼肉中的食盐含量能够反映腌制过程中食盐的渗入效果。如表1所示,未腌制草鱼中的食盐质量分数极低,为0.02%。钠盐天然存在于原料肉中,一般含量极低[16]。腌制过程中,随着腌制时间的延长,食盐质量分数增加。食盐质量分数与鱼块所受压力呈正相关。腌制4 h,各组食盐质量分数均较未腌制时显著上升(P<0.05),腌制4~12 h,各组食盐质量分数上升缓慢(P>0.05)。腌制0~4 h,由于鱼肉中食盐含量较低,渗透压较高,食盐能够迅速进入鱼肉;而4~12 h,渗透压逐渐减小,食盐的渗入速率减慢,与腌制初期相比,此阶段食盐质量分数的增加主要是由于水分的流失,这与张东等[22]的研究结果一致。腌制24 h,Z-0组的食盐质量分数显著高于F组,表明真空能够促进食盐的渗入,提高鱼肉的含盐量。真空条件下鱼肉组织细胞间距增加,变得疏松,使食盐能够快速进入鱼肉组织,导致鱼肉食盐质量分数增加。在真空辅助加压作用下,鱼肉受到外部压力越大,食盐质量分数越高,表明在鱼肉内部渗透压和外部压力协同作用下,组织细胞受到破坏,细胞内水分渗出,食盐进入鱼肉组织间隙,从而导致鱼肉食盐质量分数增加,并且显著高于真空常压腌制Z-0组。
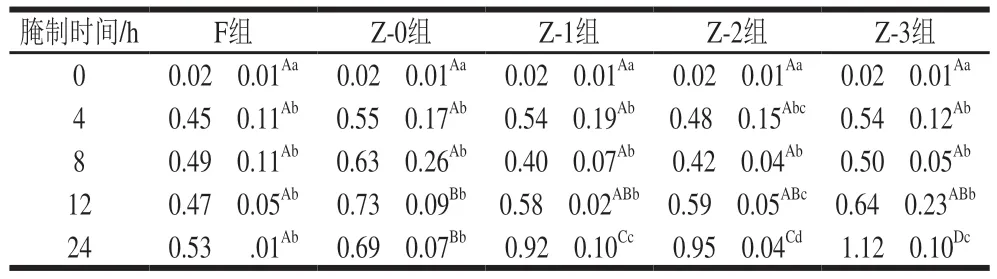
表1 不同腌制处理对草鱼肉食盐质量分数的影响Table 1 Effects of different treatment conditions on the salt content of cured grass carp%
2.1.2 产品得率
水分的保持情况对于腌制产品品质十分重要,产品得率能够反映鱼肉的持水情况,也是评价鱼肉腌制效果的重要指标。由图1可知,在腌制过程中,产品得率随腌制时间的延长呈下降趋势。腌制结束时产品得率总体保持在90%以上。张芸等[17]研究木糖醇部分替代食盐腌制对大口黑鲈鱼品质的影响发现,在低盐浓度腌制时,出品率仍可保持在较高水平。死后贮藏过程中鱼肉自身会发生一系列反应导致其水分部分流失,在真空辅助腌制过程中,随着外部压力的增大,产品得率下降。这可能是压力的增大导致鱼肉内部组织间隙增大,食盐渗入增多,造成水分流失增加,进而导致产品得率降低。

图1 不同腌制处理对草鱼肉产品得率的影响Fig.1 Effects of different treatment conditions on the product yield of cured grass carp
2.2 不同腌制处理对草鱼肉组织结构的影响
如图2所示,不同处理组间鱼肉组织的微观结构存在差异,真空辅助常压腌制和真空辅助加压腌制的鱼块样品微观结构明显不同。F组样品肌原纤维排列紧密,细胞间隙最小,细胞较完整,表明常压腌制对肌原纤维细胞造成的破坏较小。而经真空加压腌制后,样品细胞间隙增大,随着压力不断增大,肌原纤维细胞发生损伤,肌肉细胞完整性被破坏,细胞发生形变和破裂,表明食盐腌制会使鱼肉组织中水分排出,并且压力作用使肌原纤维断裂。
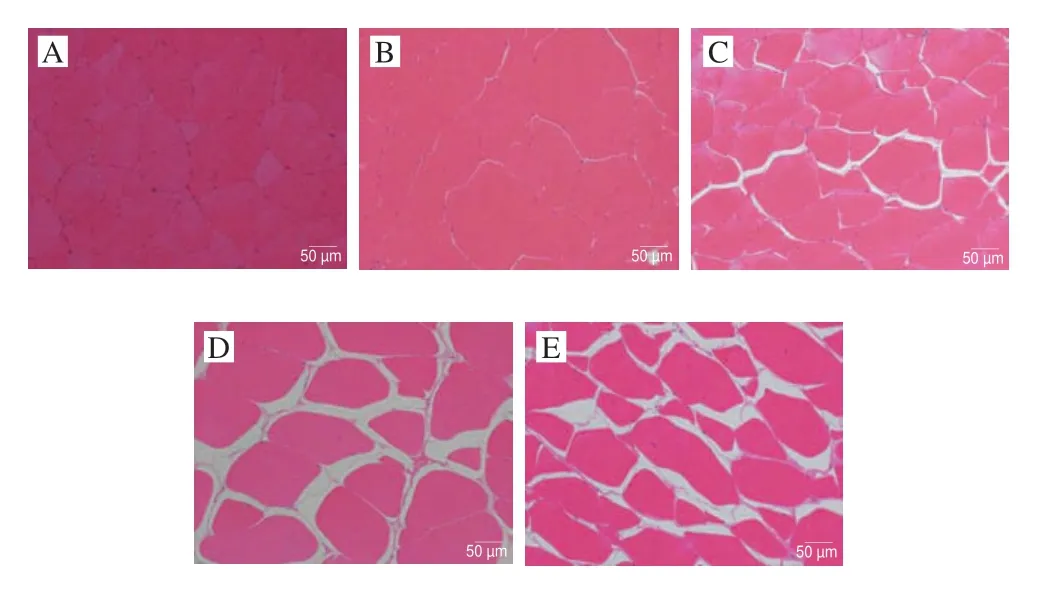
图2 不同腌制处理对草鱼肉微观组织形态的影响(×20)Fig.2 Effects of different treatment conditions on histological morphology of cured grass carp (× 20)
2.3 不同腌制处理对草鱼肉感官品质的影响
2.3.1 色泽
鱼肉颜色的变化会影响鱼肉的品质以及消费者的购买欲,白度是鱼肉品质的一项重要指标。鱼肉色泽的变化是肌肉本身生理学、生物化学和微生物学变化的外在表现,并受到光照作用的影响[23]。由图3可知,腌制结束后,Z-0组与F组鱼肉白度无显著差异(P>0.05),真空辅助加压腌制鱼肉的白度较Z-0 组显著升高(P<0.05),Z-1、Z-2、Z-3组白度分别上升至44.58、43.34和46.82。这可能是腌制24 h后食盐的渗入以及鱼肉汁液的流失导致光的折射和反射变强,从而使鱼肉的白度增加。
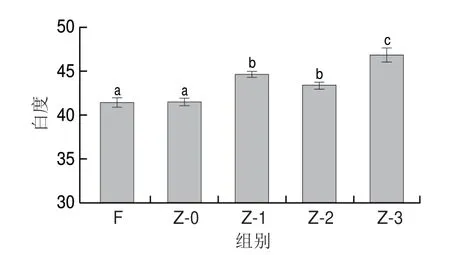
图3 不同腌制处理对草鱼肉色泽的影响Fig.3 Effects of different treatment conditions on the color of cured grass carp
2.3.2 质构特性
肉的嫩度通常用剪切力衡量[24]。质构特性分析是通过模拟人体口腔两次咬合运动,测定两次压缩过程中样品的硬度、回复性、内聚性、弹性和黏性等指标[25]。由表2可知,对于生鱼肉,Z-0组剪切力较F组显著升高,这是由于抽真空过程排除了鱼肉内部的水分和空气。在真空条件下,当压强为6.9 kPa时,鱼肉剪切力急剧下降,表明鱼肉内部肌纤维断裂,细胞间隙变大,鱼肉嫩度提高。硬度是食品保持其形状的内部结合力,是牙齿压迫样品所需最大力[26]。在真空辅助腌制过程中,Z-3组硬度最小,其嫩度最大。回复性在真空辅助加压腌制组中总体无明显变化,说明鱼肉回复性受压力影响较小。内聚性表示对食物咀嚼时的抵抗性[26]。在腌制过程中各组鱼肉内聚性小幅变化,Z-3组显著低于其他组(P<0.05)。郭思亚等[27]研究腌制工艺对鲟鱼肉干质构特性的影响,发现鱼肉内聚性在腌制过程中随着食盐添加量的增加呈一定变化但不显著,这可能与草鱼肉组织中的脂肪有关。Z-3组弹性最低,为42.26,这可能是盐的作用导致鱼肉蛋白质变性,造成自身凝胶性能降低,使鱼肉组织在受到挤压后不能恢复到原来状态,表现为鱼肉弹性的下降[28]。Z-3组黏性也最低,为1475.40。以上结果表明,真空辅助加压6.9 kPa腌制草鱼的内聚性和黏性低、硬度小、嫩度高。

表2 不同腌制处理对草鱼肉质构特性的影响Table 2 Effects of different treatment conditions on texture properties of cured grass carp
对于熟制鱼块,与F组相比,真空辅助加压腌制组鱼肉剪切力上升,这可能是加热后肌原纤维变性收缩、汁液流失,导致剪切力上升。Z-1组样品较Z-0组的硬度、黏性和内聚性显著升高(P<0.05),这说明加热后的汁液流失和压力作用对鱼块质构特性造成一定影响。随着真空辅助腌制施加压力的增大,鱼肉的硬度和黏性发生显著变化(P<0.05),但回复性和弹性无显著变化(P>0.05)。当压力过大时,鱼肉肌肉组织结构受到破坏,硬度和黏性降低。
2.4 不同腌制处理对草鱼肉理化品质的影响
2.4.1 TBARS值和TVB-N含量
TBARS值是评价肉类以及水产品脂肪氧化程度的重要指标。由表3可知,Z-0组较F组TBARS值下降,原因可能是真空环境能够减少鱼肉组织与氧气接触,进而抑制组织中微生物生长和繁殖,降低酶活性,减缓脂肪氧化,从而使TBARS值下降。真空辅助腌制条件下,随压力的增大,鱼肉TBARS值呈上升趋势。这可能是由于随着压力的增大,食盐不断渗入,促进了脂肪氧化。周宣宣等[29]研究低盐腌制对乌鳢冷藏过程中品质变化的影响发现,盐能够促进鱼肉中脂肪的氧化,盐含量越高促进作用越明显。
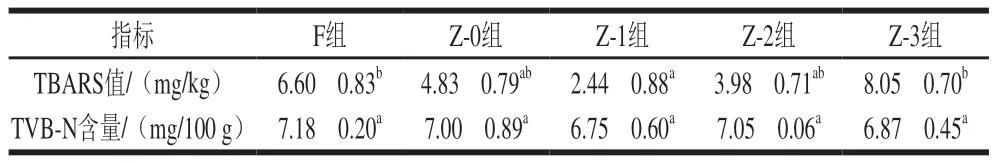
表3 不同腌制处理对草鱼肉TBARS值和TVB-N含量的影响Table 3 Effects of different treatment conditions on TBARS value and TVB-N content of cured grass carp
TVB-N含量是反映鱼肉腐败程度的重要指标之一。不同腌制处理鱼肉的TVB-N含量无显著变化。根据GB 2733-2015《食品安全国家标准 鲜、冻动物性水产品》规定,淡水鱼的TVB-N含量不得超过20 mg/100 g[30]。本实验中鱼肉的TVB-N含量均小于20 mg/100 g,说明草鱼肉在腌制过程中保持较高的新鲜度。F组与Z-0组的TVB-N含量分别为7.18、7.00 mg/100 g,Z-0组TVB-N含量较F组略下降但无显著差异,说明真空能够有效抑制内源性酶活性,减缓鱼肉中微生物的生长和繁殖速率。不同真空辅助加压腌制组的TVB-N含量无显著变化,可能是在4 ℃环境下进行腌制,鱼肉中的微生物生长受到抑制,减缓了蛋白质分解速率,使草鱼鱼块能够保持较好的新鲜度。
2.4.2 pH值
pH值作为鱼肉品质的评价指标之一,也可以反映鱼肉的新鲜度。如图4所示,腌制24 h后,F组和Z-0组pH值分别为6.42、6.42,说明真空条件对鱼肉pH值无显著影响(P>0.05)。在真空辅助腌制条件下,Z-0、Z-1、Z-2组pH值无显著差异(P>0.05),Z-3组pH值显著高于其他各组(P<0.05),达6.60,说明不同加压处理对鱼肉pH值的影响不同,当所受压力较小时,pH值不受压力影响,而压力过大时,pH值上升可能与蛋白质的变性有关。此外,食盐的渗入以及鱼体自身内源性酶导致盐溶性蛋白质分解产生碱性物质也会使pH值上升。

图4 不同腌制处理对草鱼肉pH值的影响Fig.4 Effects of different treatment conditions on pH of cured grass carp
2.5 不同腌制处理对草鱼肉品质的影响
如表4所示,腌制24 h后,Z-0组水分质量分数低于F组,这是由于真空抽气使内部组织空隙和细胞间距增大[31],食盐不断渗入使鱼肉中的水分排出,水分质量分数下降。在真空辅助腌制条件下,不同加压处理组鱼肉的水分质量分数无显著差异,均低于Z-0组,说明加压腌制能够使鱼肉中食盐含量提高,食盐的渗透作用使水分从鱼肉组织内部向外部渗出,导致水分质量分数下降[32]。
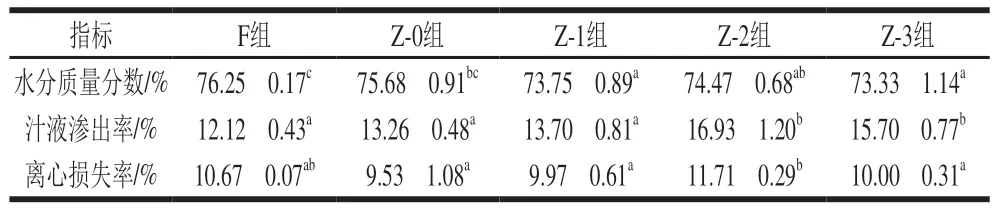
表4 不同腌制处理对草鱼肉的水分质量分数、汁液渗出率和离心损失率的影响Table 4 Effects of different treatment conditions on the water content,juice loss rate and centrifugal loss rate of cured grass carp
在4 ℃下冷藏腌制24 h,草鱼肉在真空状态下处于负压环境,食盐质量分数的增加导致肌肉持水力下降,因此Z-0组汁液渗出率略高于F组。F组和Z-0组的汁液渗出率分别为12.12%和13.26%,无显著差异(P>0.05),表明真空条件对腌制草鱼肉的汁液渗出率影响较小。而在真空辅助加压腌制后,Z-1、Z-2、Z-3组的汁液渗出率分别为13.70%、16.93%、15.70%,均大于Z-0组,表明除加热导致蛋白质变性和肌纤维收缩外,压力造成的草鱼内部肌肉细胞组织破环进一步导致草鱼肉汁液流失加剧。
离心损失率是反映草鱼持水力的重要指标之一。离心损失率越高,鱼肉保水性越差。由表4可知,腌制24 h后,Z-0组鱼肉样品的离心损失率低于F组,说明真空状态下鱼肉保水性更好。在真空条件下草鱼块释放内部气体并排出自由流动的水分,使肉样的组织结构更加紧密,保水性更佳[33]。随着压力的增大,离心损失率先上升后下降,这可能是因为在腌制过程中鱼肉受到外力作用时,肌肉组织完整性被破坏,肌原纤维间隙变大,使肌肉组织间隙的自由水不再受到束缚,而Z-3组离心损失率的降低可能与较低的水分质量分数和较高的食盐质量分数有关。
2.6 不同腌制处理对草鱼肉水分分布的影响
低场核磁共振技术可检测肉品中1H质子的弛豫时间T2,进而获得水分分布信息[34],T2越长水分自由度越高。T21(0.01~10 ms)表示结合水,T22(30~100 ms)表示不易流动水,T23(>100 ms)表示自由水[35],T21、T22、T23对应的峰面积比例P21、P22、P23表示不同状态水分的相对含量[36]。
由表5可知,腌制24 h后,Z-0组T21、T22、T23均大于F组,这可能是由于腌制过程中引入的一些金属离子与带相反电荷的蛋白质基团相互作用,形成电子基团双电层,削弱了蛋白质分子间的静电斥力,从而促进了蛋白质-蛋白质、蛋白质-溶剂间的相互作用[37],导致水分自由度增加。而真空辅助加压腌制后,随着压力的增加,T21、T22变化不显著(P>0.05),T23显著延长,表示水分自由度增加,可能是因为加压导致蛋白质聚集、交联和变性,产生溶胶,这与谢思芸等[38]研究结果一致,也与汁液损失率分析结果相互印证。腌制24 h后,Z-0组与F组相比,P21、P23无显著变化(P>0.05),P22显著下降(P<0.05),表明真空常压腌制下鱼肉不易流动水相对含量减少;而与Z-0组相比,Z-1、Z-2和Z-3组P21显著增大(P<0.05),P22、P23减小,说明鱼肉在压力作用下,不易流动水可能转化成结合水,同时由于食盐的渗透作用导致鱼肉组织中的自由水渗出。随着压力的增加,P21无显著变化,而P22、P23显著减小(P<0.05)。
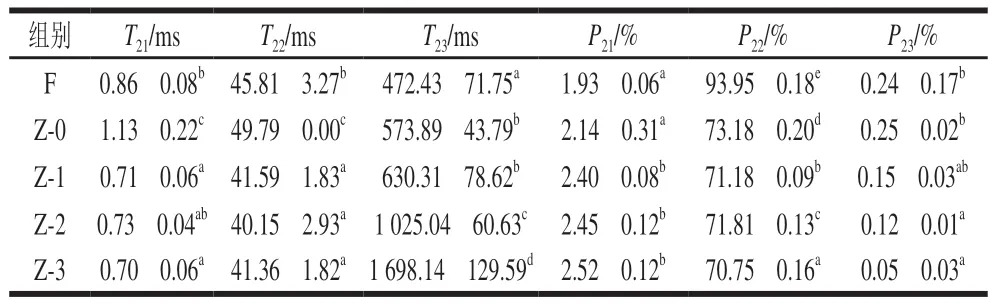
表5 不同腌制处理对草鱼肉水分分布的影响Table 5 Effects of different treatment conditions on water distribution in raw cured grass carp
由表6可知,熟制后,在真空加压腌制组中,Z-3组T21最短,T22最长,P21和P22最低,表明真空辅助加压6.9 kPa条件下腌制鱼肉组织的保水性最差。
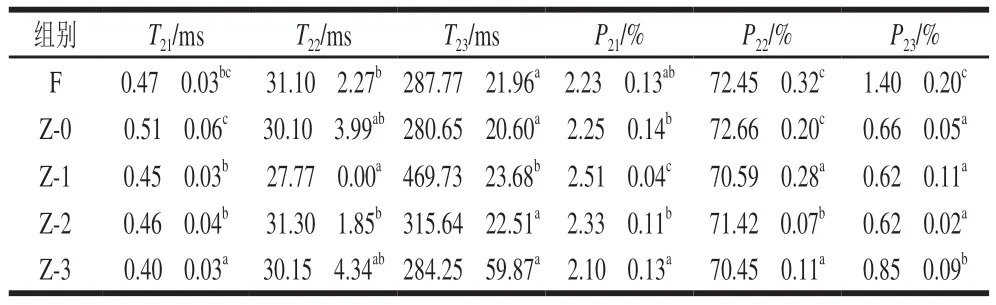
表6 不同腌制处理对熟制草鱼肉水分分布的影响Table 6 Effects of different treatment conditions on water distribution in cooked cured grass carp
磁共振成像技术是利用磁场和射频脉冲使样品中的氢质子振动发出射频信号,然后经计算机处理成像的一种技术,氢质子信号强则显红色,表明水分自由度越高[21]。由图5可知,生鱼肉中在氢质子信号在F、Z-0、Z-1、Z-2和Z-3组中逐渐增强,表明Z-3组的水分自由度最高。熟制后草鱼肉中的氢质子信号变化趋势与生鱼肉相同,说明鱼肉组织中的水分向自由水方向迁移。

图5 不同腌制处理条件下草鱼肉核磁共振成像图Fig.5 Magnetic resonance images of cured grass carp under different treatment conditions
2.7 不同腌制处理对草鱼肉蛋白质组成的影响
食盐腌制可以改善肉的品质,食盐腌制过程中发生的蛋白质磷酸化可以通过影响糖酵解过程和蛋白质降解等途径参与调控肉的品质[39]。如图6所示,与F组相比,Z-0组肌球蛋白轻链1(myosin light chain 1,MLC-1)亚基、肌球蛋白重链(myosin heavy chain,MHC)和肌动蛋白条带灰度无显著差异(P>0.05),说明真空辅助腌制对肌原纤维蛋白的降解无明显影响。与Z-0组相比,Z-1组MLC-1、MHC和肌动蛋白条带灰度均无显著变化(P>0.05),Z-3组3 种蛋白条带灰度均显著增加(P<0.05),而Z-2组MLC-1和肌动蛋白条带灰度显著增加(P<0.05),表明在真空辅助加压腌制条件下鱼肉蛋白降解速度增加。上述结果说明真空辅助腌制不能使肌肉组织中的酶类有效释放。当真空辅助加压腌制的压力较低时,肌肉中的肌原纤维蛋白结构也不会改变;当压力逐渐增加时,蛋白质结构变化较大,蛋白质分子发生交联,形成了较多的蛋白质聚集体。Z-3组肌动蛋白灰度低于Z-2组,可能是肌细胞组织结构破裂,释放蛋白酶,导致内源蛋白酶活性增加,加速了蛋白质的降解[40]。

图6 不同腌制处理对草鱼肉蛋白质降解的影响Fig.6 Effects of different treatment conditions on protein degradation in cured grass carp
3 结论
本实验主要研究真空辅助加压腌制对草鱼肉品质的影响,结果表明,在4 ℃腌制24 h后,真空辅助加压6.9 kPa条件下,鱼肉的食盐质量分数、TBARS值最高,产品得率最低。在组织结构方面,真空辅助加压腌制后鱼肉内部组织结构被破坏。在一定压力范围内,随着压力逐渐增大,白度和汁液渗出率均呈上升趋势,水分质量分数呈降低趋势;6.9 kPa条件下生鱼肉剪切力低于其他4 组,鱼肉嫩度得到改善。5 组鱼肉的TVB-N含量无显著差异,除Z-3组外,其余4 组鱼肉pH值无显著差异。低场核磁共振分析结果表明真空辅助加压腌制使鱼肉水分自由度增加,持水力较F组和Z-0组变差。腌制后草鱼肉肌原纤维蛋白发生一定程度降解。真空辅助加压6.9 kPa腌制能够使食盐渗入速率加快,同时改善草鱼肉的质构品质。

