α-突触核蛋白/A53T突变体损伤SH-SY5Y细胞的MAM并导致线粒体结构异常及自噬
岳静静,伍 超,高 歌,鲁玲玲
首都医科大学基础医学院 神经生物学系, 北京 100069
帕金森病(Parkinson’s disease,PD)是仅次于阿尔兹海默病的第二大常见的神经退行性疾病[1]。其典型的病理表现是α-突触核蛋白(α-synuclein, α-syn)的病理性聚集[2]。在疾病的发生发展中α-syn发挥着重要的作用。A53T突变体是第一个被发现的具有家族遗传性的突变位点[3]。目前关于该突变的研究有很多,主要集中在α-syn/A53T突变会导致异常的聚集导致内质网应激以及该突变会改变其与脂质膜的结合方式,破坏线粒体等胞内膜结构[4]。但是,关于A53T突变导致的细胞毒性的具体机制至今仍不明确。
据报道α-syn存在于内质网线粒体相关膜(mitochondria associated membrane of endoplasmic reticulum,MAM)[5],并能与MAM中的一些组成蛋白发生相互作用[6]。这也提示α-syn/A53T突变有可能破坏其在MAM中发挥的作用[7],进而损伤MAM。MAM是细胞内质网与线粒体链接的重要位点,发挥着重要的生理功能[8]。例如:MAM介导钙离子由内质网向线粒体的钙转运,MAM的钙转运功能可以为线粒体的膜蛋白提供高钙微环境,同时还可以进入线粒体基质,激活三羧酸循环。MAM在线粒体融合分裂的过程中,钙离子浓度通过调控DRP1来调节线粒体的分裂,MAM是贯通内质网与线粒体的重要亚细胞结构[9]。由于MAM与线粒体的结构与功能关系密切,研究α-syn/A53T突变是否损害MAM后导致线粒体结构异常对于理解α-syn突变后的致病机制具有非常重要的意义。
1 材料与方法
1.1 材料
人神经细胞母细胞瘤细胞系SH-SY5Y(本实验室保存),Prnp-SNCA-A53T小鼠(南京模式生物有限公司);DMEM高糖培养基和胎牛血清(Gibco公司);BCA蛋白定量试剂盒(Invitrogen公司);β-actin(华安生物科技有限公司);α-synuclein(Cell Signaling Technology);LDH检测试剂盒,Mito-Tracker red和Hoechst(上海碧云天生物技术有限公司);ATP检测试剂盒(Promega公司);PLA显色试剂盒;PLA小鼠探针和PLA兔探针(Thermo Fisher Scientific);Rhod2-AM(Abcam公司)。
1.2 方法
1.2.1 细胞的分组及处理:细胞传代后贴壁12 h以后,细胞增殖至80%汇合时进行细胞转染。将实验室构建的质粒EGFP-N1、EGFP-N1-α-syn、EGFP-N1-A53Tα-syn扩增后转染进SH-SY5Y细胞中。首先配制PEI转染混合物,孵育30 min。将培养皿中的培养基更换为不含青链霉素的培养基,然后将孵育好的转染复合物加入其中。6 h后更换加青链霉素的培养基。
1.2.2 Western blot检测目的蛋白:提取细胞或脑组织中的蛋白,用BCA的方法检测蛋白浓度。蛋白上样量为30 μg,经SDS凝胶电泳将蛋白分离后转至PVDF膜上,使用牛奶封闭液室温封闭1 h。加入对应的一抗后4 ℃过夜,洗膜后加入相对应的二抗室温孵育1 h。用Odyssey成像系统检测蛋白表达水平。
1.2.3 使用分子邻位杂交技术检测SH-SY5Y细胞内MAM的数量:具体方法参照Duolink®试剂的详细说明书。简单地说,将细胞固定、打孔、封闭后用Tom20以及Calnexcien分别标记线粒体以及内质网,因PLA方法可以表征40 nm以内的两个蛋白的相互作用,因此可用这种方法表征MAM的数量。将配对一抗室温孵育2 h。洗去一抗后将PLA小鼠探针以及兔探针稀释混匀后37 ℃孵育1 h。然后将寡核苷酸稀释后孵育30 min,将寡核苷酸结合在抗兔PLUS和抗小鼠MINS上。在酶的作用下能够形成一个封闭的连接体环状DNA。最后用稀释的聚合酶孵育100 min。放大信号(RCA)在聚合酶的作用下形成点状荧光信号,该信号能够在荧光显微镜下观察。最后用ImageJ软件对于PLA阳性点数进行统计。
1.2.4 用共聚焦显微镜检测线粒体形态:在细胞中转染不同质粒后,将Mito-Tracker red按1∶1 000用PBS进行稀释,然后37 ℃培养箱中孵育30 min对线粒体进行染色,弃掉染色液后用PBS洗两遍,再加入培养基。用共聚焦显微镜观察线粒体的形态。
1.2.5 LDH释放实验检测细胞毒性:首先96孔板中培养细胞,待转染不同质粒后24 h后进行LDH释放实验。首先加入LDH释放试剂,37 ℃培养箱孵育1 h。然后分别吸取各孔上清液120 μL加入至一个新的96孔板中。然后加入LDH检测工作液(现用现配),室温孵育30 min。然后在490 nm处测定吸光度值。
1.2.6 细胞钙离子的检测:将培养好的细胞先用PBS洗3遍,去除培养基,然后将Rhod2-AM钙离子探针用PBS稀释至0.5 mmol/L,然后在37 ℃培养箱中孵育细胞30 min,然后用PBS洗3次,以避免背景过高。然后用活细胞高速激光共聚焦荧光显微镜(Olympus公司)对细胞进行观察,先观察30 s后用100 mmol/L的组胺对细胞进行刺激,观察线粒体的荧光变化情况。
1.2.7 电镜观察线粒体形态:用0.9%氯化钠溶液对小鼠进行灌注,用4% PFA进行固定,然后取小鼠黑质经戊二醛固定后进行包埋,固定,切片,观察。
1.3 统计学分析

2 结果
2.1 成功构建过表达α-syn/A53T突变基因的SH-SY5Y细胞模型
将PEI作为转染试剂,质粒的转染效率高达80%(图1A,B)。用Western blot方法鉴定,在45 ku处可见清晰的条带,与EGFP-α-syn融合蛋白分子量相符(图1C)。
2.2 过表达α-syn/A53T突变体导致细胞毒性
在SH-SY5Y细胞中,α-syn/WT 组较Vector组LDH的释放含量增加(P<0.001);EGFP-α-syn/A53T以后与转染空载体组相比,α-syn/A53T组LDH释放量显著增加(P<0.001)(图2)。

A.photo of cell density under white light; B.transfection efficiency was observed by fluorescence microscope,scale bar=100 μm; C.α-syn expression was detected by Western blot

*P<0.001 compared with vector图2 过表达α-syn及其A53T突变体可以导致细胞毒性Fig 2 Over-expression of α -syn and its A53T mutant can lead to cytotoxicity n=3)
2.3 过表达α-syn/A53T突变体导致MAM数量减少
与Con组和Vec组相比α-syn/WT组,MAM的数量没有显著的变化。转染α-syn/A53T组的MAM的数量较Vec组以及α-syn/WT组,显著下降(P<0.001)(图3)。
2.4 MAM钙离子转运功能受损
SH-SY5Y细胞装载Rhod2-AM后标记线粒体内的钙离子。组胺刺激以后Vec组线粒体荧光强度明显增加,在达到峰值以后恢复到初始水平。α-syn/WT组中,加入组胺刺激以后也可观察到线粒体荧光强度增加,但增加程度低于Vec组。在α-syn/A53T组,在加入组胺刺激以后线粒体的荧光强度增加不明显(图4)。

After transfection of Vec (vector of plasmid), α-syn/WT and α-syn/A53T, cells were loaded with Rhod2-AM; confocal microscopy was used to dynamically detect the fluorescence intensity of cells; histamine 100 mmol/L was used to stimulate cells to observe the changes of mitochondrial fluorescence intensity, no less than 10 successfully transfected cells were observed, scale bar=25 μm
2.5 过表达α-syn/A53T突变体导致线粒体碎片化
用Mito-tracker标记线粒体,转染空载体的细胞中即Vec组线粒体主要为长棒状或长杆状,α-syn/A53T组的线粒体大部分以球状存在,α-syn/WT组的线粒体也受到损伤,形态介于杆状与球状之间。用ImageJ测量线粒体的横纵比值[10],统计发现α-syn/A53T组的线粒体横纵比值较Vec组显著下降(P<0.001)(图5)。
2.6 小鼠黑质组织电镜结果显示α-syn/A53T蛋白导致线粒体自噬
在WT小鼠组,观察黑质部位的线粒体形态呈长棒状,有双层膜,内膜向内凹陷形成嵴(图6A);在A53T突变小鼠黑质部位,观察到线粒体出现空泡以及线粒体自噬小体(图6B)。
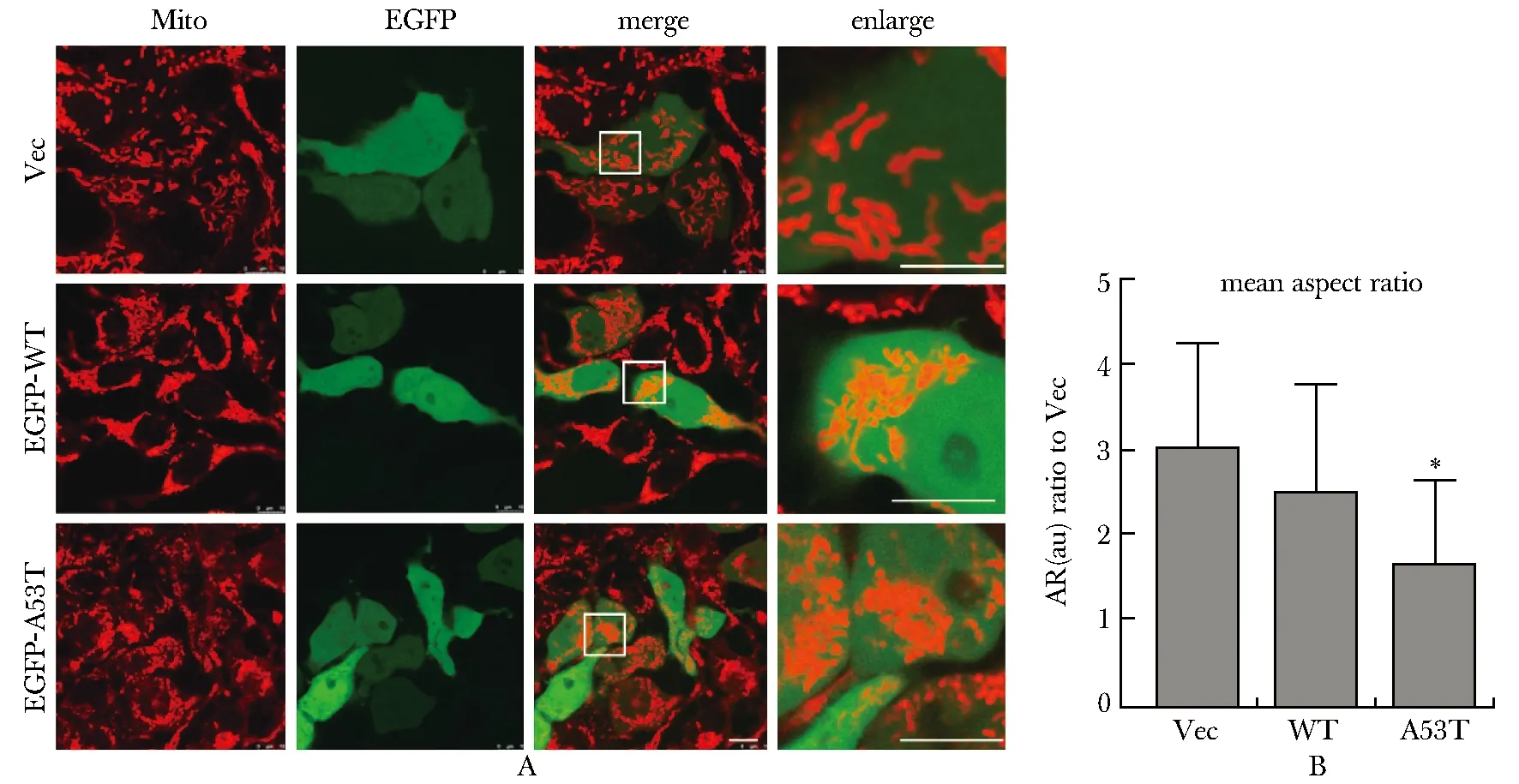
A.MitoTracker Red was used to label mitochondria to observe the effects of different components on mitochondrial morphology, the white box is the enlarged part, the scale bar=10 μm; B.the ImageJ software was used to conduct statistics on the transverse/longitudinal ratio of mitochondria, and the transverse/longitudinal ratio of the A53T group was significantly reduced; au (arbitrary units); *P<0.001 compared with vector

A.WT group, arrow refers to healthy mitochondria; B.A53T group, the arrow indicates vacuolar mitochon-dria and autophagy mitochondria图6 过表达α-syn/A53T突变体导致线粒体自噬Fig 6 Over-expression of α -syn/A53T mutants resulted in mitochondrial autophagy(scale bar=500 nm)
3 讨论
PD的发病机制复杂,α-syn过表达或突变都是导致多巴胺能神经元丢失的重要原因。先前有文章报道α-syn/A53T突变可以导致内质网应激[11]。还有文章报道α-syn/A53T突变可以导致线粒体结构功能障碍进一步引发细胞凋亡[12]。但是对于不同的损伤机制之间是否有相关的联系还不清楚。MAM是内质网与线粒体之间的重要亚细胞结构,MAM的损伤可能在帕金森病的发病机制中扮演重要作用。
通过向SH-SY5Y细胞中转染EGFP-N1空载体、EGFP-α-syn/WT以及EGFP-α-syn/A53T质粒,经Western blot实验证明成功构建过表达α-syn/A53T突变基因的人神经母细胞瘤细胞系。LDH释放实验表明α-syn/A53T LDH释放量显著增加,细胞毒性显著。为进一步探究A53T突变体的毒性机制,本课题将重点放在细胞器的相互作用上。使用分子邻位杂交技术标记MAM,通过计数不同组别MAM的数量,发现α-syn/A53T组MAM的数量明显下降。MAM数量减少以后是否会损伤内质网钙库中的钙离子向线粒体转运呢?为了观察这一过程,使用Rhod2标记线粒体钙离子,动态观察线粒体钙离子变化情况,发现过表达α-syn/A53T以后,相同剂量的组胺刺激,线粒体内的钙离子转运量减少。钙离子对于线粒体的形态与功能发挥着重要的作用,因此通过观察线粒体的形态来进一步观察MAM损伤后对于线粒体的影响。用Mito-tracker red标记线粒体,结果显示过表达α-syn/A53T以后线粒体碎片化明显。
先前研究表明α-syn是MAM结构中的一种蛋白[5]。α-syn可以与MAM结构中VDAC、VAPB等分子相互作用。IP3R-GRP75-VDAC是内质网与线粒体之间主要的钙离子通道[13],VAPB-PTPIP51也是钙通道的一种。通过本文结果,可以推测α-syn/A53T突变可能是通过损伤MAM,导致钙离子不能通过MAM转运至线粒体导致线粒体的结构功能紊乱,从而引发线粒体碎片化[14],以及线粒体自噬。线粒体损伤以后进一步导致对细胞的毒性,本研究发现α-syn/A53T对于MAM有破坏作用,提示α-syn可以通过影响内质网和线粒体两个细胞器之间的相互作用来影响细胞的状态。这提示可以从一个新的角度理解α-syn/A53T的致病机制,为以后寻找新的治疗靶标提供方向。
——疾病防治的新靶标

