中性粒细胞与淋巴细胞比率在诊断极低出生体质量儿晚发型败血症中的应用
郝庆飞,陈静,陈浩明,魏文金,张静,程秀永
(郑州大学第一附属医院 新生儿科,河南 郑州 450000)
晚发型败血症是指出生72 h后发生的败血症,是新生儿死亡的主要原因之一,是一个重要的全球公共卫生问题[1]。早产儿免疫系统发育不成熟,极易患感染性疾病,由于发病隐匿,常规的血清学检测不能及时有效的诊断。早期诊断和有效的治疗有助于预防严重和危及生命的并发症,从而降低死亡率。血培养是诊断败血症的金标准,但血培养时间长,培养阳性率较低。早产儿受制于采血量的限制,相较于成人血培养其阳性率更低。也有研究尝试采用分化群抗原64、白介素-6、白介素-8、降钙素原(procalcitonin,PCT)和C反应蛋白(C-reactive protein,CRP)等免疫相关的生物标志物辅助早期识别败血症[2]。CRP仍然是最常选择的生物标志物,但其敏感性和特异性不高。败血症是由感染引起的炎症反应,炎症在败血症的发生和发展过程中起重要作用。白细胞及其亚群对于免疫系统防御病原体感染至关重要。许多临床研究表明,中性粒细胞计数、中性粒细胞与淋巴细胞比率(neutrophil to lymphocyte ratio,NLR)是败血症的预测指标[3-4]。NLR被认为比绝对中性粒细胞或淋巴细胞计数更稳定。NLR因其作为早期诊断败血症的潜力引起了广泛关注[5-6]。然而,大多数关于NLR与败血症之间关系的研究都是在成年患者中进行的,较少有关于NLR与早产儿脓毒症之间关系的报道[7-8]。本研究探讨了NLR在极低出生体质量儿晚发型败血症中的诊断价值,现报告如下。
1 资料与方法
1.1 研究对象本研究为回顾性病例研究,经郑州大学第一附属医院伦理委员会批准(批准文号:2020-KY-228)。选取2019年1月至2020年12月在郑州大学第一附属医院出生血培养阳性的80例极低出生体质量儿作为晚发型败血症组,同时选取相同胎龄未发生感染的113例极低出生体质量儿作为对照组。纳入标准:(1)晚发型败血症组研究对象符合中国医师协会新生儿医师分会感染专业委员会制定的新生儿败血症诊疗方案中的相关诊断标准[9],且血培养结果阳性;(2)出生体质量小于1 500 g。对照组纳入标准:同期住院出生体质量小于1 500 g无窒息史的新生儿,住院期间未发生感染或炎症反应性疾病。所有患儿均完善血常规、CRP、PCT检测。排除标准:(1)非郑州大学第一附属医院出生新生儿;(2)早发型败血症;(3)患儿母亲有明确的自身免疫性疾病史;(4)存在先天性畸形、遗传代谢性疾病;(5)有手术、创伤史。
1.2 标本采集及检测方法在早产儿接受抗生素前采集其外周静脉血,严格遵循无菌操作(感染指标检查和血培养样本采集之间的时间差<8 h),进行血常规、CRP、PCT及血培养等检测。血常规检测:使用Beckman-Coulter 800全自动五分类血液分析系统进行全血细胞分类及计数。CRP检测:采用免疫比浊法日立7600型全自动生化分析仪测定,CRP>10 mg·L-1为阳性。PCT检测:采用免疫荧光法梅里埃miniVIDAS分析仪,PCT>0.05 μg·L-1为阳性;血培养则严格按无菌卫生标准采集送检,培养出致病菌为阳性。
1.3 观察指标及评价标准比较两组早产儿的血小板计数(platelet,PLT)、CRP、PCT、NLR、诊断效能,并分析相关指标在诊断极低出生体质量儿晚发型败血症中的价值。灵敏度=真阳性例数/(真阳性例数+假阴性例数)×100%,特异度=真阴性例数/(真阴性例数+假阳性例数)×100%。
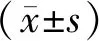
2 结果
2.1 一般资料共入选193例新生儿,其中晚发型败血症组80例,对照组113例,男婴104例,女婴89例。血培养阳性80例。其中革兰染色阴性杆菌41例,包括肺炎克雷伯菌33例,铜绿假单胞菌1例,嗜麦芽窄食单胞菌1例,大肠杆菌2例,摩氏摩根菌1例,黏质沙雷菌1例,伯克霍尔德菌2例;革兰染色阳性球菌34例,包括金黄色葡萄球菌8例,表皮葡萄球菌14例,粪肠球菌9例,头状葡萄球菌3例;真菌5例,包括假丝酵母菌4例,白念珠菌1例。对两组患儿的一般资料进行分析,结果显示,晚发型败血症组和对照组极低出生体质量儿胎龄、出生体质量、性别比较,差异无统计学意义(P>0.05)。见表1。

表1 两组早产儿一般资料比较
2.2 实验室检查结果两组新生儿的白细胞计数(white blood cell,WBC)检测数值差异无统计学意义,晚发型败血症组的PLT水平低于对照组,CRP、PCT及NLR水平均高于对照组,差异有统计学意义(P<0.05)。见表2。

表2 两组实验室检查结果比较
2.3 ROC曲线分析PLT诊断晚发型败血症敏感度为77.9%,特异度为75.0%,曲线下面积为0.83;CRP诊断敏感度为78.8%,特异度为93.8%,曲线下面积为0.85;PCT诊断敏感度为77.5%,特异度为95.6%,曲线下面积为0.90;NLR诊断敏感度为81.3%,特异度为98.2%,曲线下面积为0.95。见表3。

表3 CRP、PCT、NLR诊断晚发型败血症的ROC曲线分析
3 讨论
晚发型败血症是一种严重威胁新生儿生命的疾病,每年有近400 000名新生儿因败血症而丧生,尤其在发展中国家,与新生儿败血症有关的死亡事件要比发达国家高得多[10]。早产儿因免疫系统发育不成熟、接受机械通气、经外周插管的中心静脉导管置管等有创操作,极易发生晚发型败血症。Stoll等[11]多中心调查表明在极低出生体质量儿中,近2/3的新生儿在住院期间经历了不止一次疑似或经培养证实的晚发型败血症。一项包含超过108 000名极低出生体质量婴儿的大型队列研究显示,血培养阳性新生儿的死亡率为25.9%,而培养阴性婴儿的死亡率为11.3%[12]。即使晚发型败血症存活者,也存在神经发育落后的风险[13]。
在新生儿败血症诊断方面,公认的金标准是血培养,但其阳性率仅不足10%,且多在48 h后才能获得结果[14],从而可能导致延误治疗。因此,需要快速、高特异性和高灵敏度的检测,并可用于早期诊断。WBC是一种简单易行的方法,可在怀疑感染的情况下对新生儿进行常规评估。低白细胞数和高不成熟中性粒细胞/总中性粒细胞比值诊断新生儿败血症证据不足,但阴性预测值高达99%[15]。血小板是调节内皮通透性和募集粒细胞和巨噬细胞的非特异性一线炎症标志物。许多研究表明,PLT减少可以反映机体的炎症和免疫状态,但特异性不高。本研究提示PLT诊断晚发型败血症的敏感度为77.9%,特异度为75.0%。CRP水平在感染开始后6~12 h开始上升,并在48 h达到峰值。除了用作诊断标志物外,CRP还可以作为停用抗生素的指征,在怀疑感染后6 h以及24 h后连续测定均正常,对败血症的阴性预测值达99.7%[16]。但不同的研究发现,CRP的敏感性和特异性差异很大[2,17]。这种差异可能与胎龄及出生体质量相关。在本研究中,晚发型败血症组CRP水平高于对照组,差异有统计学意义,其敏感度为78.8%,特异度为93.8%,高于此前的研究[18]。这可能与本研究纳入的研究对象为极低出生体质量儿有关。PCT主要由单核细胞和肝细胞产生,可在感染后4~6 h开始升高,在18~24 h达到峰值[19]。在晚发型败血症患者中PCT在诊断及停止抗生素治疗方面均有一定的指导价值[20]。在一项评估PCT对新生儿败血症的诊断潜力的荟萃分析中,PCT诊断晚发型败血症的诊断价值高于早发型败血症[21]。本研究提示PCT诊断晚发型败血症的敏感度为77.5%,特异度为95.6%。
众所周知,中性粒细胞在先天免疫中发挥着至关重要的作用,提供机体快速感知和消除病原体的第一道防线。中性粒细胞的增加表明对微生物感染的反应,它们迅速迁移到受影响的区域。同时,中性粒细胞在吞噬作用、细胞因子释放和T细胞活化中发挥积极作用。淋巴细胞是获得性免疫的关键细胞,它为抗原提供了更广泛和更精细的识别库。淋巴细胞凋亡导致的淋巴细胞减少是败血症的一个突出特征,这可能是适应性免疫抑制的原因。因此,NLR反映了先天免疫和适应性免疫之间的平衡,是一种与免疫状态显著相关的有价值的生物标志物。尽管有研究表明,NLR、感染性休克和成人患者死亡率之间可能存在关系,但在早产儿败血症与NLR关联性的相关研究方面,目前极少有关于NLR在极低出生体质量儿晚发型败血症诊断价值的研究[22]。在Omran等[7]的研究中,比较脓毒症新生儿和健康婴儿的NLR值,发现脓毒症新生儿的NLR值要高得多,以NLR 2.7为截断值,其敏感性和特异性水平分别为80.0%和57.1%。本研究中,NLR诊断敏感度为81.3%,特异度为98.2%,曲线下面积为0.95,高于Omran等[7]的研究,可能与本研究患儿为极低出生体质量儿有关。
目前,关于NLR在早产儿晚发型败血症的研究极少,本研究尽管样本量小,但数据提示NLR诊断晚发型败血症的价值不逊于PCT,高于CRP,且不需要额外的检测成本。总之,NLR是一种简便、廉价和快速的诊断晚发型败血症的方法,可以减少不必要的抗生素治疗。但是,仍需要前瞻性、多中心、大样本量的研究证实NLR在晚发型败血症中的诊断价值。

