紫外分光光度法检测海南霉素的研究
池可心,姚卫蓉✉
(江南大学 食品学院,江苏 无锡 214122)
海南霉素钠(C47H79O15Na)是一种广泛添加在鸡、牛、羊等动物饲料中的新型一元酸聚醚类抗生素,主要用于防治球虫病[1]、调节生长代谢[2-3]。海南霉素的上市产品为含 1%海南霉素纯品的预混剂(球克),《中国饲料药物添加剂使用规范》规定其预混合饲料规格为 10 mg/g,目前海南霉素用于预防球虫病的使用以500~750 μg/g水平混饲(以海南霉素钠预混剂计)[4]。
目前饲料中海南霉素检测定量方法仅有液相色谱串联质谱法[5],海南霉素钠预混剂生产过程中检测方式仅有茴香醛衍生法–紫外分光光度法[6],液相色谱串联质谱检测成本高,对研究人员操作要求高,需要开发一种成本低、简单的方法以满足在简单条件下对海南霉素快速检测方法,同时为海南霉素钠预混剂生产控制中提供一种简单、准确的检测方法。
海南霉素没有发光基团,要通过分光光度法检测海南霉素,需要通过衍生法引入发色基团。目前聚醚类药物常用的衍生剂有茴香醛[6]、香草醛[7]、对二甲氨基苯甲醛[8]、2,4-二硝基苯肼(DNP)[9],本文前期尝试用不同衍生剂对海南霉素进行衍生化,包括DNP、茴香醛[6]、香草醛、对二甲氨基苯甲醛,发现除DNP外,都能与海南霉素发生显色反应。香草醛等衍生剂一般与浓硫酸、浓盐酸配合使用,加浓酸的目的主要是使羧基脱水、提供酸环境。香草醛浓酸显色原理是海南霉素与香草醛发生双分子缩合生成共轭双键系统,浓酸使目标物分子中羧基脱水,增加双键结构,再经双键位移等反应生成共轭双键[10-11],如图1所示。本文拟利用对二甲氨基苯甲醛、香草醛衍生,通过调节衍生剂浓度、温度、不同的酸及浓度对衍生条件进行优化,以达到较低的检测限,建立一种低成本、操作简单的方法检测海南霉素,用于快速检测饲料、海南霉素钠预混剂中海南霉素的含量。

图1 海南霉素衍生示意图Fig. 1 Derivative diagram of hainanmycin
1 材料与方法
1.1 材料与试剂
海南霉素标准品:中国兽医药品监察所;海南霉素钠预混剂(含1%海南霉素):山东胜利生物工程有限公司;香草醛、茴香醛、对二甲氨基苯甲醛(分析级):北京百灵威科技有限公司;盐酸、硫酸、甲醇、乙醇(分析级):上海国药集团有限公司;鸡饲料,石家庄正大饲料。
1.2 仪器与设备
小型高速粉碎机:河北本辰科技有限公司;VORTEX-GENIE2型SI可调速漩涡混合器:美国Scientific Industries公司;SHZ-B水浴恒锅:上海晶谈仪器制造有限公司;T10系列双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;干式氮吹仪:上海梓桂仪器有限公司;Thermo Scientific台式离心机:美国 Thermo Fisher Scientific;Milli-Q 超纯水系统:美国 Millipore公司。
1.3 实验方法
1.3.1 对二甲氨基苯甲醛衍生剂的制备与检测
对二甲氨基苯甲醛衍生剂:90 mL无水乙醇,加入3 g对二甲氨基苯甲醛,超声溶解后置于冰水中,缓缓加入10 mL浓硫酸,混匀,避光保存,两周内有效。
称取海南霉素钠标准品用乙醇稀释至 20~200 μg/mL得到一系列不同浓度稀释液,取样品溶液 0.6 mL(以无水乙醇为空白对照)、显色剂0.4 mL置于10 mL 具塞试管内,涡旋震荡1 min混匀,放入90 ℃恒温水浴中5 min,取出试管后用冷水冷却,在λmax= 600 nm处测得其吸光度值,以海南霉素浓度为横坐标,吸光度值为纵坐标绘制标准曲线。
1.3.2 香草醛衍生剂的制备与检测
香草醛衍生剂:4 g香草醛溶于80 mL乙醇中,搅拌溶解,置于冰水中,缓缓加入20 mL浓盐酸,摇匀后放置4 ℃冰箱保存,两周内有效。
称取海南霉素标准钠盐标准品用乙醇稀释至5~50 μg/mL得到一系列不同浓度稀释液,取样品溶液 0.6 mL(另取无水乙醇为空白对照),置于10 mL具塞试管内,加入0.4 mL香草醛衍生剂,涡旋震荡1 min混匀,放入90 ℃恒温水浴中反应5 min,在λmax= 590 nm处测得其吸光度值,以海南霉素浓度为横坐标,吸光度值为纵坐标绘制标准曲线,衍生示意如图1。
1.4 香草醛衍生条件的优化
1.4.1 酸种类与浓度对吸光度值的影响
在反应温度75 ℃、反应时间35 min香草醛浓度4%(g/100 mL)的条件下,加入不同浓度的盐酸、硫酸配置衍生剂,硫酸浓度分别为2.5%、5%、10%、15%、20%,盐酸浓度分别为5%、10%、15%、20%、25%,以海南霉素浓度10 μg/mL按照1.3.2检测方法分别测得吸光度值。
1.4.2 香草醛浓度对吸光度值的影响
固定反应温度75 ℃、反应时间35 min,以盐酸浓度20%配置衍生剂,香草醛浓度分别为1、2、4、6 g/100 mL,以海南霉素浓度10 μg/mL按照1.3.2检测方法分别测得吸光度值。
1.4.3 反应温度、时间对吸光度值的影响
香草醛浓度 4%,盐酸浓度 20%,配置衍生化试剂,量取衍生化试剂液0.4 mL于10 mL具塞试管中,加入0.6 mL乙醇–海南霉素标准品溶液(海南霉素浓度为10 μg/mL),涡旋震荡1 min摇匀,分别放置 65、75、85、90 ℃水浴中反应5、15、25、35、45、55 min后,取出冷却至室温,在590 nm处测得最大吸光度值。
1.4.4 衍生剂占反应总体积比对吸光度值的影响
香草醛浓度 4%,盐酸浓度 20%,配置衍生化试剂,量取衍生化试剂0.1、0.2、0.3、0.4、0.5、0.7 mL于10 mL具塞试管中,分别加入0.9、0.8、0.7、0.6、0.5、0.3 mL的乙醇–海南霉素标准品溶液(海南霉素含量均为10 μg),涡旋震荡1 min摇匀,置90 ℃水浴中反应5 min,取出试管冷却至室温,在590 nm处测得最大吸光度值。
1.4.5 衍生反应后产物稳定性考察
取样品溶液0.6 mL海南霉素10 ug/mL(另取乙醇为空白对照),置于10 mL具塞试管内,加入0.4 mL一定浓度的香草醛4%–盐酸20%乙醇溶液(现用现配),涡旋震荡 1 min混匀,放入90 ℃恒温水浴中避光反应5 min后在590 nm处测得其吸光度值,分别在0.5、1、1.5、2、2.5、3、4、12 h时间段监测其紫外吸收变化情况,考察其衍生反应物的稳定性。
1.5 饲料中海南霉素的检测
在空白鸡饲料中加海南霉素,制得含有5、10、50 mg/kg海南霉素水平的样品饲。称取2 g鸡饲料,置于50 mL离心管内,加入8 mL乙酸乙酯,震荡提取2 min,放入超声清洗机中,超声提取5 min后,用离心机5 000 r/min离心5 min后取上清,转移至烧瓶中,于45 ℃旋转加热蒸发至近干,然后加入2 mL乙腈复溶,取出至离心管中,再加入2 mL乙腈饱和正己烷溶液震荡1 min,用离心机在5 000 r/min下离心5 min,去除正己烷层溶液,将下层溶液用氮气吹至近干,加入 0.6 mL 90%乙醇溶液复溶,转移至10 mL具塞量筒中,按照方法3.2.5进行检测,测得590 nm处吸光度值,用基质匹配标准曲线计算回收率。
因为饲料基质在与香草醛衍生化时会有基质干扰,需要用基质标准曲线定量。空白饲料提取净化后,用0.6 mL 5~50 μg/mL海南霉素标准溶液复溶,按照方法 1.3.2进行测定绘制基质标准曲线。
1.6 预混剂中海南霉素的检测
对海南霉素钠预混剂提取溶剂进行优化,在2 g海南霉素钠预混剂,分别加入10 mL甲醇、乙醇、乙腈、乙酸乙酯、异辛烷,震荡 2 min,超声提取5 min,取0.5 mL定容至100 mL,取100 μL按照方法1.3.2进行检测。
1.7 数据分析
所有实验至少进行三次,用SPSS 25.0和EXCEL 2021对数据进行统计和分析,Origin 2021b软件进行作图处理。
2 结果与讨论
2.1 对二甲氨基苯甲醛法
对二甲氨基苯甲醛对海南霉素衍生后,最大吸收波长在 600 nm处,对二甲氨基苯甲醛衍生条件进行优化,包括衍生剂浓度、衍生反应温度、酸的种类及浓度等。在优化条件下结果见图2所示,其最低检测浓度为20 μg/mL,海南霉素浓度在 20~200 μg/mL与吸光度值线性拟合良好,R2>0.99,但由于该方法检测限高,不能满足检测饲料中低浓度的要求,因此此方法仅能适用于检测标准品溶液和预混剂中高浓度海南霉素检测。
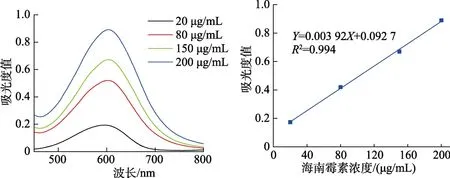
图2 对二甲氨基苯甲醛衍生海南霉素紫外分光图和线性回归拟合图Fig. 2 UV spectra and linear regression fitting of Hainanmycin derivatived by p-methylaminobenzaldehyde
2.2 香草醛法
香草醛对海南霉素衍生后,最大吸收波长在590 nm处,对香草醛衍生条件进行优化,衍生剂浓度、温度,使用酸浓度等,如图3所示其最低检测浓度为5 μg/mL,海南霉素浓度与吸光度值线性拟合均良好,R2大于0.99,能满足检测饲料中低浓度的要求,此方法能适用于检测标准品溶液、饲料中常量级海南霉素检测、预混剂中高浓度海南霉素检测。

图3 香草醛衍生海南霉素紫外分光图和线性回归拟合图Fig. 3 UV spectra and linear regression fitting of vanillin-derived hainanmycin
2.3 酸种类与浓度对香草醛衍生吸光度值的影响
如图4所示,使用不同浓度硫酸、盐酸配置香草醛衍生剂,在相同的反应条件下,香草醛衍生剂使用硫酸、盐酸的最佳浓度分别为10%、20%时效果最好,使用20%盐酸时效果优于10%硫酸,因此,决定使用20%盐酸作为香草醛衍生剂的使用酸及浓度。

图4 不同酸及使用浓度对海南霉素衍生化效果Fig. 4 Effect of different acids and concentrations on derivative hainanmycin
2.4 香草醛浓度对香草醛衍生吸光度值的影响
在相同反应条件下,75 ℃水浴加热35 min,以盐酸浓度为20%,香草醛浓度分别为1、2、4、6 g/100 mL配置不同香草醛含量的衍生剂,结果如图5所示,随着香草醛浓度的升高,衍生效果越好,当香草醛含量为 4%时,在海南霉素相同浓度下衍生产物吸光度值最高,当再增加香草醛的含量时,衍生效果反而变差、吸光度值下降,因此选择香草醛含量为4%时配置衍生剂。

图5 不同香草醛浓度衍生剂衍生效果Fig. 5 Effects of different vanillin concentration derivatives on derivatization
2.5 反应温度、时间对香草醛衍生吸光度值的影响
如图6所示,在反应温度 65 ℃时,吸光度值随着反应时间的增加而呈现缓慢增加的趋势;在反应温度 75 ℃时,吸光度值随着反应时间先增加后降低的趋势,反应时间为35 min时吸光度值达到最大;在反应温度85 ℃时,吸光度值随着反应时间先增加后降低的趋势,反应时间为15 min时吸光度值最高;反应温度 90 ℃时,在 5 min时吸光度值就达到最高,随着反应时间延长吸光度值下降,乙醇逐渐蒸干,海南霉素也可能在高温下分解。因此选择温度90 ℃、时间5 min作为最佳反应时间和温度。
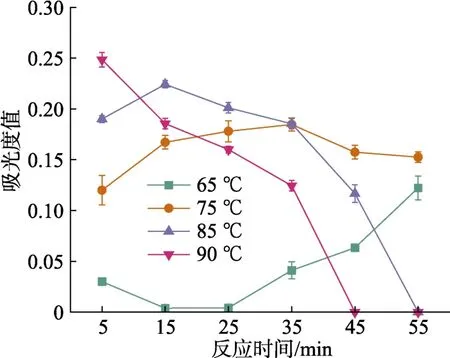
图6 不同反应温度和时间对香草醛衍生海南霉素的影响Fig. 6 Effect of different reaction temperature and time on vanillin-derived hainanmycin
2.6 衍生剂占反应总体积比对香草醛衍生吸光度值的影响
如下图7所示,控制反应总体积为1 mL,随着衍生剂占反应总体积比增高,吸光度值呈现先升后降的趋势。衍生化试剂与乙醇溶液反应体积比4∶6时,吸光度值达到最大;体积占比超过 4∶6后,吸光度值逐渐降低,可能衍生化试剂浓度过高影响其与香草醛发生缩合,导致海南霉素反应不充分,因此选择最适宜的衍生化体积比为4∶6。
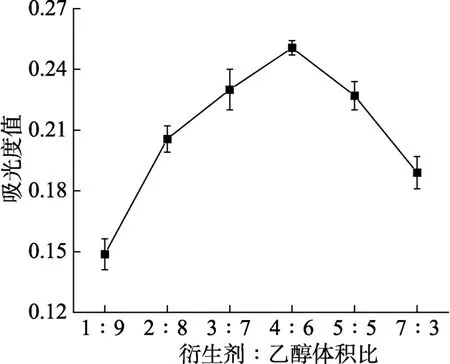
图7 衍生剂体积与乙醇反应体积比对海南霉素衍生化影响Fig. 7 Effect of the ratio of derivative volume to ethanol reaction volume on the derivatization of hainanmycin
2.7 香草醛衍生反应后产物稳定性考察
如图8所示,此显色反应很稳定,反应后产物在1 h内吸光度下降不足5%,且在12 h内显色度都无明显变化。因此,此衍生反应生产的衍生物很稳定,能够满足检测需求。

图8 显色反应稳定性Fig. 8 Color reaction stability
2.8 香草醛其他聚醚类抗生素衍生反应
用香草醛同样对马杜霉素、莫能菌素[12]、盐霉素进行衍生反应(20 μg/mL),在400~800 nm波长扫描下,如下图9所示,其各自最大吸收波长分别为464、517、522 nm,与海南霉素590 nm能够明显区分开来,说明香草醛衍生海南霉素的衍生产物具有可分辨的独特性。

图9 香草醛衍生不同聚醚类药物的紫外光谱图Fig. 9 UV spectrum of vanillaldehyde derived different polyether drugs
2.9 饲料中海南霉素的提取溶剂选择
称取2 g鸡饲料,分别使用不同的提取试剂乙酸乙酯、乙腈、甲醇、异辛烷、90%乙腈水按照1.5方法进行提取净化,并用香草醛衍生剂按照方法1.3.2进行检测,测得590 nm处吸光度值,用基质匹配标准曲线计算回收率。如图10所示,乙酸乙酯的回收率较高,因此使用乙酸乙酯作为饲料中海南霉素的提取溶剂。

图10 不同溶剂提取饲料中海南霉素回收率(n=3)Fig. 10 Recovery rate of hainanmycin from feed by different solvents (n=3)
2.10 预混剂中海南霉素的提取溶剂选择
对比甲醇、乙醇、乙腈、乙酸乙酯、异辛烷提取海南霉素钠预混剂(1%海南霉素)的回收率,结果图11所示,相同的条件下,甲醇的回收率最高,理论回收率高达93.3%~100.0%,乙醇、甲醇、乙酸乙酯次之,甲醇更适用于海南霉素钠预混剂的提取,回收率最高。
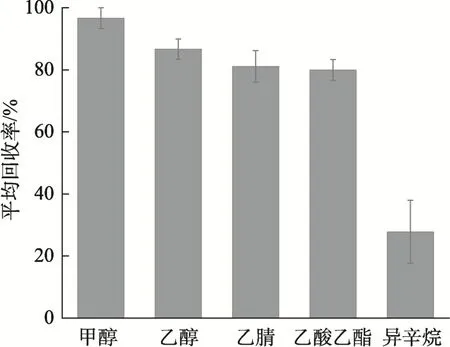
图11 不同溶剂提取海南霉素钠预混剂回收率(n=3)Fig. 11 Recovery rates of hainanmycin sodium premix extracted with different solvents
2.11 方法学考察
2.11.1 饲料中海南霉素的检测
前处理按照方法 1.3.2进行,海南霉素 5~50 μg/mL浓度范围内,计算出饲料基质匹配标准曲线为 y = 0.021 9x + 0.044 4,R²>0.99,由 3σ/K计算出LOD为1.6 μg/g,定量限为4.8 μg/g。鸡饲料在5、10、50 μg/g海南霉素加标水平下,每个加标水平三个平行,回收率如表1所示,在75%~94%,通过分析这些加标样品,计算日内精密度,一天重复3次。日内相对标准偏差为3.1%~11.2%,小于 15%,能够满足饲料中海南霉素检测需求。
2.11.2 市场产品的实际检测结果
由山东胜利公司提供的海南霉素钠预混剂(1%海南霉素),按照方法 1.6进行提取,按照1.3.2香草醛衍生法方法进行检测,计算预混剂中海南霉素含量,每个样品三个平行,一天重复三次计算日内相对精密度。结果如表2所示,本方法的回收率在 83%~101%,日内相对标准偏为4.7%~5.7%,均小于15%,满足检测需求。

表2 市场产品的实际检测回收率和相对标准偏差Table 2 Recovery rate and relative standard deviation of hainanmycin %
3 结论
本文通过对二甲氨基苯甲醛法、茴香醛法对海南霉素进行衍生,能够对饲料、预混剂中海南霉素检测。同时优化了饲料和预混剂中海南霉素的提取条件,乙酸乙酯用于饲料中提取、甲醇用于海南霉素钠预混剂提取效果较好,香草醛衍生法在饲料和预混剂中回收率分别 75%~94%、83%~101%,相对标准偏差分别为 2.7%~8.4%、5.2%~7.3%,方法灵敏度高、特异性强、简单快速,且能够与其他聚醚类抗生素与香草醛衍生后的产物区分开来(最高吸收波长不同),香草醛衍生后海南霉素590 nm,盐霉素522 nm,马杜霉素464 nm,可以作为测定饲料和海南霉素钠预混剂中海南霉素含量的一种有效手段。

