高果糖饮食诱导代谢综合征的分子机制研究进展
甘倩云,孙学谦,宋歌,彭文婷,徐美虹,綦文涛,1✉
(1. 上海理工大学 健康科学与工程学院,上海 200093;2. 国家粮食和物资储备局科学研究院 粮食品质营养研究所,北京 100037;3. 山东西王糖业有限公司技术中心,国家玉米深加工产业技术创新中心,山东 滨州 256209;4. 北京大学 公共卫生学院,北京 100191)
果糖(Fructose)是一种单糖,是葡萄糖的同分异构体,分子式是 C6H12O6。自上世纪五十年代以来,果糖作为甜味剂,广泛用于食品工业[1]。除了果糖的价格低廉外,其较好的口感也使得果糖的消费量不断升高。果糖摄入并不能减少胃分泌饥饿素(Ghrelin),所以单独摄入果糖时,给人带来的饱腹感很低,导致一次性摄入大量果糖,增加食物的总热量[2]。
而高剂量的果糖摄入会导致代谢综合征的发生。如过量的果糖摄入已被证明会促进脂肪生成,在肝脏中囤积脂肪,引发肥胖[3-4]和非酒精性脂肪性肝病(Non-alcoholic fatty liver disease,NAFLD)[5-6],导致人体代谢异常,并引起一些并发症,比如胰岛素抵抗和Ⅱ型糖尿病[7]等。高剂量果糖摄入还会在代谢过程中累积大量的中间产物,这些产物也会对机体造成影响。比如,果糖在代谢过程中会快速并大量的消耗三磷酸腺苷(ATP),且这一过程不可逆,最终造成一磷酸腺苷(AMP)在体内积累,刺激 AMP脱氨基酶活性增加,并使 AMP转化为尿酸,而尿酸的逐渐积累会诱发高尿血酸症[8]。因此,近年来,果糖的健康效应和安全性得到了大量的关注,与之相关的研究也逐渐成为热点。
现代营养学要求从分子水平上深入揭示营养物质在体内的作用机制,如信号转导、基因表达和蛋白修饰等,并用分子生物学技术评价营养的需要量和食物的营养价值。本论文针对果糖影响研究较多的肥胖和非酒精性脂肪型肝炎等代谢综合征,对其摄入所调控的分子信号通路进行了综述分析,以期为果糖的合理消费和生物学效应的深入研究提供参考。
1 果糖的吸收和代谢
1.1 果糖的吸收
果糖进入体内后,首先在小肠内被吸收并转化为葡萄糖和其他代谢物,摄入低剂量果糖时,90%的果糖会被小肠吸收,当果糖剂量≥1 g/kg,超过肠道对果糖的吸收能力,多余的果糖会在肝脏中代谢,甚至到达结肠,作为结肠中微生物的养料,并影响菌群结构[9-10]。当人体摄入 3 000千卡饮食时,若果糖的占比达到40%时会导致腹泻[11]。果糖和其他单糖如甘露糖和半乳糖从肠道被吸收后,须经肝脏转化为葡萄糖才能被机体利用。人体中的己糖转运是由基因家族 SLC2A中的GLUT(Glucose transporters,葡萄糖转运体)蛋白介导的,而只有GLUT2(Glucose transporters type 2)和 GLUT5(Glucose transporters type 5)这两个蛋白明显具有促进果糖转运的能力。其中GLUT5转运果糖的能力更突出,GLUT5不需要依赖 Na+转运子就可以完成果糖运输。进入体内的果糖首先由肠上皮细胞表面的 GLUT5特异性地通过跨顶膜运输转运到细胞质,然后由GLUT2从细胞质运输到门静脉血液中[12],但其流出机制暂不明确[13]。
1.2 果糖的代谢
果糖被果糖激酶(Ketohexokinase,KHK)磷酸化,从而保持肠腔到胞浆的梯度便于果糖的摄取。KHK缺失会降低果糖的转运率[14]。果糖代谢和葡萄糖代谢有所不同,在葡萄糖代谢过程中,磷酸果糖激酶能够催化6-磷酸果糖转化成1,6-二磷酸果糖,但它会被ATP和柠檬酸盐抑制,因此也被称作葡萄糖代谢过程中的限速酶,这一过程也是限速步骤。然而在果糖代谢中不需要经过限速酶的作用,完全避开了这一过程,所以果糖代谢比葡萄糖更容易。部分果糖在肠道、肝脏、肾脏和大脑等多种组织中,果糖先被果糖磷酸激酶磷酸化为1-磷酸果糖,然后由醛缩酶催化裂解为磷酸二羟基丙酮和甘油醛。甘油醛可以通过丙糖激酶转化为3-磷酸甘油醛,然后进入糖酵解代谢过程[11],同时磷酸二羟基丙酮也会转化成 3-磷酸甘油醛和3-磷酸甘油,然后3-磷酸甘油在酰基辅酶A的作用下转化成酰基甘油,最后和载脂蛋白结合形成脂蛋白,一般是极低密度脂蛋白[15]。还有部分的果糖被代谢成葡萄糖和乳酸,乳酸也是一种糖异生底物。当果糖增加葡萄糖生成时,大部分葡萄糖被肝脏吸收,通过刺激葡萄糖 K-酶生成葡萄糖-6-磷酸,然后用于产生糖原[16]。因此,果糖也能促进糖异生和糖原积累。
2 果糖调控多个信号通路
2.1 果糖与PI3K/AKT信号通路
磷脂酰肌醇 3-激酶(PI3K)/蛋白激酶 B(AKT)信号通路在控制基本细胞功能中起着至关重要的作用,包括但不限于调控细胞增殖、存活、新陈代谢等[17]。PI3K分为三类,分别是Ⅰ类、Ⅱ类和Ⅲ类PI3K,其中Ⅰ类PI3K的研究最为普遍,它是由p110催化亚基和p85调节亚基组成的异源二聚体,通过激活下游酪氨酸激酶来发挥自身的功能[18]。丝氨酸和苏氨酸激酶AKT,也称为蛋白激酶 B,也有三种亚型,AKT1,AKT2和AKT3[19]。其中AKT1和AKT2大多存在于组织中,而 AKT3主要在大脑中表达[20]。PI3K/AKT信号通路的下游信号有很多,比如胰岛素受体底物-1(IRS-1)和GLUT1等蛋白,以及线粒体氧化磷酸化(OXPHOS)等通路[21]。
Hsiao Huang Chang等[22]将形成钙化重要来源的人瓣膜间质细胞(HVICs)与果糖共同孵育24 h,实验结果表明,高果糖组PI3K P85、AKT、p-AKT和p-IRS1的表达显著增加,IRS1的表达无显著变化。同时结果发现高果糖摄入会通过激活PI3K/AKT线粒体OXPHOS通路,使人血管内皮细胞提前钙化,最终造成主动脉瓣狭窄。Xiaofang Chen等[23]使用10%果糖溶液喂养SD大鼠,试验结果表明,高果糖饮食组大鼠总PI3K和AKT表达水平显着增加,GLUT1水平也显著高于对照组,且大鼠的主动脉厚度明显增加。因此,通过这些结果我们可以得出如下推论,即高果糖饮食通过诱导PI3K的高表达,从而激活AKT信号,并进一步激发下游GLUT1和线粒体OXPHOS信号通路,导致血管受到损伤,甚至发展为心血管疾病,如图1所示。

图1 果糖对PI3K/AKT信号通路的调控Fig.1 Regulation of PI3K/AKT signaling pathway by fructose
2.2 果糖与NF-κB信号通路
核转录因子-κB(nuclear factor-kappa,NF-κB),属于 Rel家族,广泛存在于各类细胞中。NF-κB家族有 5 个成员,包括 NF-κB1(p50)、NF-κB2(p52)、RelA(p65)、RelB和 c-Rel,通常所说的 NF-κB蛋白,是指 p65/p50亚单位构成的 NF-κB1二聚体蛋白;RelB/p52亚单位形成NF-κB2二聚体蛋白[24-25]。在正常状态下,NF-κB通常与其抑制蛋白IκB结合,以非活性方式储存在细胞质中,NF-κB激活信号在有效刺激下激活 IκB 激酶(IKK),诱导IκB磷酸化和释放,从而消除IκB对NF-κB的抑制作用[26],活化NF-κB通路,此外,p65的翻译后修饰,也调节NF-κB通路活性[27],促进下游炎症相关基因的转录和表达,在机体免疫、组织炎症、细胞增殖、分化和凋亡等方面发挥调控作用。
Chao Wang等[28]研究发现,SD大鼠喂食35%的果糖饮食 4、8、12 周后,NF-κB 通路中的 IKKβ、IκB和 NF-κB/p65等蛋白的表达水平上调,且以时间依赖性的方式显著激活,并引起大鼠血清中的脂质增加、肝脏中脂质积累以及胰岛素抵抗。Jaiswal N.等[29]使用不同浓度的果糖(5~25 mmol/L)分别培养树突状细胞(DC)24、48和72 h,发现细胞中IκB-α磷酸化使蛋白质泛素化并导致NF-κB激活和p65蛋白易位到细胞核,导致 DC细胞发生炎症反应。Veličković等[30]使用 20%果糖饲料喂养Wistar 大鼠9周后发现,NF-κB通路的激活以及肝脏内炎症因子IL-1β和TNF-α等的表达升高。还有研究证明妊娠和哺乳期间过量摄入果糖会抑制神经元PPARγ(过氧化物酶体增殖物激活受体 γ)的核表达,进而诱导胶质细胞NF-κB的表达增加,导致促炎细胞因子的积累和脂质的过氧化,最终引起成年雌性后代的CA1、CA3和DG出现轻度海马神经炎症,即母体高果糖饮食会通过抑制成年雌性后代的 PPARγ表达来触发NF-κB相关的神经炎症和氧化应激[31]。通过上述结果的分析可以推断,高果糖饮食会通过诱导 IKK活性或抑制 PPARγ表达,提高机体NF-κB表达活性,从而诱发脂质积累和胰岛素抵抗,NF-κB的活化还会导致下游炎症信号通路的激活,产生更多的炎症因子和相关并发症,如图2所示。

图2 果糖对NF-κB信号通路的调控Fig.2 Regulation of the NF-κB signaling pathway by fructose
2.3 果糖与JAK-STAT信号通路
JAK(Janus kinase,Janus激酶)-STAT(signaling transducer and activator of transcription,信号转导和转录激活剂)信号通路是近年来发现的一种简单的膜到核信号通路,也是一条由细胞因子刺激的信号转导通路[32]。它主要由酪氨酸激酶相关受体(接收信号)、酪氨酸激酶 JAK(传递信号)和转录因子 STAT(产生效应通路)这三个成分组成。JAK激酶家族有4种非受体酪氨酸激酶,分别是:JAK1、JAK2、JAK3和 TYK2。STAT蛋白家族则包括7个结构和功能相关的蛋白,主要的有STAT1、STAT2和STAT3[33]。当细胞因子配体与受体结合后可以磷酸化激活JAK,并磷酸化下游靶蛋白 STAT,然后使其二聚体化后,易位到细胞核内与特定的 DNA序列结合,激活或者抑制下游基因的转录[34],以此来调节细胞的分化、增殖、凋亡和炎症反应等许多重要的生物学过程[35]。
Guang-YaoZhou等[36]用10%的果糖水溶液喂养SD大鼠5周,发现果糖上调了大鼠肝脏中p-JAK2、p-STAT3及下游 Bcl-xL、Cyto-c、Caspase-9和Caspase-3等蛋白的表达,并导致大鼠肝炎的发生。Chao Wang等[28]研究发现,果糖摄入诱导了JAK/STAT通路中的JAK2和STAT3蛋白水平的上调,激活炎症通路并导致全身性铁缺乏和肝脏铁蓄积。Yan-zi Yang等[37]喂养SD大鼠10%果糖溶液连续17周,结果发现高剂量果糖摄入在激活了 JAK2/STAT3信号通路的同时,还激活了TGF-β1/Smad信号传导,导致大鼠肝纤维化的产生。通过上述结果的分析可以推断,高剂量的果糖可以直接或通过细胞因子诱导JAK2/STAT3信号通路的活性,激活炎症通路,引起肝脏炎症;或通过激活TGF-β1/Smad通路,诱发肝脏炎症甚至肝纤维化的发生,从而引起肝脏病变,如图3所示。
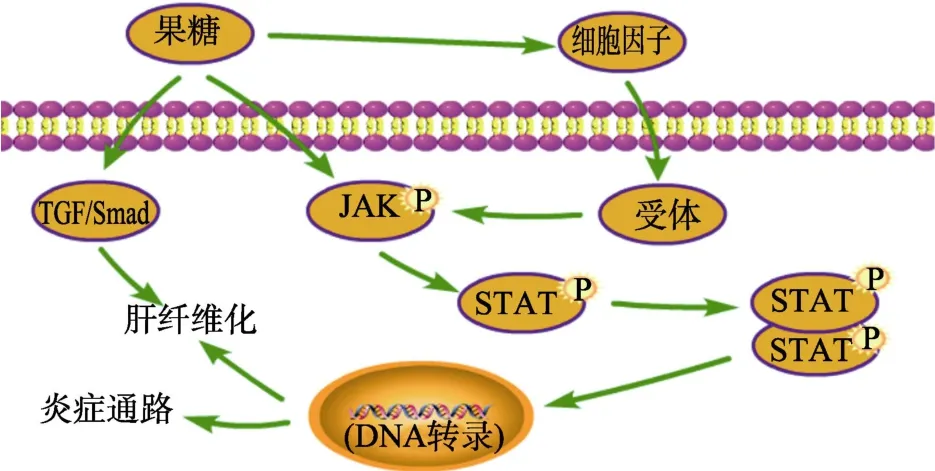
图3 果糖对JAK-STAT信号通路的调控Fig.3 Regulation of the JAK-STAT signaling pathway by fructose
2.4 果糖与AMPK信号通路
AMPK(AMP-activated protein kinase,AMPK,AMP激活蛋白激酶)是丝/苏氨酸蛋白激酶,对调节真核生物细胞和机体代谢的能量平衡起关键作用[38],几乎包含生命体的整个生理代谢活动。当细胞内二磷酸腺苷/三磷酸腺苷(ADP/ATP)的比率升高,会导致 AMP/ATP的比率更大程度升高,此时代表着细胞能量不足,AMPK被磷酸化激活[39-40]。AMPK激活可以阻止胰岛素抵抗和肝脏炎症[41],从而恢复糖尿病患者肝脏和其他组织的正常功能[42]。钙/钙调素依赖蛋白激酶(CaMKK)β和肝激酶 B1(LKB1)是级联中的两个上游激酶,当CaMKK被钙离子激活,或LKB1与其辅助因子STRAD和MO25组成异源三聚体时,使AMPK信号通路被激活[43]。
目前有多个研究发现,通过调控AMPK信号通路扭转高果糖引起的脂肪积累过程。LiXin Tan等[44]用60%的果糖饲料(HFD)喂养大鼠6周后注射吡格列酮(PPARγ的激活剂),结果发现吡格列酮通过增加 p-AMPK基因的表达,降低了HFD大鼠的体重增加速度和内脏脂肪重量。果糖在代谢过程中会快速并大量消耗ATP,有研究发现,高果糖产生大量 6P-葡萄糖,导致胰岛素抵抗和 ATP耗竭,而安特罗丹(Antrodan)可通过刺激 AMPK磷酸化诱导 Sirt1的表达,Sirt1与pAMPK一起抑制高果糖诱导的脂肪酸合成酶(FAS)活性和总甘油三酯(TG)水平,减轻或改善非酒精性脂肪肝疾病[45],即 AMPK磷酸化是抑制高果糖诱导的脂质积累的关键途径。另有研究发现,C57BL/6型小鼠在含有35%果糖的饮食下饲养8周后,AMPK、p-AMPK和p-胰岛素受体1(pIRS1)表达量降低,并导致更高的胰岛素抵抗和胰岛素信号传导失败。高果糖饮食还被发现能够抑制痩素(Leptin)和脂联素(Adiponectin)的表达[46]。而两者可分别通过痩素受体(Ob-Rb)和脂连素受体(AdipoR)诱导CaMKK通路活性,从而激活AMPK通路。因此,我们可以推断,高剂量果糖的摄入会通过两条途径抑制 AMPK信号通路活性,一是通过能量失衡降低 ADP/ATP比率,抑制AMPK磷酸化水平,进而诱发胰岛素抵抗或肝脏炎症;二是通过抑制瘦素和脂联素表达水平,阻止CaMKK被钙离子激活,抑制AMPK磷酸化水平,促进肝脏脂肪的积累从而导致NAFLD的高风险,如图4所示。

图4 果糖对AMPK信号通路的调控Fig.4 Regulation of the AMPK signaling pathway by fructose
2.5 果糖与MAPK信号通路
MAPK(丝裂原活化蛋白激酶)级联在将细胞外信号转导到细胞核内的过程中起着关键作用,MAPK位于蛋白激酶级联反应中,有三级的信号传递过程:MAPK,MAPK激酶(MAPKK)以及 MAPK激酶激酶(MAPKKK)[47]。这三种激酶能依次激活,共同调节着细胞的生长、分化、应激、炎症反应等多种重要的生理和病理效应[48]。至少有三种不同的 MAPK信号通路:细胞外信号调节激酶(ERK MAPK),c-Jun NH2-末端激酶或应激激活蛋白激酶(JNK或SAPK)和 p38MAPK[49]。
Wei Wang等[50]发现高果糖喂养的大鼠肾小球内,活性氧ROS增加,并进一步诱导了p38MAPK的磷酸化和硫氧还蛋白互作蛋白(TXNIP)的表达,从而激活了 NLRP3结节样受体炎性小体产生 IL-1β。这一系列过程促进了果糖诱导的肾小球足细胞损伤过程中的氧化应激和炎症反应。Steve Leu等[51]发现,MFE(母体果糖暴露)的孕期和哺乳期大鼠减少了血管形成活性。进一步的蛋白表达分析表明大鼠循环外周血单核细胞中p38MAPK、JNK 和 ERK等的磷酸化水平被MFE上调。即孕期和哺乳期的母体果糖摄入过高会调节EPC(内皮阻细胞)的数量和血管生成活性,并导致由血流恢复不佳引起的缺血性损伤。因此,上述结果分析表明,果糖对MAPK信号通路的调节主要通过诱导关键酶p38MAPK、JNK和ERK的磷酸化水平,从而引起一系列的反应诱发炎症和血管损伤,如图5所示。这也是过量果糖摄入诱发心血管疾病风险的内在机制。

图5 果糖对MAPK信号通路的调控Fig.5 Regulation of MAPK signaling pathway by fructose
2.6 果糖与Toll样受体信号通路
Toll样受体(Toll-like Receptors,TLRs)是一种跨膜蛋白,通过识别来自不同微生物的病原体相关分子模式,在自然免疫系统中发挥着重要作用[52]。TLRs信号通路有两种途径:髓细胞分化因子 88(MyD88)依赖性信号通路和 MyD88非依赖性信号通路[53]。TLRs家族成员有11个,除TLR3是通过TRIF(MyD88适配体样蛋白)来介导下游信号外,所有的 TLRs都可以通过MyD88 介导下游的信号(MyD88依赖性信号通路)。而TLR4比较特别,它是唯一一个可以同时利用MyD88和TRIF作为信号接头分子启动下游TRAF 信号[54]。
Khalid等[55]研究发现,使用15%的果糖水溶液喂养GK大鼠(成年期会发展为Ⅱ型糖尿病的非肥胖品系大鼠)14周,其心脏和主动脉中的TLR4蛋白表达量显著增加,并且发现炎症标志物和TLR4信号转导的特定下游靶标信号NF-κB蛋白表达量也显著增加,这表明高剂量果糖会通过心脏与血管组织中的TLR4过度激活,来诱发炎症并进一步损害糖尿病大鼠的心血管功能,增加血压。Junxia Zhang等[56]用高果糖饮食诱导大鼠高尿酸血症,发现尿酸可以上调大鼠脂肪细胞中TLR2和TLR4 mRNA的表达量,进一步地增加炎性细胞因子并上调组织中的肾素–血管紧张素(RAS),引起收缩压(SBP)升高。通过上述结果分析我们可以推测,高剂量果糖摄入可通过Toll样受体信号通路导致炎症反应,并诱导NF-κB和RAS等的表达,从而影响心血管功能并诱发高血压等疾病,如图6所示。

图6 果糖对Toll样受体信号通路的调控Fig.6 Regulation of Toll-like receptor signaling pathway by fructose
3 结论与展望
果糖与健康的关系一直是学术争论的热点。一致的数据表明,过量的果糖摄入是不健康生活方式的重要因素,也是诱导多种代谢综合征发生的危险因素。现代科学的发展,使我们从分子水平更深入地认识到了这一点。本文通过绘制信号通路简图的方式,综述了果糖摄入调控的信号通路变化及可能导致的健康效应。通过分析可以发现,高果糖诱发的心血管疾病主要是其激活了AKT、MAPK和Toll样受体等信号通路,进一步激发下游GLUT1和线粒体OXPHOS信号通路,以及NF-κB等通路,并引起一系列的炎症反应,导致血管受到损伤,从而影响心血管功能并诱发高血压等疾病。高果糖诱导脂肪积累、炎症和NAFLD主要是通过诱导NF-κB、JAK2/STAT3和AMPK等通路的表达活性,并进一步地通过JAK2/STAT3信号通路的调控诱发肝脏纤维化和胰岛素抵抗等相关疾病。同时,通过分析这些通路的变化也可以发现,在高果糖诱导代谢综合征相关疾病时,几乎都伴随着炎症反应的发生,因此,炎症可能是抑制高果糖引起的代谢综合征的有效靶点。
此外,果糖对健康的影响还与其摄入剂量密切相关,上述对健康的不利影响多发生在高果糖摄入的情况下。根据我们之前的调查研究发现,当人果糖摄入剂量>100 g/d时,会增加血浆总甘油三酯(TG)、总胆固醇(TC)和低密度脂蛋白胆固醇(LDL-C)水平;而等热量的果糖替代其他碳水化物则有利于血糖及糖化血红蛋白的控制;果糖摄入剂量<90 g/d时,与糖尿病的发病无关;膳食果糖供能比在5.9%~9.4%之间时有益于血压控制,超过 9.4%则会增加高血压的发病风险[57-59]。
总之,关于果糖与健康之间的关系,已深入到分子水平研究其对机体的作用机制。然而,目前关于果糖对信号通路的调控多集中在其对一个或两个通路的影响研究,及其引起的机体健康反应。果糖对这些通路影响的关联和互作机制研究还不多见。此外,近年来,随着肠道菌群研究的展开,越来越多的研究还发现,高剂量的果糖会通过改变肠道菌群结构并减少结肠的粘膜厚度[60],从而增加肠道的通透性,这使得肠腔微生物更容易进入结肠粘膜,诱发结肠炎等疾病。因此,在未来的研究中,可以将已知通路作为果糖的研究靶点,研究不同通路之间的关联性及其与肠道菌群之间的关系;或通过基因组学、转录组学和代谢组学等新方法对果糖可能调控的未知通路进行筛查和调控,从而为科学合理的摄入果糖提供有效支撑。

