《中国超药品说明书用药管理指南(2021)》推荐意见及要点解读
左 玮,刘容吉,孙雅佳,张 波,陈耀龙,5,6,张抒扬
中国医学科学院北京协和医院 1药剂科 2疑难重症及罕见病国家重点实验室 7心内科,北京 100730 兰州大学 3公共卫生学院 4健康数据科学研究院 5基础医学院循证医学中心, 兰州 730000 6中国医学科学院循证评价与指南研究创新单元 兰州大学基础医学院, 兰州 730000
医疗机构药品拓展性临床应用,又称“超药品说明书用药(off-label use of drugs)”“药品未注册用法”“药品说明书之外用法”等,本文采用“超药品说明书用药”这一术语(下文简称“超说明书用药”)[1]。药品说明书更新滞后于医学实践进步已是全球普遍存在的问题,故超说明书用药并不等同于不合理用药,其体现的是临床诊疗需求和患者的治疗权益,但同时,某些超说明书药物的有效性和安全性尚未得到充分验证,存在未知风险。因此,无论是为了保障患者最佳治疗权益、规范临床用药行为,还是为了规避医疗风险,探索超说明书用药的科学管理方法均具有紧迫性和必要性。2021年8月20日通过的《中华人民共和国医师法》[2](下文简称《医师法》)首次将超说明书用药写入法条。然而,现有的共识及法规对如何指导我国的超说明书用药管理,特别是在循证医学证据的确定及其在知情同意和分级管理中的应用等方面仍未达成共识。鉴于此,北京协和医院牵头,与兰州大学循证医学中心联合成立了中国超药品说明书用药管理指南制订工作组,组织相关领域多学科专家共同制定了《中国超药品说明书用药管理指南(2021)》,并以英文形式已全文发表于ExpertRevClinPharmacol[3]。本文就该指南的推荐意见进行解读,以期更好地指导超说明书用药管理。
1 指南概述
本指南于2021年1月在国际实践指南注册平台(International Practice Guidelines Registry Platform, IPGRP)进行了中英文双语注册并获得唯一注册编号:IPGRP-2021CN011。制订方法和流程主要基于2014年世界卫生组织发布的《世界卫生组织指南制定手册》及2016年中华医学会发布的《制订/修订<临床诊疗指南>的基本方法及程序》,并依据指南研究与评价工具(Appraisal of Guidelines for Research and Evaluation Ⅱ,AGREE Ⅱ)和国际实践指南报告规范(Reporting Items for Practice Guidelines in healthcare,RIGHT)的具体要求进行报告。指南基于当前已有研究证据,聚焦超说明书用药的定义、适用情形、证据分类、知情同意、法律依据、药物不良反应监测和评价、管理程序、不同利益相关方的责任和义务、医保报销和药品审评制度等9个问题,形成了23条推荐意见,并参照循证管理指南评价工具[4]以及牛津大学循证医学中心(Oxford Centre for Evidence-based Medicine,OCEBM)[5]证据分级标准对证据质量和推荐强度进行了分级(表1)。此外,在对证据进行鉴定时,还综合考虑了中国的相关法律和法规等,以期为临床医师、药师以及各利益相关方提供参考。
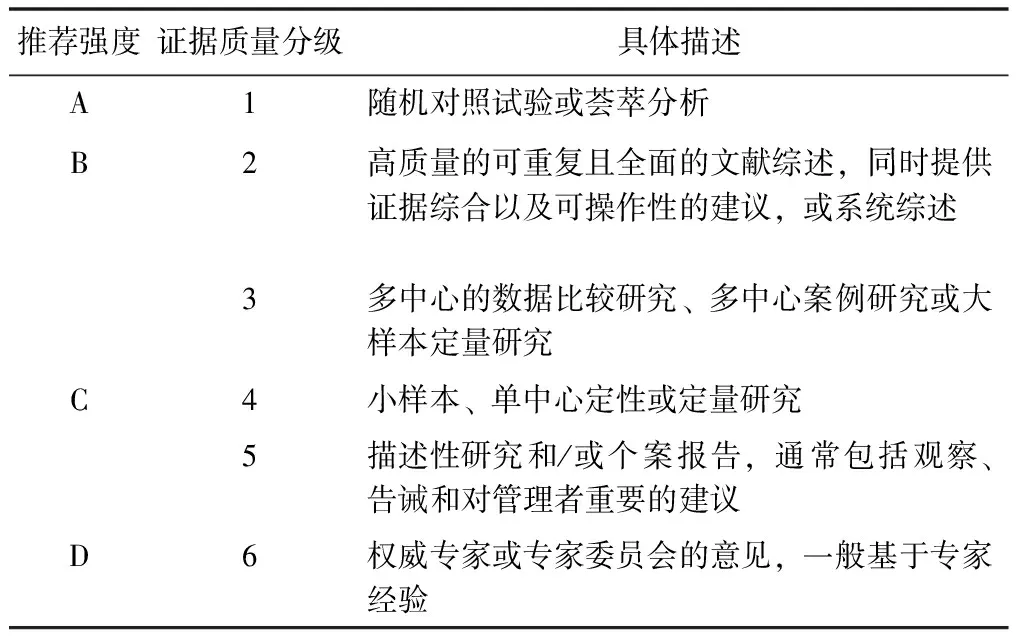
表1 证据质量分级
2 指南推荐意见及要点解读
问题1:我国对超说明书用药的定义和界定范畴是什么?
推荐意见1
超说明书用药是指药品的应用超出国家药监部门批准、生产企业提供的药品说明书和标签界定范围,包括但不限于超出适应证、剂量、给药途径、给药频率、疗程或人群等。(B2)
证据解读:指南参考中国、美国、英国、澳大利亚以及欧盟等多个国家和地区对超说明书用药的描述[6-11],将超说明书用药概括为超出国家药品监督管理局批准的药品说明书和标签范围的用法,包括但不限于未经批准的适应证、剂量、给药途径、给药频率、疗程、人群等。
问题2:哪些情况下,临床医师可超说明书用药?
推荐意见2
经评估同时满足以下情形时,建议考虑超说明书用药:(1)针对病情尚无有效或更好的治疗方法,且可能严重影响患者的生活质量和疾病预后,或造成公共卫生问题;(2)具有循证医学证据支持;(3)根据超说明书用药管理规定,取得患者和(或)近亲属的知情同意;(4)通过医疗机构管理部门或机构审批,如医疗机构药事管理与药物治疗委员会和(或)伦理委员会;(5)不得以试验、研究或其他关乎医务人员自身利益为目的使用。(B2)
证据解读:《医师法》第二十九条规定,“在尚无有效或者更好治疗手段等特殊情况下,医师取得患者明确知情同意后,可以采用药品说明书中未明确但具有循证医学证据的药品用法实施治疗。医疗机构应当建立管理制度,对医师处方、用药医嘱的适宜性进行审核,严格规范医师用药行为。”[2]本指南综合参考国内外多个指南、共识以及研究,认为当无有效或更好的治疗方法时,超说明书用药是一种选择。同时,应综合考虑患者的疾病状况和预后,如患有影响生活质量的严重疾病,或存在较大的严重预后不良风险时,也可考虑超说明书用药。指南还强调循证医学证据是临床实践的基石,所有的临床决策均应以现有的证据为基础。
知情同意是临床实践中保护患者权益的重要手段。《中华人民共和国民法典》(下文简称《民法典》)和《医师法》均规定,为保护患者权益,在对患者进行超说明书用药时,应取得患者和(或)近亲属的知情同意[2,12]。指南建议临床医生应根据所在单位的管理制度,取得相关部门的批准,如药事管理与药物治疗学委员会或伦理委员会,以加强规范的临床实践。此外,指南特别强调,超说明书用药是以临床诊疗需求为前提,而不应以临床试验或科研等研究为目的。但应鼓励并支持临床医师在科学论证的前提下开展相关临床研究,这有助于推动新药研发和扩大药物适应证。
问题3:如何确定超说明书用药的循证依据并制订相关推荐意见?
推荐意见3.1
一般情况下,建议以证据质量分级体系GRADE(Grading of Recommendations Assessment, Development and Evaluations)B级及以上的证据或OCEBM 2级及以上的证据作为超说明书用药有效性评价的高等级循证依据。证据质量也可参考其他权威的分级系统进行评估,如Micromedex®的Thomson分级系统(Ⅱa级及以上被认为是高质量证据)。证据等级越高,推荐力度越大。(B3)
1级有效性证据:GRADE A、OCEBM 1或Thomson分级系统Ⅰ级,制订强推荐意见,推荐临床应用;2级有效性证据:GRADE B、OCEBM 2或Thomson分级系统Ⅱa级,制订中等强推荐意见,建议临床应用;3级有效性证据:GRADE C、OCEBM 3或Thomson分级系统Ⅱb级,制订弱推荐意见,在某些特定情况下可尝试临床应用;4级有效性证据:GRADE D、OCEBM 4/5或Thomson分级系统Ⅲ级,不制订推荐意见,不推荐临床应用。(注:国际公认的,国外的药品说明书、临床实践指南和共识声明可被视为1级证据)
推荐意见3.2
特殊情况下,无法获取证据级别较高的有效性证据时,如罕见病、新生儿、突发公共卫生事件等,建议评估低等级循证依据(如病例对照、病例系列、病例报告等)的同时,结合疾病严重程度、有无替代治疗方案、药物特点、经济性等多种因素,评估患者可能获益和风险,综合制订推荐意见。(B2)
推荐意见3.3
安全性评估可根据我国《药品不良反应报告和监测管理办法》以“一般”和“严重”来区分不良反应造成的损害严重程度,同时应综合考虑不良反应的发生率、上市时间和其有效性等整体因素。(A1)
证据解读:指南介绍并推荐参考目前权威的分级系统对超说明书用药证据进行评估[13-16],如GRADE是全球最权威的证据分级系统之一,已被世界卫生组织和Cochrane协作网等100多个主要国际组织采用;OCEBM分级系统也被广泛使用,其分级标准对应不同的证据类别,已被研究人员用于评估超说明书用药的证据;Micromedex®数据库(https://www.micromedex-solutions.com/home/dispatch/ssl/tru)的Thomson分级系统也被用于超说明书用药的证据质量评价。值得注意的是,在许多情况下,例如新生儿和儿童、罕见病领域以及公共卫生突发事件的早期阶段等,通常只有低等级证据(如病例系列分析),建议总结所有可用的证据,特别是在罕见病领域,也可考虑来自类似疾病的证据。
中国《药品不良反应报告和监测管理办法》[17]将不良反应造成的损害严重程度分为 “一般” 和“严重”,并对“严重不良反应”和“新的不良反应”提出了描述性定义。鉴于不良反应上报系统的局限性,以及目前尚缺乏成熟的循证评价体系,故在安全评估中推荐参考《药品不良反应报告和监测管理办法》。
问题4:何种情况下,超说明书用药应获得患者知情同意?患者知情同意应包含哪些要点?
推荐意见4.1
当有效性证据为2级(相当于GRADE B级)或更低时,应根据相关法律法规取得患者和(或)近亲属对超说明书用药明确的知情同意(特殊情况需另行考虑)。(D6)
推荐意见4.2
医疗机构制定的超说明书用药的知情同意书模板,至少应包括:(1)告知本次用药涉及超说明书用药;(2)告知超说明书用药的含义;(3)超说明书用药的原因;(4)建议方案的性质、利弊和可能出现的不良事件和(或)不良反应及其应急方案;(5)替代治疗方案的性质和利弊;(6)用药注意事项;(7)随访相关事宜;(8)如何监测和报告不良事件/不良反应。(B2)
证据解读:《医师法》第二十五条规定:“医师在诊疗活动中应当向患者说明病情、医疗措施和其他需要告知的事项。需要实施手术、特殊检查、特殊治疗的,医师应当及时向患者具体说明医疗风险、替代医疗方案等情况,并取得其明确同意;不能或者不宜向患者说明的,应当向患者的近亲属说明,并取得其明确同意”。[2]对于紧急且无法获得患者和(或)近亲属意见的情况,《医师法》第二十七条规定:“对需要紧急救治的患者,医师应当采取紧急措施进行诊治,不得拒绝急救处置。因抢救生命垂危的患者等紧急情况,不能取得患者或者其近亲属意见的,经医疗机构负责人或者授权的负责人批准,可以立即实施相应的医疗措施。”《民法典》第一千二百一十九条和一千二百二十条对上述内容也有类似规定[12]。结合我国临床医生和药师工作负担过重的现状,以及对医患双方权益的最大保护,本指南建议对超说明书用药的知情同意也进行分级管理,即基于超说明书用药的循证分级依据进行管理。鉴于公众对超说明书用药知之甚少,医生在告知患者超说明书用药医疗风险、替代方案等重要事项同时,还应告知超说明书用药的概念、原因,以及在整个用药过程中如何监测和报告不良事件/不良反应等信息。
问题5:超说明书用药的法律依据有哪些?
推荐意见5.1
中国的超说明书用药应严格遵守相关法律法规,如《医师法》和《民法典》。(B2)
推荐意见5.2
医师在执业活动中有权在注册执业范围内进行医学检查和疾病调查,实施医疗处置(包括超说明书用药),出具相应的医学证明,选择合理的治疗(包括超说明书用药)、预防和保健方案。(B2)
推荐意见5.3
不能将所有的超说明书用药不良结局判定为医疗机构责任,涉及纠纷时建议医疗损害鉴定部门或医疗纠纷调解委员会在鉴定和调解中成立多学科咨询机制,根据不同的情形判定超说明书用药责任。(C5)。
推荐意见5.4
禁止生产企业以商业为目的开展任何超说明书用药营销行为。(A1)
证据解读:指南指出,在有关超说明书用药的司法案件中,整个管理审批制度的功能缺陷、知情同意书不明确、缺乏证据是不合理用药案件判决的主要问题。因此在严格遵守《医师法》和《民法典》相关规定的基础上,逐步建立完善的超说明书用药管理制度,规范知情同意书的格式,深入系统地分析临床用药前证据,是保证超说明书用药安全的最重要措施。指南建议在超说明书用药临床实践中注意:(1)超说明书用药的合理性(参考药品说明书/标签、指南和证据依据);(2)保护患者的知情同意权(告知和知情同意);(3)加强备案管理和用药监测。同时,严禁制药公司在说明书之外进行药品营销活动[18-19]。
问题6:如何监测、评估超说明书用药的不良事件和(或)不良反应风险?
推荐意见6.1
应对超说明书用药进行不良事件和(或)不良反应的监测和评估。(B3)
推荐意见6.2
除被动监测外,建议采取基于信息的主动监测和流行病学研究,以确保用药安全。(B3)
推荐意见6.3
建议从国家层面创建多层次超说明书用药监测网络,包括被动监测模式如不良事件和(或)不良反应数据库的数据挖掘,主动监测模式如哨点监测系统、在线药物警戒软件平台和(或)数据库和基于网络多模式健康监测平台等;建议从医疗机构层面积极开展主动监测模式,如网络密集性监测、个体化血药浓度监测、电子病历数据监测和真实世界研究等。(B2)
推荐意见6.4
建议临床医师重视超说明书用药有关不良反应和(或)不良事件风险,积极识别、诊断、处理,做好病历记录并及时上报超说明书用药不良反应。(A1)
证据解读:指南指出,使用监测和分析工具识别、评估和管理超说明书用药的安全性非常重要。为更全面、更系统地了解超说明书用药不良事件和(或)不良反应风险,建议在目前普遍使用的自发报告(即被动监测模式)基础上,有计划地开展主动监测,并借助多种监测工具建立多层次监测网络[20-23]。真实世界中关于超说明书用药安全性数据的积累和分析进一步为备案和分级管理提供了参考依据。同时,有必要对企业加强教育、指导和培训,发挥药品生产和销售企业的主体责任,提高超说明书用药的安全性。
问题7:医疗机构中超说明书用药管理流程及各利益方在其中的责任和义务?
推荐意见7.1
建议医疗机构制定明确的超说明书用药管理制度和管理流程。超说明书用药管理的组织架构主要由医院管理部门、相关临床科室、药学部门和超说明书用药审批机构(包括药事管理与药物治疗学委员会以及伦理委员会)组成。由临床科室提出申请,药学部门负责审核后,提交给药事管理与药物治疗学委员会审批。(B2)
推荐意见7.2
建议医疗机构明确利益相关方在超说明书用药管理制度和流程中的责任和义务。
推荐意见7.2.1
根据患者使用超说明书用药时的实际情况,临床科室应结合被开具超说明书用药的患者个人情况,对超说明书用药进行评估:(1)是否有足够的证据证明超说明书用药的合理性;(2)根据医院管理流程的要求启动申请;(3)详细说明超说明书用药方案及管理不良事件和(或)不良反应的应急方案;(4)尊重患者和(或)近亲属对用药的知情权,对超说明书用药的不确定性、潜在风险和医疗费用情况进行告知;(5)监测用药后的疾病进展及相关不良事件和(或)不良反应,并在规定时间内向院内不良反应监测平台和国家不良反应监测系统报告。(2B)
推荐意见7.2.2
药学部门应负责任:(1)对临床科室提交的超说明书用药申请及相关证据进行初步审核,对证据不充分的备案申请应要求临床科室补充提供相关依据;(2)整理超说明书用药申报清单,提交医疗机构药事管理与药物治疗学委员会和/或伦理委员会;(3)接收和监测临床医生和患者在超说明书用药过程中报告的不良反应,并协助做好不良反应的救治管理工作。(B2)
推荐意见7.2.3
医疗机构的药事管理与药物治疗学委员会(必要时联合伦理委员会)应负责任:(1)对临床科室提交的超说明书用药申请进行审核;(2)形成本机构常见的超说明书用药清单并定期更新。(B2)
推荐意见7.2.4
患者和(或)近亲属应负责任:(1)充分了解超说明书用药方案及实施后可能存在的风险;(2)在与临床医生就超说明书用药方案进行充分沟通后签署知情同意书(包括同意或不同意);(3)积极报告用药期间的不良事件和(或)不良反应。(D6)
证据解读:指南认为超说明书用药审批制度的建立,有助于规范临床实践,保证超说明书用药的合理性和安全性,减少和避免因超说明书用药不当引起的纠纷。在《医师法》[2]《医疗机构药事管理规定》[24]《药品不良反应报告和监测管理办法》[17]等多项法律法规的基础上,综合来自中国、美国、西班牙、意大利等多个国家的研究,形成了对超说明书用药管理过程中利益相关方责任和义务的建议[25-27]。同时,为规范超说明书用药,减少重复申请,实现更有效的监控和管理,建议制订超说明书用药数据库或清单。
问题8:何种情况下,超说明书用药可纳入医保报销?
推荐意见8.1
建议将符合一定标准的超说明书用药纳入国家基本医疗保险报销的标准体系。(B2)
推荐意见8.2
建议国家有关部门成立专门的超说明书用药医保报销审查委员会,对药物的有效性、安全性、经济性、疾病/病情的负担和严重程度进行评估,为报销提供依据。(C4)
证据解读:指南对目前各个国家地区是否允许超说明书用药报销的情况进行了梳理和介绍[28]。如德国、意大利和加拿大等国家均成立了专门的委员会,评估应将何种超说明书用药纳入医疗保险报销范围。但不同国家的具体审查标准不同,例如,法国和瑞士在评估疾病严重程度的同时也考虑成本效益;在德国,只有当缺乏批准的治疗方法,且根据现有证据表明治疗可能会成功的严重疾病才可纳入报销范围;在荷兰,如果适应证的发病率低于1∶150 000,且无其他授权药物可用,则可列入报销名单。在美国,若超说明书用药情况被医院处方集服务(hospital formulary service)、药典-药物信息(pharmacopoeia-drug information)、国立综合癌症网络药物与生物制剂汇编(drugs & biologics compendium)、Micromedex®数据库、ClinPharmacol、Lexi-Drugs以及《医疗保险手册》收录的同行评议杂志分析证明适用,则可能获得医疗保险报销。因此,本指南建议中国建立超说明书用药的特别评估机制和报销范围标准/清单。然而,在制订报销清单时,如何快速准确地对现有证据进行审查将面临极大挑战。
问题9:国家是否需要以及如何建立超说明书用药审评和审批体系?
推荐意见9
建议在国家层面建立超说明书用药的审评和审批体系,包括:(1)建立快速审批通道,加快审批速度;(2)建立全面监测和评价系统,收集疗效和安全性信息,为超药品说明用药审评和审批提供有力依据。(B2)
证据解读:超说明书用药能否以及如何成为说明书内用法是解决超说明书用药矛盾的途径之一。2012年法国国家医药卫生产品安全局提出了“临时使用建议用法(Temporary Recommendations for Use, TRU)”[29],其有效期最长为3年,若期间发现存在公众健康危害风险或缺乏患者随访数据,可修改、暂停或撤销TRU,从而实现了授权药品超说明书用药。1999年,日本卫生劳动福利部启动了广泛使用的超说明书用法的上市许可申请提交计划,并于2010年2月成立了未批准药品和超说明书用药发展促进计划委员会,对于符合要求的超说明书药品,委员会将要求制造商在日本推动其临床开发[30]。2007年,意大利药品管理局开发了一套创新药物的电子管理登记系统,可用于收集超说明书用药的使用数据,监测疗效和成本,为超说明书药提供了相关依据[31]。中国《药品注册管理办法》指出[32],药品获准上市后,生产企业应继续开展药品安全性和有效性研究,及时更新记录或根据相关数据提交修改药品说明书的补充申请,并不断更新和完善药品说明书和标签。药品监督管理部门依据职责,根据药品不良反应监测和上市后评价结果,可要求药品上市许可持有人修订更新药品说明书。本指南通过对国际上超说明书用药审批相关政策进行梳理,给出了我国建立超说明书用药审批和审评体系的建议。
3 小结
本指南基于现有超说明书用药领域的循证医学证据,严格遵守国际公认的指南制订方法学,结合中国法律和法规,以及相关专家学者的实践经验,为超说明书用药管理提供了全面参考。超说明书用药管理的难点在于,在超说明书用药的临床实践中,推荐意见的制订除参考循证医学证据之外,还需综合考虑不同人群(如新生儿、儿童、孕妇或老年人)的特殊性、多系统疾病和公共卫生突发事件治疗相关的复杂性以及与药物新型用法相关的开放性问题等。因此,本指南推荐意见的形成,一方面按照PICO原则对9个问题进行解构和统一的文献检索,背对背信息提取,并根据国际公认的证据评价系统对提取的内容形成证据汇总;另一方面,也结合了中国国情和国际经验,是临床、药学、循环医学、法律和医院管理等多学科领域专家访谈以及多轮 Delphi法调研的结果。
本指南的优势:(1)建议医疗机构作为责任主体,可根据循证证据和推荐等级,制订适用于本医疗机构的不同等级的超说明书用药详细实施细则。如对于在临床上被广泛使用并被国际指南推荐的超说明书用药,可放入医院处方集,作为普通药品管理。(2)强调超说明书用药与法律和伦理问题的高风险有关,在某些情况下,医生必须权衡利弊,邀请患者参与共同决策。(3)呼吁在激励和鼓励超说明书使用方面应作出更多的努力。例如,推动法律和法规的不断改进,充分利用医生在新生儿、儿童,甚至罕见病人群中的经验性真实世界证据等。本指南也存在一定的局限性:如考虑到本领域的特殊性,超说明书用药管理有关的研究文献目前较少,且指南纳入的文献中存在部分研究类型尚无相应的质量评价工具进行评估,故在循证管理指南评价工具基础上,通过综合文献内容及其发表的期刊级别,进一步结合我国有关法律法规等,形成最终的证据质量和推荐强度分级。
综上,本指南是我国第一部关于超说明书用药的指南,为我国超说明书用药管理提供了参考。在指南实施和应用过程中,需结合具体情况以及未来临床实践发展和相关法律法规不断进行修订和调整。此外,无论是超说明书用药的临床研究领域还是循证管理领域,均迫切需要进一步开展高质量的研究。
作者贡献:左玮负责论文初稿撰写;刘容吉、孙雅佳负责论文修订;张波、陈耀龙、张抒扬负责论文修订及终稿审核。
利益冲突:所有作者均声明不存在利益冲突
附录:《中国超药品说明书用药管理指南(2021)》指南制定工作组名单(按姓氏首字母排序)
首席药学专家:张波(中国医学科学院北京协和医院药剂科)
首席方法学专家:陈耀龙(中国医学科学院循证评价与指南研究创新单元兰州大学基础医学院,中华医学会杂志社指南与标准研究中心)
指导委员会:杜斌(中国医学科学院北京协和医院内科ICU),黄心宇(国家医疗保障局医药服务管理司),李秋(重庆医科大学附属儿童医院),刘晓清(中国医学科学院北京协和医院感染内科),杨志敏(国家药品监督管理局药品审评中心),张锋(国家卫生健康委员会药物政策与基本药物制度司),张抒扬(中国医学科学院北京协和医院心内科),张文宝(国家卫生健康委员会医政司医疗管理处),赵岩(中国医学科学院北京协和医院风湿免疫科)
秘书组:孙雅佳(兰州大学公共卫生学院),左玮(中国医学科学院北京协和医院药剂科)
证据组:都丽萍,高一强,接恒博,李若涵,李杏翠,刘芳,刘容吉,马元元,牛子冉,屈静涵,尚俊美,孙雯娟,唐筱婉,许婷婷,许秀丽,闫雪莲,张凡,赵蕾蕾,赵琳婧,赵喆,周雨佳,邹羽真,左玮(中国医学科学院北京协和医院药剂科);王平,杨楠(兰州大学基础医学院);刘云兰,孙雅佳(兰州大学公共卫生学院);雷若冰,孟敏(重庆医科大学)
指南组:常青(中国医学科学院北京协和医院医务处),陈丽萌(中国医学科学院北京协和医院肾内科),邓利强(中国卫生法学会,北京市华卫律师事务所),李大魁(中国医学科学院北京协和医院药剂科),李国辉(中国医学科学院肿瘤医院药剂科),刘东(华中科技大学同济医学院附属同济医院药学部),吕迁洲(复旦大学附属中山医院药剂科),姜玲(中国科学技术大学附属第一医院(安徽省立医院)药剂科),梅丹(中国医学科学院北京协和医院药剂科),孟文勃(兰州大学第一医院普通外科),潘慧(中国医学科学院北京协和医院医务处),彭华(中国医学科学院北京协和医院医务处),史琛(华中科技大学同济医学院附属协和医院药剂科),童荣生(四川省医学科学院·四川省人民医院药学部),王芳(兰州大学第二医院生殖医学科),王晓玲(首都医科大学附属北京儿童医院药学部),王岳(北京大学医学部),吴晶(天津大学药物科学与技术学院),伍俊妍(中山大学孙逸仙纪念医院药学部),武新安(兰州大学第一医院药剂科),肖娟(中国医学科学院北京协和医院儿科),徐凯峰(中国医学科学院北京协和医院呼吸与危重症医学科),颜青(国家卫生健康委员会医院管理研究所),泽碧(西藏自治区人民医院药学部),曾学军(中国医学科学院北京协和医院全科医学科),张晓坚(郑州大学附属第一医院药学部),赵林(中国医学科学院北京协和医院肿瘤内科),郑志华(广东省药学会),周颖玉(中国药学会科技开发中心)
外审组:崔丽英(中国医学科学院北京协和医院神经科),李大川(国家卫生健康委员会医政司),马彬(兰州大学基础医学院),翟所迪(北京大学第三医院药剂科),郑雪倩(中国卫生法学会,北京市华卫律师事务所)

