‘龙眼’葡萄酒微生物变化及与挥发性香气的相关性分析
罗飞,师旭,王颉,庞永宏,赵彦敏
(1. 中粮华夏长城葡萄酒有限公司,河北秦皇岛 066000;2. 中粮长城桑干酒庄(怀来)有限公司,河北张家口 075400;3. 河北农业大学食品科技学院,河北保定 071000;4. 张家口市食品药品检验中心,河北张家口 075000;5. 河北省张家口市农业广播电视学校,河北张家口 075000)
‘龙眼’葡萄是中国最具特色和代表性的鲜食酿酒兼用品种,有近千年的栽培历史,目前主要在怀来地区有集中种植,且面积逐年缩减。据怀来县统计局数据,2021年‘龙眼’葡萄种植面积约有20 hm2,有两家企业酿造‘龙眼’干白葡萄酒,其他均以鲜食消费。因此‘龙眼’葡萄面临被淘汰的风险。
众所周知,葡萄酒复杂的风味很大部分是一系列微生物代谢活动的结果[1],微生物对葡萄酒香气的贡献,及其在葡萄酒品质中的改良始终在研究之中[2-3],大量芳香化合物在酿酒酵母初级发酵过程中形成[4]。此外,现有研究表明,接种本土非酿酒酵母可以改善葡萄酒的芳香特征[5],如有孢汉逊酵母(Hanseniaspora uvarum)和高渗汉森酵母(Hanseniaspora osmophila)可以分泌多种水解酶,有助于葡萄酒花香物质的产生[6];而葡萄酒微生态系统除以酿酒酵母、非酿酒酵母为代表的真菌群落外,细菌群落也对葡萄酒风味存在重要影响,其中乳酸菌(LAB)具有广泛的酯合成和水解活性。许多研究中观察到苹乳酸发酵(MLF)后,乙酸乙酯、乙酸异戊酯和乳酸乙酯水平增加[7-8],其中最常用的酒酒球菌(Oenococcus oeni)的多糖被证明具有与释放的香气化合物结合的能力,从而影响最终的葡萄酒香气[9]。近年来国内外通过高通量测序(HTS)技术报道了不同产区、不同葡萄品种发酵过程中微生物多样性组成和其此消彼长的变化及其与挥发香香气的相关性[10],如‘威代尔’冰白葡萄酒[11]、‘法兰娜’(Falanghina)甜葡萄酒[12]和‘马瑟兰’[13]红葡萄酒已有报道,然而我国独有的‘龙眼’干白葡萄酒工业发酵过程尚缺乏相关研究。
本研究对‘龙眼’干白葡萄酒发酵过程中微生物群落变化及其与挥发性香气变化相关性分析,将为我国本土品种‘龙眼’干白发酵过程中微生物多样性研究提供一定理论支持,从而了解葡萄酒风味特征的形成和质量控制,为酿酒师监控发酵过程提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 葡萄原料
‘龙眼’葡萄产自怀来,行距2 m,株距0.8 m。
1.1.2 酵母选择
酿酒酵母(S. cerevisiae)VL2,由Lamothe Abiet公司生产,经酿酒师长期验证,具有低温耐受性强、启动发酵快的特点,适合‘龙眼’干白葡萄酒的酿造。
1.1.3 主要试剂
果胶酶(食品级),Laffort公司;氯化钠(分析纯)、偏亚硫酸钾(食品级),国药集团有限公司;甲醇(色谱纯),北京迪科马科技有限公司;3-辛醇(分析纯),美国Sigma公司;FastDNA® Spin Kit for Soil DNA抽提试剂盒,美国MP Biomedicals公司;MiSeq Reagent Kit v3测序试剂盒,美国Illumina公司。
1.2 仪器与设备
7890B-5977A气相色谱质谱联用仪,Agilent公司;57328-u顶空固相微萃取纤维头,Supelco公司;HPINNOWAX毛细管色谱柱(60 m×250 μm×0.25 μm),Agilent公司;Autosampler 2707高效液相色谱仪,Waters公司;Wine Scan FT 120 FOSS仪,FOSS公司;2720 thermal cycler PCR仪,美国Applied Biosystems公司;Illumina Miseq测序仪,美国Illumina公司。
1.3 试验设计方法
试验用10 t不锈钢控温发酵罐发酵,每罐9 t葡萄汁,设置3个平行处理。
发酵工艺流程:葡萄原料→穗选→破碎除梗→葡萄汁压榨(果胶酶 15 g·t-1)→焦亚硫酸钾处理(60 mg·L-1)→冷浸渍48 h→澄清汁→接种酿酒酵母(200 g·t-1)→控制发酵温度12~13 ℃进行酒精发酵→发酵结束→分离、调硫→下胶→热稳定试验→冷稳定处理→过滤→干白葡萄酒。
葡萄汁压榨、前处理和澄清:葡萄采收后,用氮气保护气囊压榨机(2 t·h-1)压榨获得葡萄汁(总糖:178.93 g·L-1,总酸:9.2 g·L-1),压榨过程中添加焦亚硫酸钾(60 mg·L-1)和果胶酶(15 g·t-1)。压榨出的葡萄汁在7~8 ℃下放置48 h后分离出澄清汁(C),取500 mL用于后续分析。
酵母活化及扩培:取5400 g活性干酵母,在38 ℃水浴条件下,加入10倍水(54 L,38 ℃)进行活化。活化后的活性干酵母利用葡萄澄清汁(10 ℃)进行扩培,从38 ℃开始按照每次6 ℃的梯度依次降温,每次降温后保持3~5 min,将温度降至11~13 ℃后,等量接种于11~13 ℃葡萄汁中,48 h后,温度控制在12~13 ℃发酵,每天保持早中晚测量温度。
各处理每隔1 d取样,至酒精发酵结束。取样共8次,分别为第2天、第4天……第16天,记为L2、L4、L6、L8、L10、L12、L14、L16。在3个发酵罐上中下部取样共500 mL,样品经4 ℃离心(9900 r·min-1离心15 min),上清液用于理化指标和挥发性香气分析。样品收集后,保存于﹣80 ℃。至发酵液残糖小于2 g·L-1时,结束取样。
1.4 微生物群落测定方法
参考先前方法将发酵过程中样品进行总DNA提取和检测,对细菌16S rRNA基因的V3~V4区和真菌ITS rRNA基因的ITS区目的基因进行PCR扩增,3个平行样本PCR产物混合,用2%琼脂糖凝胶对PCR产物进行检测;按AxyPrep DNA凝胶提取试剂盒说明对回收产物提取纯化,用微型荧光计进行检测定量。采用边合成边测序的方法在Illumina公司Miseq PE300平台上机进行高通量测序。
1.5 理化指标测定方法
总糖、总酸和酒精度:利用FOSS仪在Wine Scan FT 120从波数926~5012 cm-1进行透射扫描测定;pH采用pH计法测定;甲醇参照GB/T 15038—2016[14]利用高效气相色谱仪测定。
1.6 挥发性香气测定方法
GC条件:Agilent HP-INNOWax毛细管极性色谱柱(60 m×250 μm×0.25 μm),进样口温度设定为240 ℃,载气为高纯He(>99.999%),流速为 1 mL·min-1,不分流模式;柱箱升温程序如表1所示。
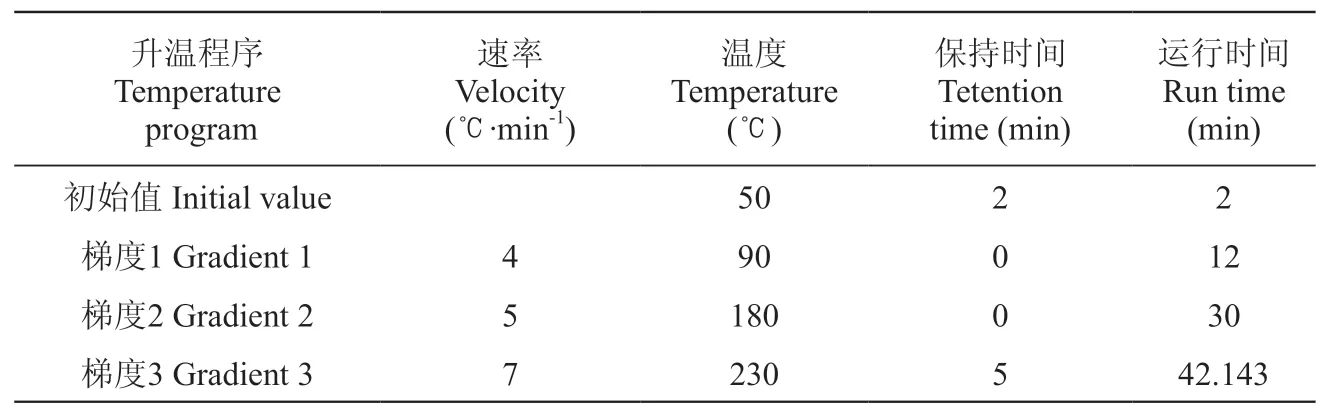
表1 GC柱箱升温程序Table 1 GC column box warming procedure
MS条件: EI+离子源,电子能量为70 eV,离子源温度230 ℃,四级杆温度150 ℃,溶剂延迟5 min,质谱质量扫描范围45~350 u。
测定结果利用NIST14谱库定性,筛选匹配度>90%的香气组分,顶空固相微萃取,利用3-辛醇进行内标法半定量,每个样品重复3次。
1.7 结果统计分析
试验结果用X±SD形式表示,使用SPSS 26软件(SPSS,Inc.,USA)进行统计分析;绘图采用Origin 2020(OriginLab Corporation,USA)软件;发酵过程中微生物变化使用SIMCA 14.1(Umetrics AB,Sweden)进行正交偏最小二乘分析(OPLS);通过R语言包进行Spearman相关性分析。
2 结果与分析
2.1 干白葡萄酒理化指标
‘龙眼’干白葡萄酒发酵结束及葡萄澄清汁基本理化指标如表2所示。发酵天数共计16 d,酒精发酵结束时葡萄酒中甲醇含量为41.17±1.45 mg·L-1,符合GB/T 15037—2006[15]规定的不超过250 mg·L-1的要求。

表2 ‘龙眼’干白葡萄酒理化指标Table 2 Physical and chemical indexes of 'Longyan' dry white wine
2.2 干白葡萄酒发酵过程中微生物群落变化分析
对8个样本的16S rRNA基因V3~V4区进行测序,获得518 942个高质量读数,每个样本平均8212个序列。去除低丰度和非细菌操作分类单位(OTU)后,通过OTU聚类(相似性97%)得到766个OTU。对于真菌,使用HTS生成720 231的高质量读数,每个样本平均47 742个序列,获得350个OTU(相似性97%)。
由图1可见发酵过程中的总体样本相对丰度大于1%的优势微生物有细菌属20种、真菌属6种,相对丰度小于1%的归为其他属。
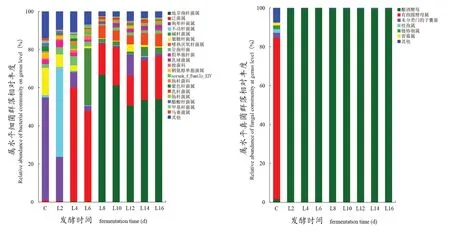
图1 ‘龙眼’干白葡萄酒发酵过程中主要细菌(左)和真菌(右)相对丰度变化的影响Figure 1 Relative abundance changes of major bacteria (Left) and fungi (Right) during 'Longyan' dry white wine
对于细菌,葡萄汁中相对丰度较高的为驹形氏杆菌属Komagataeibacter(53.79%),其次是葡糖杆菌属Gluconobacter(14.40%),二者在发酵中逐渐减少,发酵结束时的丰度分别为1.31%和0.60%。发酵过程中增加最快的是地芽孢杆菌属Geobacillus,到第8天时丰度达到66.76%,之后逐渐减少,在第16天时又增加到54.06%;其次是泛菌属Pantoea在第4天(59.95%)时显著增加,之后又逐渐减少,第16天时降至2.28%;不动杆菌属Acinetobacter在第2天的丰度猛增至47.03%,随后又迅速降低。
对于真菌,葡萄汁中有孢圆酵母属Torulaspora丰度最高,为82.86%;其次是未分类门的子囊菌g_unclassified_p_Ascomycota(2.64%),枝孢属g_Cladosporium(1.92%)。而发酵过程中以接种的酿酒酵母占优势。
2.3 干白葡萄酒发酵过程中挥发性香气变化分析
‘龙眼’干白葡萄酒挥发性化合物含量如表3所示。共鉴定出28种挥发性香气化合物,分为醇类、乙酸酯、脂肪酸乙酯、其他酯类、酸类、醛类、酮类、萜烯类和C13-降异戊二烯。‘龙眼’葡萄澄清汁中共鉴定出4种挥发性香气,有C6醇类的正己醇、(E)-2-己烯-1-醇,醛类为己醛,酮类为3-辛酮。发酵结束时,‘龙眼’干白葡萄酒共鉴定出25种挥发性香气,相对含量较高的为脂肪酸乙酯中的辛酸乙酯、己酸乙酯、癸酸乙酯及乙酸酯中的乙酸异戊酯、乙酸己酯,均高于最低阈值,是葡萄酒果香的主要来源。其中,除辛酸乙酯在发酵中逐渐增加,到第14天最高(14 498.14±1279.99 μg·L-1),发酵结束降低到10 247.03±957.75 μg·L-1,其余均为发酵过程中逐渐增加;其他酯类中辛酸异戊酯带有菠萝、椰子和奶油香,己酸异戊酯与癸酸异戊酯均带有果香和甜味,在发酵过程中逐渐增加;醇类中相对含量最高的为异戊醇,其次为苯乙醇,发酵过程中乙酰转移酶催化高级醇酯化产生乙酸酯;脂肪酸含量最高的是辛酸,其次是癸酸和己酸,来源于脂质代谢和长链脂肪酸分解[16],均逐渐增加到第10天最高后减少。萜烯类是β-石竹烯和4-萜烯醇分别在发酵第10天较高,第4天开始检测到,并逐渐增加。C13-降异戊二烯中的β-大马士酮在发酵第2天被检测到,以后逐渐增加。

表3 ‘龙眼’干白葡萄酒挥发性化合物相对含量Table 3 Volatile compounds relative content in 'Longyan' dry white wine
2.4 干白葡萄酒发酵过程中微生物群落与挥发性香气化合物变化相关性
如图2所示,以鉴定出的28种挥发性化合物为横坐标,以相对含量>1细菌和真菌为纵坐标进行正交偏最小二乘分析(OPLS),得到VIP>1(R2>0.5,Q2>0.5)的核心微生物细菌属11种,真菌属2种。如图3所示,通过AI进行可视化得到OPLS分析VIP>1的核心微生物与28种挥发香气的Spearman相关性(|R|>0.7;P<0.05)。

图2 ‘龙眼’干白葡萄酒发酵过程中微生物群与挥发性化合物的相关性VIP分析Figure 2 VIP correlation analyses between microflora and volatile compounds of 'Longyan' dry white wine fermentation
如图3所示细菌中有5个属:驹形杆菌属、葡萄糖杆菌属、醋酸杆菌属、甲基杆菌属、鞘氨醇单胞菌属与葡萄汁中品种香正己醇、(E)-2-己烯-1-醇和己醛呈显著正相关,与发酵过程中产生的香气呈负相关;而地芽孢杆菌属与乙酸癸酯、乙酸苯乙酯、4-萜烯醇和β-大马士革酮;乙酸己酯、己酸乙酯、4-萜烯醇呈极显著正相关;乳酸杆菌属(Lactobacillus)与4-萜烯醇和β-大马士革酮;己酸、乙酸癸酯、乙酸苯乙酯、己酸乙酯和癸酸异戊酯呈极显著正相关;嗜热厌氧杆菌属与己酸、4-萜烯醇和β-大马士革酮;乙酸癸酯、乙酸苯乙酯、己酸乙酯和癸酸异戊酯呈极显著正相关;乳球菌属与乙酸癸酯呈极显著正相关。
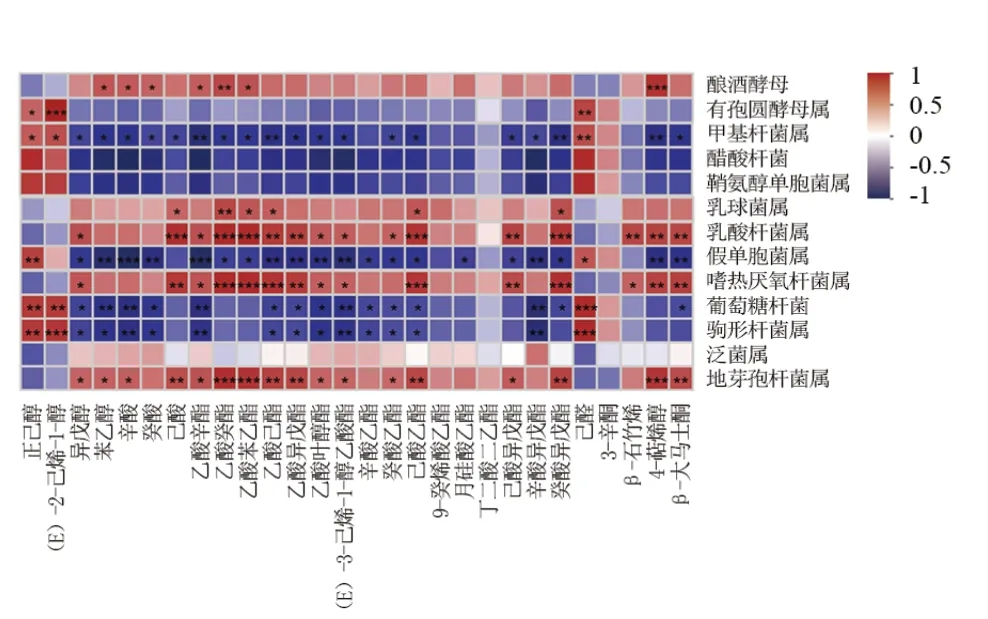
图3 ‘龙眼’干白葡萄酒发酵过程中核心微生物(VIP>1)和挥发性化合物相关性热图Figure 3 Correlation heatmap between core microbiota (VIP>1) and volatile compounds during 'Longyan' dry white wine fermentation
真菌中酿酒酵母与发酵香呈正相关,而非酿酒酵母有孢圆酵母属与葡萄汁中品种香(E)-2-己烯-1-醇和己醛呈显著正相关。
3 讨论和结论
本研究用高通量16s rRNA及ITS测序技术和HSSPME-GC/MS,对‘龙眼’干白葡萄酒发酵过程中微生物群落和挥发性成分变化进行监测。
共鉴定出28种挥发性香气,包括醇类3种、乙酸酯7种、脂肪酸乙酯6种、其他酯类3种、酸类4种、醛类1种、酮类1种、萜烯类2种和C13-降异戊二烯1种,相对含量最高的为脂肪酸乙酯中的辛酸乙酯、己酸乙酯、癸酸乙酯及乙酸酯中的乙酸异戊酯、乙酸己酯。值得注意的是,萜类化合物β-石竹烯(倍半萜)是薄荷中的主要香气[23],具有青草和木质的味道,在葡萄酒中未见报道;4-萜烯醇(单萜)化合物常存在于葡萄表皮和葡萄藤中,一些酿造工艺压榨、浸渍,以及酶、细菌、酵母的参与会影响其在葡萄酒中的含量[24]。β-大马士酮(C13-降异戊二烯,倍半萜酮)是胡萝卜素的降解产物,对葡萄酒有重要影响[25],在葡萄酒中的阈值极低,通常为0.05 μg·L-1,可以直接赋予葡萄酒花香、蜂蜜和水果的香味[26],或协同改变其他水果的香味[27]。本研究初步明确了‘龙眼’干白葡萄酒发酵过程中的挥发性香气,未来可以通过感官组学中GC-O、香气提取稀释、香气遗漏和重组等技术进一步明确具有代表性的‘龙眼’干白的典型香气。
本试验检测到的相对含量>1%的细菌属有20种,真菌属有6种。通过OPLS分析初步确定了11种细菌和5种真菌为VIP>1的核心微生物。通过Spearman相关性分析得出,其中的5种细菌和1种真菌与葡萄汁中品种香正己醇、(E)-2-己烯-1-醇和己醛呈显著正相关,4种细菌和1种真菌即酿酒酵母属(Saccharomyces)与发酵过程中的部分发酵香呈极显著正相关,特别是地芽孢杆菌属(Geobacillus)、乳酸杆菌属(Lactobacillus)和嗜热厌氧杆菌属(Thermoanaerobacterium)均与乙酸癸酯、乙酸苯乙酯、4-萜烯醇、β-大马士革酮、乙酸苯乙酯和癸酸异戊酯等呈极显著正相关。已有研究表明,地芽孢杆菌属(Geobacillus)的许多脂肪酶能在极端温度和pH值下存在,并具有酯合成潜力[28]。与苹果酸-乳酸发酵相关的乳酸杆菌属(Lactobacillus)具有糖苷酶和酯酶活性,从而进一步改善葡萄酒的风味[29],因此地芽孢杆菌属(Geobacillus)、乳酸杆菌属(Lactobacillus)和嗜热厌氧杆菌属(Thermoanaerobacterium)可能是与发酵过程中挥发性香气产生相关的核心功能微生物,共同促进了‘龙眼’干白葡萄酒发酵过程中复杂挥发性香气的形成。在以往的研究中已有高通量技术监测发酵过程中微生物变化及与挥发性香气相关性研究[11-13],从而初步确定对挥发性香气有贡献的核心功能微生物,但工业化生产中葡萄酒相关研究较少。综上,本研究初步明确了‘龙眼’干白葡萄酒发酵过程中的核心微生物、核心功能微生物及其与挥发性香气的相关性。关于微生物如何代谢仍需要进行转录组学和代谢组学的深入研究,这些微生物的食品安全性仍待长期验证。

