HCCR-1、Bcl-2的表达与结直肠癌的相关性分析
张淑华 张勇
(确山县人民医院病理科,河南 确山 463200)
约95%的结直肠癌是由结肠和直肠内壁的腺细胞发展而来,癌症通常开始于内壁最内层,并缓慢生长到外层。结直肠癌(Colorectal Cancer,CRC)早期症状包括排便习惯改变(如便秘或者腹泻)、大便细窄、粪便中含有鲜红或韩红色血液、骨盆或下腹持续疼痛(如胀气、肿胀或疼痛)、不明原因的体重减轻、恶心或偶遇及精神不振等表现,随着疾病发展,其肿瘤增大导致肠腔狭窄,从而造成机械性肠梗阻,还可能发生肠穿孔和出血等并发症,对患者生命造成严重的威胁。
近年来,结直肠癌发病率和死亡率在世界范围内呈现上升趋势。通过mRNA差异展示、杂合性丢失等研究方法,发现了100多种抑癌基因,通过对这些抑癌基因的研究,可以阐述肿瘤形成机制,为未来抗肿瘤治疗新方法提供理论依据[1]。人宫颈癌癌基因(Human Cervical Cancer Oncogene,HCCR)定位于人染色体12q,包括HCCR-1与HCCR-2。国内有研究报道,HCCR在肝癌内中过表达,逐渐成为肝癌诊断线索[2]。B淋巴细胞瘤-2(B-cell Lymphoma-2,Bcl-2)可抑制多种原因引起的细胞凋亡,其过表达可使细胞抵抗正常凋亡。
因此,为了进一步探究其在CRC组织中的作用机制,本文对其CRC组织和癌旁正常组织中的HCCR-1、Bcl-2蛋白表达情况进行检测,揭露HCCR-1、Bcl-2蛋白表达之间的关系,评价其表达在诊断、治疗CRC中的临床价值。
1 资料与方法
1.1 一般资料
回顾性分析2019年3月至2022年3月本院收治的CRC患者的临床资料。其中女60例,男53例,年龄35-78岁,平均年龄55.76±3.88岁。以距癌组织边缘5 cm以上无癌浸润的癌旁正常组织作为正常对照。
纳入标准:临床资料完整;均经病理学确诊;符合《NCCN结直肠癌诊治指南(2017)》中CRC诊断标准[3];排除标准:有严重造血系统疾病和传染病者;合并心、肺、肝、肾等其他脏器并发症者;合并恶性肿瘤和全身感染者;存在认知功能障碍和心理问题者。本研究经本院伦理委员会同意,且患者及家属知情签署《知情同意书》。
1.2 方法
1.2.1 HCCR-1、Bcl-2表达的检测方法
均采用免疫组化法对HCCR-1、Bcl-2表达进行检测。选取手术后癌旁正常组织和CRC组织的石蜡块(本院病理科提供)。4μm连续切片,60℃烤片1 h,切片脱蜡和水化,加0.01 mol·L-1枸橼酸缓冲液(pH6.4)于高压锅中,加热至喷气,持续2 min。冷却后,蒸馏水冲洗,PBS溶液浸洗3次,每次5 min,用新鲜配置的3%双氧水处理15 min,PBS浸洗3次,每次5 min,室温封闭0.5 h。吸干液体,滴加鼠抗人HCCR-1、Bcl-2多克隆抗体,覆盖标本,将切片放入湿盒中孵育,PBS浸洗3次,每次5 min,滴加Envision试剂,覆盖标本,37℃保温箱内孵育1 h,PBS浸洗3次,每次5 min。室温下显色,复染,充分水洗,脱水透明,重型快干胶封片,在高倍显微镜下观察。PBS代替一抗作为阴性对照,阳性对照采用试剂公司提供的阳性切片(试剂盒均购自上海通蔚试剂有限公司,操作步骤按试剂盒说明书进行)。
1.2.2 HCCR-1、Bcl-2阳性表达的判定
阳性表达定位于细胞核和细胞质,在肿瘤细胞胞质、胞膜上可见棕黄或棕褐色颗粒。100×光镜下取肿瘤实质区,400×光镜下随机选择5个视野。根据染色强度评分:阴性=0,弱阳性=1,中等阳性=2,强阳性=3。染色阳性细胞数分为:≤10%(阴性=0),11%-30%(弱阳性=1),31%-50%(中等阳性=2),>50% (强阳性=3)。当两者分数之和≥3时判定HCCR-1、Bcl-2为阳性。
1.3 观察指标
(1)对比CRC组织和癌旁正常组织间HCCR-1、Bcl-2蛋白表达水平;(2)对比不同临床特征CRC组织的HCCR-1、Bcl-2蛋白表达情况;(3)分析CRC组织中HCCR-1、Bcl-2表达的相关性。
1.4 统计学方法
采用SPSS 26.0统计学软件分析数据,n(%)表示,χ2检验;相关性采用Spearnan相关性分析;以α=0.05为检验水准。
2 结果
2.1 CRC组织与癌旁正常组织间HCCR-1、Bcl-2蛋白表达水平对比
HCCR-1在癌旁正常组织中无阳性表达,在113例CRC组织中有83例阳性表达,表达率为73.45%。
Bcl-2在113例CRC组织中有62例阳性表达,表达率为54.87%;且CRC组织HCCR-1、Bcl-2蛋白阳性率均显著高于癌旁正常组织(P<0.05)。见图1。

图1 Bcl-2、HCCR-1免疫组化代表图(×100)
2.2 不同临床特征CRC组织的HCCR-1、Bcl-2蛋白表达情况
CRC组织中HCCR-1、Bcl-2的表达均与Dukes分期相关(P<0.05);均与患者年龄、性别、肿瘤大小、组织类型、肿瘤分化程度、淋巴结转移无关(P>0.05)。见表1。
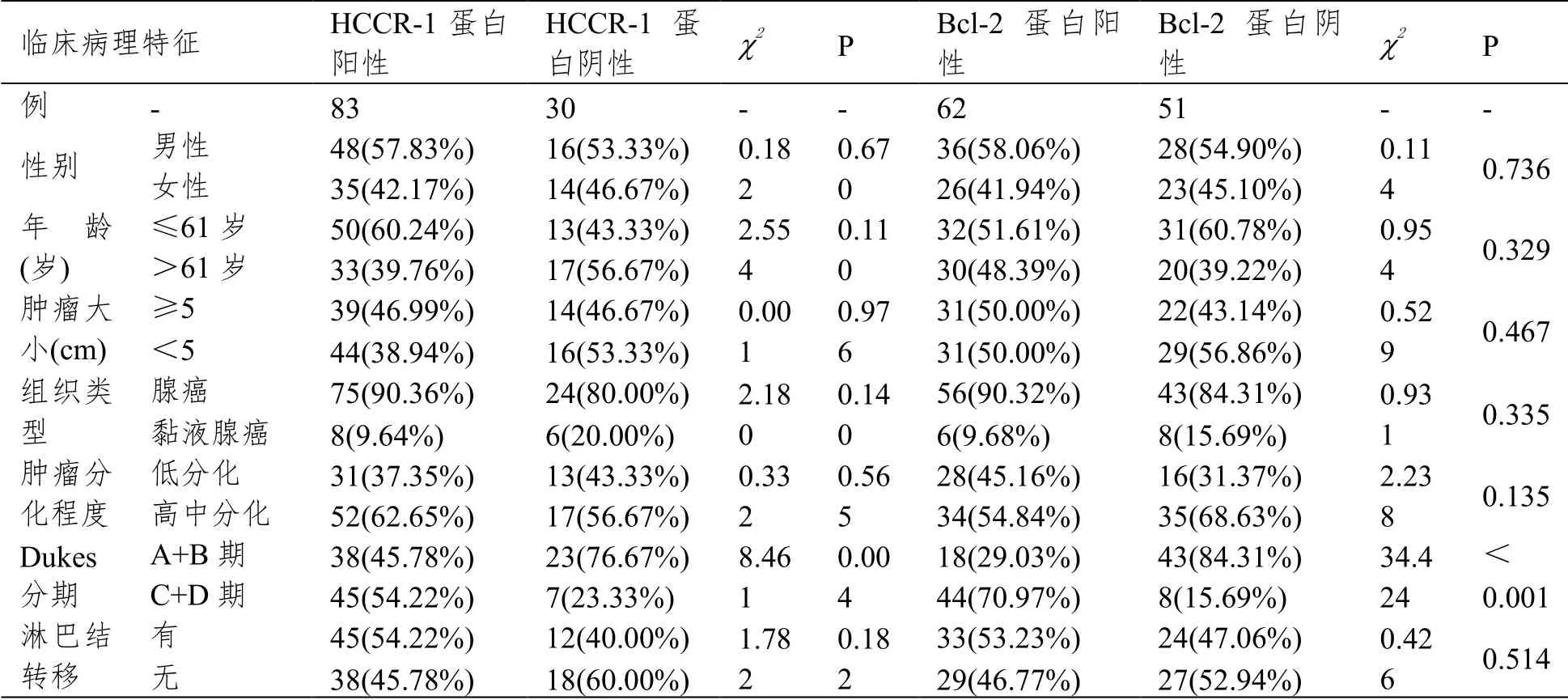
表1 不同临床特征CRC组织的HCCR-1、Bcl-2蛋白表达情况比较(例(%))
2.3 CRC组织中HCCR-1、Bcl-2蛋白表达的相关性分析
Spearman相关分析结果显示在CRC组织中,HCCR-1蛋白表达与Bcl-2蛋白表达相关性呈负相关(r=-0.298,P<0.05)。见表2。

表2 CRC组织中HCCR-1、Bcl-2蛋白表达相关性
3 讨论
CRC是胃肠道中常见的恶性肿瘤,其具体病因目前尚未完全明确,有专家认为,可能是遗传、环境、饮食习惯及消化道疾病等多种因素共同作用的结果,且我国CRC近几年病死率呈明显上升。
HCCR是近年来发现的致癌基因,与人类多种肿瘤密切相关,可作为诊断肝癌、乳腺癌的标志物。有研究表明,HCCR-1编码的细胞膜外蛋白可造成线粒体功能障碍,以抵抗和抑制短波紫外线(Ultra Violet C,UVC)诱导的细胞凋亡[4]。有学者认为,HCCR-1通过与人宫颈癌癌基因结合蛋白-1(Human Cervical Cancer Oncogene Binding Protein -1,HCCRBP-1)相互作用来诱导肿瘤发生[5]。陈粉合等发现卵巢浆液性恶性肿瘤组患者的HCCR阳性表达率为70.00%,高于对照组的8.00%,临床分期III、IV期、组织学分级为中、低分化、有淋巴结转移的卵巢浆液性恶性肿瘤患者HCCR蛋白阳性表达水平较高,且通过单因素分析得出,组织学分级是影响卵巢浆液性恶性肿瘤患者HCCR蛋白水平的因素[6]。
潘云翠等学者采用免疫组化法检测HCCR-1在乳腺浸润性导管癌中的表达,结果发现HCCR-1在乳腺浸润性导管癌中呈现高表达(66.9%,107/160),且HCCR-1表达与临床分期,组织学分级,淋巴结转移,雌激素受体表达,孕激素受体表达相关[7]。
Bcl-2基因是近年来发现的细胞凋亡调控基因,通过抑制细胞凋亡来延长细胞寿命[8]。熊见等发现胃癌中细胞凋亡率及Bcl-2表达率在胃黏膜癌变进展中呈上升趋势,且Bcl-2的过度表达使细胞凋亡受抑,从而促进胃癌的发生和发展[9]。本研究结果中HCCR-1蛋白在正常结肠粘膜组织中无表达,在CRC组织中阳性表达率为73.45%,这一结果与陈粉合、潘云翠等研究结果基本一致,提示HCCR-1蛋白过量表达与CRC早期发生及病程进展有关。另一方面,HCCR-1、Bcl-2的表达均与Dukes分期有关,且CRC组织HCCR-1、Bcl-2蛋白阳性率均显著高于癌旁正常组织,说明HCCR-1、Bcl-2与肿瘤侵袭有关。Spearman相关分析结果显示在CRC组织中,HCCR-1与Bcl-2蛋白表达呈负相关,原因可能是Bcl-2的抑制作用导致HCCR-1过表达,与熊见等研究结果类似。另外,HCCR-1、Bcl-2的表达与患者年龄、性别、肿瘤大小、组织类型、肿瘤分化程度、淋巴结转移无关,与陈粉合、潘云翠等研究结果不一致,可能是因为本研究的样本量太小。
综上,HCCR-1、Bcl-2蛋白在CRC组织中存在过表达状态,与其临床病理特征显著相关,并能作为一种新的预后判断指标和治疗靶点,为疾病诊断、预后判断提供参考价值。

