肠源性短链脂肪酸生成机制及其饮食调控
何 方,李金星,吴思谋
(四川大学 华西公共卫生学院/华西第四医院, 四川 成都 610041)
短链脂肪酸(short chain fatty acids, SCFAs)是一类碳原子数小于7的挥发性有机酸[1],在肠道内以盐的形式存在。乙酸、丙酸、丁酸是由肠道菌群发酵食物中不易消化的碳水化合物、肽和氨基酸产生,甲酸、戊酸、己酸和支链SCFAs(2-甲基-丁酸、异戊酸)主要是支链氨基酸分解代谢产生,肠道菌群发酵食物前体也会有少量生成[2-3]。乙酸是肠道中含量最丰富的SCFAs,其次是丙酸、丁酸,这3种SCFAs占肠道中总SCFAs的90%左右,研究最多也最深入,因此本文主要就这3种SCFAs进行讨论。
SCFAs是肠道上皮细胞的重要能源物质,也是游离脂肪酸受体2和3(free fatty acid receptor 2/3, FFAR 2/3)的天然配体[4]。尽管不同脂肪酸受体的同源性约有40%,但它们与SCFAs的亲和力和组织的特异性表达存在差异[5]。FFAR3在结肠上皮细胞、脾脏、脂肪细胞等均有分布,其与丙酸亲和力最强,其次是丁酸、乙酸;FFAR2主要表达在肠道和特异性免疫区域,参与SCFAs调节肠内分泌细胞分泌胃肠道激素的启动过程[5-6]。SCFAs与不同受体结合能够发挥多种功能,如丁酸与G蛋白偶联受体109A(G protein coupled receptors 109A, GPR109A)结合可以通过上调细胞周期调节因子诱导人结肠癌细胞周期停滞;SCFAs,尤其是丁酸,可以充当组蛋白去乙酰化酶抑制剂从而诱导黏膜Treg细胞分化,通过产生白介素-10(interleukin-10, IL-10)来限制肠道炎症[7-8]。研究还发现,肠源性SCFAs能够进入循环系统发挥调节脂质代谢、调节食欲、调节免疫和炎症反应等多种生理学效应[9]。近年发现,SCFAs在肠道菌群- 肠- 脑轴中具有关键作用,细胞实验证实了SCFAs能够穿过血脑屏障,动物实验也观察到丙酸盐灌胃后小鼠出现了下丘脑区域,即室旁核、下丘脑外侧核和弓形核的激活,而关于SCFAs影响大脑功能的具体机制尚不明确[10]。因此,了解人体内肠源性SCFAs的形成及代谢机制并提出相应的饮食调控策略对于预防疾病、维持健康有重要意义。
1 肠源性SCFAs的形成和代谢途径
1.1 形成SCFAs的食物前体物质
不易消化的碳水化合物是SCFAs的主要食物前体,包含抗性淀粉(resistant starch, RS)、非淀粉多糖(non-starch polysaccharides, NSP)、低聚糖(oligosaccharide, OS)等[2],由糖酵解细菌在盲肠和近端结肠发酵产生直链SCFAs;肠道内的蛋白水解细菌也可发酵蛋白质、肽和氨基酸产生支链SCFAs[11]。
RS根据其化学物理性质分为5类(RS1~RS5)。RS1对热稳定且无法通过酶解反应消化,主要在全麦、豆类等谷皮中;RS2是研究最多的天然RS,常单独或联合RS3/4作为补充剂使用,主要在生土豆、青香蕉、直链淀粉含量较高的玉米中;RS3是老化淀粉,产生于反复湿热加工的食物中,如煮熟和冷却的土豆、面包、玉米等;此外还有化学改性淀粉(RS4)和淀粉酶- 脂质复合物(RS5)[12]。不同食物来源及不同类型的RS对SCFAs产生的贡献不同。体外研究中,Giuberti等[13]使用猪粪便模拟消化过程发现,相较于另3种市售RS产品,来源于冷却后的白高粱RS3(RS3s)能够最大限度促进SCFAs合成,尤其促进丙酸和丁酸产生。Zhou等[14]使用健康人粪便进行体外发酵实验,发现在支链淀粉、豌豆淀粉和酸水解豌豆淀粉提取的RS3中,肠道菌群更容易利用支链淀粉及豌豆淀粉中的RS,发酵24 h后两者总SCFAs、乙酸、丙酸、丁酸含量远高于其他组。然而,人体利用RS产生SCFAs的研究结果并不一致。某项系统综述总结了人体补充RS对SCFAs产生的影响,有70%的研究表明补充RS能够提高粪便SCFAs产量(n=16),29%的研究显示没有影响(n=7),有一项研究甚至发现了粪便SCFAs减少[15]。这可能是由于人群研究只能测量粪便SCFAs,而肠道内约95%SCFAs,尤其是丁酸,会在结肠被肠黏膜吸收,导致粪便SCFAs减少。
NSP是膳食纤维的主要成分,几乎所有的植物性食物都含有NSP,其含量从1 g/kg(玉米淀粉)到690 g/kg(大豆麸皮)[16]。全麦和小麦是NSP的主要食物来源,叶类蔬菜、根茎类蔬菜和豆类也含有少量NSP,大米中的NSP含量极低(4 g/kg),传统发酵的啤酒和低酒精、无酒精啤酒中的NSP在0.5~4.0 g/L[17]。纤维素、半纤维素和果胶是NSP的3个主要类别,占植物细胞壁的90%左右[18]。这3种成分的比例因植物种类和部位而异。阿拉伯木聚糖是大多数谷物中含量最丰富的半纤维素,约占黑麦、高粱和玉米总NSP的40%以上,这一比例在小麦中高达63%[19],纤维素和其他半纤维素(β-葡聚糖为主)分别占20%和30%左右[18],而大麦和燕麦中则表现出较高浓度的β-葡聚糖[20]。果胶主要存在于柑橘、柠檬、柚子、苹果等水果果皮中,对维持植物的结构和硬度至关重要[21]。
OS是由3~10个单糖聚合而成的多糖,天然食物含有少量OS,如人乳中含有母乳低聚糖,大豆中含有大豆低聚糖,而低聚果糖则存在于多种蔬菜水果中[22]。多种OS被批准为保健食品或被允许作为食品添加剂、营养强化剂添加到食品中弥补日常摄入的不足。体外发酵实验证实,SCFAs生产曲线受到OS种类的影响,低聚半乳糖显示出较好的促乙酸生成能力,而低聚甘露糖则是在发酵48 h后观察到最大量的丁酸生成[23]。
这些研究也表明,碳水化合物对肠道内SCFAs模式的贡献由其类型决定。比如乙酸是果胶和木聚糖分解的主要产物,阿拉伯半乳糖发酵会产生大量乙酸和丙酸,RS发酵产生大量丁酸等[24]。
1.2 形成SCFAs的肠道菌群
复杂碳水化合物的代谢需要多种碳水化合物活性酶参与,比如完全降解Ⅱ型鼠李糖醛酸(type Ⅱ rhamnogalacturonan, RG-Ⅱ)需要切割21种不同的糖苷键,涉及至少3种碳水化合物酶家族[25],而绝大多数哺乳动物不能合成这些酶类,肠道菌群才是发酵碳水化合物产生SCFAs的主体[26]。
产乙酸菌广泛分布在自然界内,目前在土壤(淤泥)、动物肠道中分离出了属于23个属的100多种代表性产乙酸菌[27-28]。人体肠道内的厌氧菌和兼性厌氧菌能够进行完整的糖酵解途径,在无氧条件下能将丙酮酸转换为乙酰辅酶A,不进行三羧酸循环而是直接产生乙酸[29]。
通过检测丙酸形成的3条途径中关键酶的基因,可以初步确定人体结肠产丙酸菌的种类。琥珀酸途径是人体肠道菌群产丙酸的主要途径,利用甲基丙二酰辅酶A脱羧酶或者丙酰辅酶A羧化酶的基因序列与多位志愿者粪便菌群宏基因组测序对比,发现具有此途径关键基因的细菌广泛分布在厚壁菌门、拟杆菌门、放线菌门、疣微菌门[30],其中Megasphaeraelsdenii虽含有关键基因,但并不行使此功能,而是通过丙烯酸酯途径产生丙酸[31],还有部分细菌能够生产琥珀酸(如Bacteroidesovatus),后通过交叉喂养生产丙酸[32]。乳酰辅酶A脱水酶是丙烯酸酯途径的关键酶,可以将乳酰辅酶A脱水成丙烯酰辅酶A[33],对124名受试者粪便菌群的基因分析显示,Coprococcuscatus和Megasphaeraelsdenii主要通过丙烯酸酯途径产生丙酸,且只有34名受试者粪便中检测到此途径的关键基因[31]。因此,此途径可能只存在于部分人群,并且局限于少数几种肠道菌群中。能够利用丙二醇途径产生丙酸的部分细菌能够同时产生乙酸、甲酸、乳酸等其他产物,并且具有较强的底物依赖性[31,34]。如在葡萄糖为碳源的培养基上,Ruminococcusobeum的主要产物为乙酸、甲酸和乳酸;而在岩藻糖和鼠李糖为碳源的培养基上,甲酸产量明显减少,丙酸产量分别上升100倍、50倍[31]。与Ruminococcusobeum相似,Roseburiainulinivorans、Ruminococcusgnavus、Ruminococcustorques、Bifidobac-teriumlongum也含有丙二醇途径中辅酶A依赖性丙醛脱氢酶的基因[31,34],还有部分细菌能够利用乳酸或鼠李糖产生1,2-丙二醇(如Lentilactobacillusbuchneri),然后通过交叉喂养产生丙酸[35]。
基于体外培养和基因测序的方法,已经鉴定出了人体肠道内产丁酸菌主要来自厚壁菌门(Firmicutes)中梭菌目(Clostridiales)的毛螺菌科(Lachnospiraceae)、瘤胃球菌科(Ruminococcaceae)、梭菌科(Clostridiaceae)、真杆菌科(Eubacteriaceae)和颤螺菌科(Oscillospiraceae)等[26, 36-37]。毛螺菌科中罗氏菌属(Roseburia)、厌氧棒杆菌属(Anaerostipes)、粪球菌属(Coprococcus)、丁酸弧菌属(Butyrivibrio);瘤胃球菌科中瘤胃球菌属(Ruminococcus);梭菌科中梭菌属(Clostridium)、粪杆菌属(Faecalibacterium);真杆菌科中真杆菌属(Eubacterium)均含有能够产生丁酸的特定菌种,不同菌种产丁酸途径不同。基因测序发现含有丁酰辅酶A/乙酸辅酶A转移酶相关基因的细菌较多,健康人肠道中利用磷酸转丁酰酶/丁酸激酶途径产生丁酸的细菌较少,这些细菌往往也检测到丁酰辅酶A:乙酸辅酶A转移酶活性[38-40]。需要注意的是,基因检测结果与菌株实际产丁酸能力间还有一定距离,有研究发现约45%含丁酰辅酶A/乙酸辅酶A转移酶基因序列属于未能通过传统方法从人类肠道中培养出来的细菌,16%的基因序列属于未被确定分类的细菌[41],并且产丁酸菌的鉴定还未具体到菌株水平,而此处将属于同一种的不同产丁酸菌株进行了总结,只具体到菌种水平。
1.3 SCFAs的代谢途径
乙酸是肠道内含量最高的SCFAs,可以由大多数肠道菌群产生。肠道内乙酸生成主要依靠两种途径:糖酵解过程中产生的丙酮酸通过乙酰辅酶A产生乙酸,或者产乙酸菌利用CO2、CO通过伍德- 永达宁途径(Wood-Ljungdahl pathway)生成[42-43]。通过伍德- 永达宁途径产乙酸的细菌是一类多样化的严格厌氧菌,在厌氧环境中几乎无处不在,它们可以利用H2和CO2作为能源和底物生成乙酰辅酶A[44],或者在丙酮酸脱氢酶复合物、丙酮酸:铁氧还蛋白氧化还原酶或丙酮酸:甲酸裂解酶的催化下将丙酮酸转变为乙酰辅酶A[45-46]。伍德- 永达宁途径固定CO2有两类经典反应,分别生成甲酸或CO,甲酸通过一系列四氢叶酸和钴胺素依赖性反应还原为甲基-类铁硫蛋白复合物,再与CO、辅酶A一起生成乙酰辅酶A[47]。丙酮酸分解或伍德- 永达宁途径生成的乙酰辅酶A在厌氧条件下都经过磷酸转乙酰酶和乙酸激酶催化生成乙酸[48-49]。
肠道菌群可以通过琥珀酸途径、丙二醇途径和丙烯酸酯途径生成丙酸。琥珀酸途径利用三羧酸循环中的琥珀酸作为底物,通过琥珀酰辅酶A、甲基丙二酰辅酶A、丙酰辅酶A等多个中间产物转化为丙酸[36]。1,2-丙二醇是某些细菌包括拟杆菌属(Bacteroides)、大肠埃希菌属(Escherichiacoli)等发酵脱氧糖(岩藻糖、鼠李糖等)的终产物[34,50],而另一些细菌虽然不能直接利用脱氧糖,但却能通过交叉喂养利用1,2-丙二醇生成丙酸,如罗伊氏黏液乳杆菌(Limosilactobacillusreuteri)[51]。在丙烯酸酯途径中,乳酸通过乳酰辅酶A、丙烯酰辅酶A、丙酰辅酶A等多步反应生成丙酸[33],但这条线路似乎仅限于韦荣球菌科(Veillonellaceae)和毛螺菌科中的少数细菌[52]。
丁酸主要通过碳水化合物进入三羧酸循环后的两分子乙酰辅酶A经多步反应缩合而成[53],也可由谷氨酸、赖氨酸、4-氨基丁酸发酵而成,不同食物前体产生丁酸均涉及丁酰辅酶A转变成丁酸的2条途径:磷酸转丁酰酶/丁酸激酶途径以及丁酰辅酶A:乙酸辅酶A转移酶途径[36,54]。第1个途径中,丁酰辅酶A经磷酸转丁酰酶转变为丁酰磷酸,再由丁酸激酶催化为丁酸;第2个途径中,丁酰辅酶A中的辅酶A通过丁酰辅酶A/乙酸辅酶A转移酶转移到乙酸中形成乙酰辅酶A和丁酸。利用基因探针解析肠道菌群相关基因后发现,丁酰辅酶A/乙酸辅酶A转移酶途径是多种细菌产丁酸的主要途径[38,55]。
3种主要SCFAs的生成途径见图1。肠道内的SCFAs能够迅速被结肠细胞吸收利用,或通过门静脉系统运送到肝脏,或进入循环系统中,仅5%~10%经过粪便排泄[56]。70%~90%的丁酸由结肠细胞代谢[57],肝脏也能够有效代谢从结肠吸收的丙酸和丁酸[58],即使在直接给药的情况下也能够避免外周血中丙酸和丁酸浓度急剧增加[26,59]。乙酸的结肠上皮吸收和肝脏吸收较弱,大部分乙酸随着循环系统进入脂肪组织、乳腺组织等[60],这些细胞胞质中含有乙酰辅酶A合成酶,可以将乙酸转化为乙酰辅酶A从而参与脂肪、蛋白质和碳水化合物代谢[56]。SCFAs生成途径及对应的肠道菌群详见表1。

图1 3种主要SCFAs乙酸、丙酸、丁酸的肠道内生成途径Fig.1 Gut biosynthesis pathways of acetic acid, propionic acid and butyric acid as three major SCFAs

表1 3种主要SCFAs肠道生成途径及对应的肠道菌群Tab.1 Gut biosynthesis pathways of three major SCFAs and its corresponding gut microbiota
2 肠源性SCFAs的饮食调控策略
2.1 调控食物中SCFAs前体物质的摄入
SCFAs前体物质是产生SCFAs的基础,食物中SCFAs前体物质主要是膳食纤维和抗性淀粉,经过肠道菌群发酵产生肠源性SCFAs,因此调控食物中的SCFAs前体物质摄入能够从源头上调控肠源性SCFAs的产生。SCFAs前体物质存在于多类食物中,全谷物类食物富含抗性淀粉、膳食纤维,蔬菜水果富含果胶、非淀粉多糖,大豆类食物富含非淀粉多糖、半纤维素、果胶。提高富含膳食纤维的食物摄入量有利于促进肠道菌群利用SCFAs前体物质进行发酵,从而增加结肠内容物和粪便中的SCFAs[1,79]。相反,减少食物中SCFAs前体物质的摄入,则降低了肠源性SCFAs的产生。当摄入的膳食纤维不足时,膳食或内源性蛋白质、多肽和脂肪作为肠道菌群生长的较差能量来源,导致肠道菌群发酵能力下降从而使肠源性SCFAs减少[80]。
2.2 调控产生SCFAs肠道菌群的比例
通过改变肠道中产SCFAs相关菌群比例可以调控肠源性SCFAs产生。目前,调控肠道菌群结构的主要方式有:1) 改变膳食结构从而调控肠道菌群组成;2) 直接摄入益生菌调节肠道菌群;3) 摄入益生元作为SCFAs前体物质选择性地促进宿主肠道微生物生长。这些方式能显著地增加肠源性SCFAs产生,但其对于临床上的效果还需要更深入的研究。表2为调控产生SCFAs肠道菌群的相关案例。
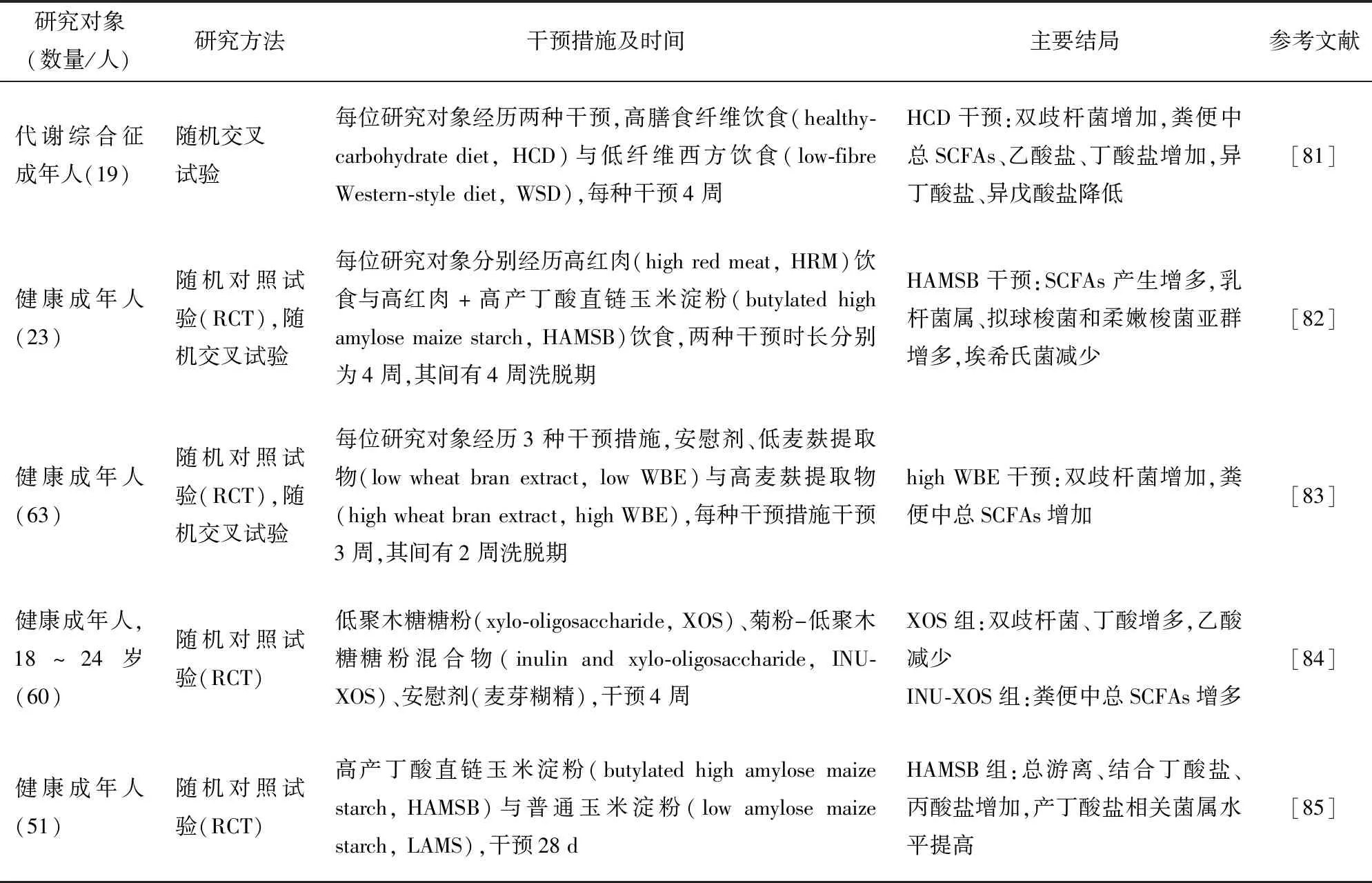
表2 SCFAs前体物质对肠道菌群的影响Tab.2 Impact of SCFAs precursors on gut microbiota
Hald等[81]研究发现,相较于西方饮食,以全谷物为主要碳水化合物的饮食结构能够提高肠道双歧杆菌比例和粪总SCFAs含量。Le Leu等[82]研究发现,相较于高红肉摄入的饮食结构,增加高直链玉米淀粉摄入能够提高肠源性SCFAs产生。Francois等[83]研究发现,健康成年人每天摄入10 g麦麸提取物会提高粪便总SCFAs水平,降低粪便pH值,且双歧杆菌相对丰度提高。Lecerf等[84]研究发现,补充低聚木糖(xylo-oligosaccharide, XOS)能提高肠道中丁酸含量和双歧杆菌水平,而降低乙酸含量。West等[85]研究发现,增加高直链玉米淀粉摄入能使粪便中丁酸含量提高,且产丁酸相关菌属水平提高。
2.3 调控产生SCFAs的酶类
SCFAs前体向SCFAs的转化涉及多种生化途径,这些途径由酶活性介导,但是,单一通过调控酶的方法在实际生活中难以实现。人体大部分消化酶无法消化分解复合碳水化合物和植物多糖。研究发现,在人类基因组中,只有不到20种糖苷酶被鉴定为能够参与膳食多糖消化的酶[86]。细菌中虽然有多种SCFAs前体酶,但细菌分解SCFAs前体的能力差异较大,结构越复杂的多糖需要更多种糖苷酶去代谢[87],某些细菌有多种产SCFAs相关酶,来催化不同复杂结构的多糖代谢,另一些细菌产SCFAs相关酶少,仅能利用一种或几种多糖,因此,仅通过调控产生SCFAs的酶类来控制肠源性SCFAs难以操作。
3 结 语
SCFAs作为肠道微生物的重要代谢产物,目前受到越来越多微生物代谢产物与人体健康领域的关注。SCFAs在细胞供能和信号传导方面有着重要作用,因此SCFAs与多种健康状况有关联。SCFAs在脂代谢、免疫调控和炎症反应等方面有着不可忽略的作用。如何通过调节人体内SCFAs水平从而预防或治疗相关疾病也成为当下的重要课题。
肠源性SCFAs主要通过食物中难消化的碳水化合物在肠道微生物的作用下生成,乙酸、丙酸和丁酸是主要的肠源性SCFAs。肠源性SCFAs将膳食、肠道菌群与健康功能之间复杂的交互机制联系在一起,通过补充SCFAs食物前体物质从而影响肠源性SCFAs,选择性地促进肠道中有益菌的生长,维护肠道微生态稳态,从而直接或者间接地调节机体多种生理功能,促进人体健康。因此,通过以肠道微生物为中心的精准营养干预从而调控SCFAs有望作为新的预防和治疗相关免疫、代谢疾病的策略,必将被更广泛关注。

