乳清分离蛋白- 壳聚糖复合颗粒的构建及其微观结构表征
庞志花,孙梦雅,李博睿,刘 萍,李梦飞,陈存社,刘新旗
(北京工商大学 食品与健康学院, 北京 100048)
微粒化蛋白是通过施加某些外力因素(如剪切、加热)使得蛋白质不再按照原有方式聚集而是形成微粒,该微粒的空间结构相对有序且具有纳微尺度。微粒化蛋白可以作为脂肪替代物或乳液稳定剂在食品结构中起重要作用,目前已经有商业化的、以乳清蛋白为原料生产的微粒化蛋白用于低脂食品的开发。多糖是另一类重要的生物大分子,可通过静电吸引力的弱相互作用与蛋白质形成高度结构化的复杂大分子凝聚物,这种复合凝聚物往往显示出比单独的蛋白质和多糖更突出的功能,比如水合作用、界面特性、稳定性等。利用多糖对蛋白微粒进行表面包裹,形成以蛋白为核、多糖为壳的复合结构,已经被证明可以有效提高蛋白微粒的稳定性、润滑性及输送载体特性[1-6]。乳清蛋白是干酪加工的副产物,具有很好的乳化性和界面特性,广泛应用于食品工业[7-8]。壳聚糖是自然界中唯一存在的天然阳离子多糖,具有良好的蛋白质亲和性,在食品领域应用前景广阔[9-11]。二者可以在中性或弱酸性条件下发生静电复合,是制备蛋白- 多糖复合微粒的理想原料。
蛋白质- 多糖的复合程度及复合物结构特征取决于环境条件及加工方式。由于复合凝聚是蛋白质与带电多糖之间通过静电驱动的相互作用行为,因此复合颗粒的形成及其结构强烈依赖于pH值和盐离子浓度。已有研究表明,壳聚糖在特定的盐离子浓度和pH值条件下可以促进或者阻碍β-乳球蛋白的热聚集[12]。热处理温度直接影响蛋白质的聚集程度,从而影响复合颗粒的大小与结构。此外,在β-乳球蛋白与果胶的复合颗粒的研究中发现,混合方式即蛋白热处理前混合或者热处理后进行混合,也被证明会影响复合颗粒的特性[13]。针对蛋白质与壳聚糖的复合物研究,多集中于二者自组装形成复合膜以及复合物的乳化、包埋性能等方面[14-17],对于乳清蛋白- 壳聚糖复合颗粒的形成条件,特别是工艺条件对构建其核壳结构的影响,缺乏针对性研究。
本研究利用乳清蛋白和壳聚糖的静电复合作用,构建蛋白质- 多糖复合微粒。研究pH值和盐离子浓度对复合作用的影响,进而以构建核壳结构的复合颗粒为目标,研究热处理温度、二者混合方式、机械剪切对颗粒特性及其微观结构的作用,希望为构建完整的结构化乳清蛋白- 壳聚糖复合微粒提供数据支撑。
1 材料与方法
1.1 材料与试剂
乳清分离蛋白(WPI)(蛋白质量分数为91%),购于山东汇益生物科技有限公司;壳聚糖(CS),购于上海源叶生物科技有限公司;氯化钠、盐酸、氢氧化钠等试剂均为分析纯,购于国药集团化学试剂有限公司。
1.2 仪器与设备
FE20型pH计,梅特勒- 托利多仪器(上海)有限公司;Cary- 60型紫外可见分光光度计,安捷伦科技(中国)有限公司;ZS90型Zeta电位仪,马尔文帕纳科(上海)公司;GHJ- 6型水浴磁力搅拌器,苏州市国飞实验仪器有限公司;FSH- 2型高速匀浆器,江苏省常州市金坛区荣华仪器制造有限公司;X- 30R型离心机,美国贝克曼库尔特有限公司;FOSS- 8400型全自动凯氏定氮仪,丹麦福斯分析仪器有限公司;A1Rsi型激光共聚焦显微镜,日本Nikon有限公司。
1.3 实验方法
1.3.1WPI-CS复合体系的制备
WPI-CS复合体系的制备方法在课题组前期研究的基础上加以修改[18]。准确称取适量的WPI粉末溶于去离子水,配制成质量分数为0.9%的WPI储备液,在25 ℃下用电子搅拌器以500 r/min搅拌30 min,置于4 ℃冰箱水化过夜。准确称取适量CS粉末溶于去离子水,配制成质量分数为0.1%的储备液,用1 mol/L HCl将储备液pH值调至2.50,在25 ℃用电子搅拌器以500 r/min搅拌30 min。
混合相应的储备溶液,制备蛋白质与多糖质量比为9∶1的混合溶液,控制混合后总聚合物质量分数为0.5%。向混合液中添加NaCl调节盐离子浓度分别为0、20、50、100、200 mmol/L,分析盐离子浓度对混合溶液浊度的影响。
1.3.2WPI-CS复合体系浊度的测定
采用紫外可见分光光度计对浊度进行测定,使用1 cm石英比色皿,测定波长为600 nm。 滴定开始前,首先用1 mol/L HCl将WPI-CS混合溶液(总生物聚合物质量分数为0.1%)pH值调节至2.00±0.20,用NaOH溶液对混合体系由酸性向中性滴定至pH值为7.00±0.20。每当体系pH值变化0.10~0.20时,取样测定其浊度,同时记下对应的pH值。为保证整个体系混合均匀,滴定过程在磁力搅拌器上进行。样品浊度的计算公式见式(1)。
浊度=(100-T) ×100%。
(1)
式(1)中,T为透光度。
1.3.3WPI-CS复合颗粒的制备及组成测定
为了探究混合方式对制备WPI-CS颗粒特性的影响,选用先混合2种物质再加热和先加热WPI再与CS混合的2种方法制备颗粒。
方法1:调节1.3.1中制备的混合溶液的pH值,分别在75、85、95 ℃热处理30 min,然后用冰水将溶液迅速冷却至室温,混合液在4 ℃下以9 000 r/min离心30 min,收集沉淀物,所得颗粒称为WPI-CS(混- 热)。
方法2: 调节质量分数为0.9%的WPI溶液的pH值,分别在75、85、95 ℃热处理30 min,然后用冰水将溶液迅速冷却至室温,再加入质量分数为0.1%的CS储备液,按照1.3.1中的方法制备混合溶液,混合液在4 ℃下以9 000 r/min离心30 min,收集沉淀物,所得颗粒称为WPI-CS(热- 混)。
分别采用凯氏定氮法和苯酚- 硫酸法测定离心后上清液中的蛋白质和多糖含量,沉淀中蛋白质和多糖含量的计算方法见式(2)和式(3)。
m1(沉淀)=m1-m1(上清液) ;
(2)
m2(沉淀)=m2-m2(上清液) 。
(3)
式(2)中,m1为原溶液中总蛋白质质量,g;m1(沉淀)为沉淀颗粒中蛋白质的质量,g;m1(上清液)为复合离心后上清液中蛋白质质量,g。式(3)中,m2为原溶液中多糖质量,g;m2(沉淀)为沉淀颗粒中多糖的质量,g;m2(上清液)为复合离心后上清 液中多糖质量,g。
1.3.4粒径和ζ电位的测定
将热处理后的混合液用高速匀浆器在剪切速度为10 000 r/min下剪切2 min,再稀释至总生物聚合物质量分数为0.1%。采用ζ电位仪测定剪切前后颗粒的粒径和ζ电位,溶剂和复合颗粒的折射率分别为1.33和1.50。所有测量均在25 ℃下重复3次。
1.3.5颗粒形态观察
使用激光共聚焦电子显微镜观察颗粒中的蛋白质和多糖分布。分别用荧光染料尼罗蓝和5-氨基荧光素对WPI和CS进行荧光标记,室温下搅拌1 h后,按照1.3.3中的方法制备WPI-CS复合颗粒。取400 μL颗粒分散液,滴于共聚焦小皿,并盖上盖玻片用于荧光观察。尼罗蓝和5-氨基荧光素的激发波长分别为633 nm和488 nm,使用60×物镜扫描并收集荧光图像,观察颗粒的构成形态。
1.4 数据处理
实验数据使用SPSS统计软件进行处理,采用单因素方差分析,在95%置信区间分析结果的显著性。所有实验均重复3次。
2 结果与分析
2.1 pH值和盐离子浓度对WPI-CS复合作用的影响
2.1.1pH值对WPI-CS复合作用的影响
WPI的等电点在pH值为4~5,CS的酸度系数(pKa)在6附近,对于蛋白质和阳离子多糖复合体系,两者结合形成复合物会改变混合体系的浊度[19],因此,可利用浊度滴定法研究WPI与CS的复合程度。图1为WPI和WPI-CS溶液浊度随pH值变化的情况。从图1可以看出,随着pH值的增加,WPI溶液浊度呈现先增加后降低的趋势,在pH值为4.45时溶液达到最大浊度值,为79.48%,说明WPI的等电点在pH值为4.45附近。随着pH值的增加,WPI-CS溶液浊度呈现先增加后减小再增加最后稳定的趋势,在pH值5.47时达到最大浊度值,为98.34%。该结果是因为当pH值高于WPI等电点时,WPI带负电荷,可与带正电荷的CS发生静电吸引作用,表现为混合溶液浊度的迅速增加。当pH值向CS的pKa靠近时,CS质子化程度降低,与WPI的静电吸引作用减弱[20],因此溶液浊度减小。进一步增加复合溶液的pH值,CS溶解度降低,以沉淀形式析出,导致整个体系的浊度增加[21-22]。
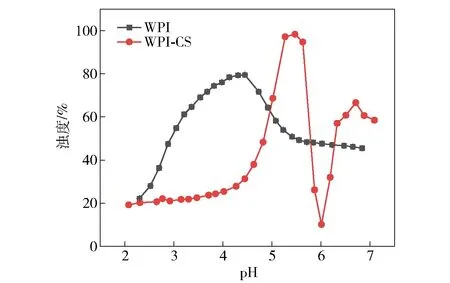
图1 pH值对WPI和WPI-CS溶液浊度的影响Fig.1 Effect of pH value on turbidity of WPI and WPI-CS solutions
2.1.2盐离子浓度对WPI-CS复合作用的影响
图2为含有不同盐离子浓度的WPI-CS溶液的浊度分析结果。由图2可知,随pH值的增加,各盐离子浓度复合溶液的浊度曲线都呈现相同的变化趋势,即先增加达到最大浊度值,随后降低达到极小值,再增加最后趋于稳定。与不含盐离子WPI-CS溶液相比,添加不同盐离子浓度的复合溶液最大浊度值均减小且达到最大浊度值对应的pH值也降低。这是因为盐离子的存在使WPI的等电点降低,盐离子对表面电荷的屏蔽作用使得WPI与CS的结合程度降低[23]。在宏观上表现为未添加盐离子的复合溶液浊度更高。此外,盐离子浓度越高,溶液浊度极小值越大,当盐离子浓度达200 mmol/L时,WPI-CS溶液浊度极小值最大,该现象是因为高浓度盐离子对表面电荷的屏蔽作用会阻碍CS的去质子化,从而阻止复合物解离。本部分研究表明,当盐离子浓度为0、pH值为5.47时WPI与CS的静电吸引相互作用最强。
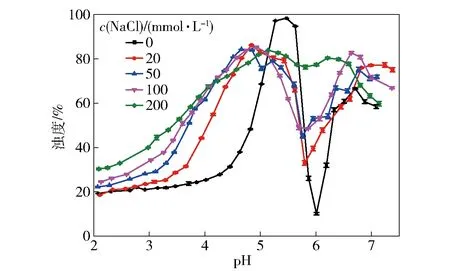
图2 盐离子浓度对WPI-CS溶液浊度的影响Fig.2 Effect of salt ionic concentration on turbidity of WPI-CS solutions
2.2 混合方式和热处理温度对WPI-CS颗粒特性的影响
在2.1中所得最佳盐离子浓度和pH值的基础上,探讨混合方式和热处理温度对WPI-CS复合颗粒的颗粒特性的影响,实验结果见表1 。

表1 WPI颗粒和WPI-CS复合颗粒的组成、粒径和电位Tab.1 Composition, particle size and ζ potential of WPI particles and WPI-CS composite particles
2.2.1混合方式对WPI-CS颗粒特性的影响
由表1可以看出, WPI-CS(热- 混)颗粒与WPI-CS(混- 热)颗粒中WPI与CS的组成比例没有显著性差异。WPI-CS(热- 混)颗粒的平均粒径小于相同热处理温度下WPI-CS(混- 热)颗粒的粒径,这是因为先加热WPI后与CS混合制备的WPI-CS颗粒的蛋白质内核是在没有多糖存在的情况下形成的,颗粒粒径主要取决于WPI在加热过程中的聚集程度;而先混合WPI与CS,再加热混合物制备的WPI-CS颗粒粒径还受到CS比例的影响,会出现已经形成的WPI-CS颗粒与WPI聚集体二次结合的现象,从而导致最终形成的复合颗粒的粒径更大,这在之前的报道中也有相关说明[13]。WPI-CS(热- 混)颗粒在75 ℃时电位绝对值最大,为20.60 mV,显著高于 WPI-CS(混- 热)颗粒在85 ℃时达到的最大电位绝对值11.97 mV,即WPI-CS(热- 混) 颗粒稳定性更好。这是由于75 ℃加热WPI时,WPI的解折叠程度低,在疏水相互作用和静电相互作用的驱动下CS包裹在WPI表面且结构稳定,表现为电位绝对值大[24];而先混合WPI和CS,再进行加热处理会使得已经形成WPI-CS颗粒中的WPI构象发生改变,WPI与CS结合作用减弱,体系变得不稳定。研究表明,混合方式不会对WPI-CS颗粒的结合程度产生影响,先加热WPI再与CS混合的方式可制备粒径更小的复合颗粒,且该复合颗粒的稳定性更好。
2.2.2热处理温度对WPI-CS颗粒特性的影响
热处理温度直接影响蛋白质的聚集程度和颗粒形态。由表1可以看出,3种热处理温度形成的WPI-CS颗粒中WPI与CS的组成比例没有显著性差异,说明热处理温度不会对WPI-CS颗粒的结合程度产生影响。随着热处理温度的增加,WPI和WPI-CS(热- 混)颗粒的粒径逐渐增加,电位绝对值逐渐减小。这是因为温度升高,WPI的变性程度增加,解折叠程度更高,内部的疏水基团暴露的更多,表面电荷随之减少,WPI分子间的疏水相互作用得到加强,聚集程度增加[25],从而形成粒径更大、电位绝对值更小的颗粒。热处理温度对WPI-CS(混- 热)颗粒的影响表现为随温度的增加,颗粒粒径逐渐增加,电位绝对值先增大后减小,这可能是因为适当热处理可促进WPI与CS的静电络合反应,而温度过高会破坏WPI-CS颗粒的稳定结构,表现为电位绝对值下降。本研究结果表明,75 ℃热处理WPI颗粒再与CS混合形成的复合颗粒的稳定性最好,且颗粒粒径较小。
2.3 剪切处理对WPI-CS颗粒特性的影响
为了明确剪切处理对颗粒粒径和电位的影响,将WPI和WPI-CS颗粒进行高速剪切处理,剪切后颗粒的粒径和ζ电位的测定结果见表2。从表2可以看出,剪切处理后WPI颗粒和2种WPI-CS颗粒的粒径值均随温度的升高而增大,且WPI-CS(热- 混)颗粒的粒径比WPI-CS(混- 热)颗粒的粒径更小,75 ℃时为744.5 nm;剪切后WPI颗粒和WPI-CS(热- 混)颗粒在75 ℃获得最大电位绝对值,WPI-CS(混- 热)颗粒在85 ℃获得最大电位绝对值,该现象与未剪切时颗粒的粒径和ζ电位变化情况一致。结合表1和表2,对比剪切前后相同制备条件下的颗粒粒径和ζ电位能够看出,剪切处理可有效减小颗粒的粒径,对WPI颗粒和先加热WPI后与CS混合制备的WPI-CS颗粒的 ζ电位无明显影响。本研究表明:剪切处理可获得粒径更小的WPI和WPI-CS颗粒,且不会改变混合方式和热处理温度对颗粒粒径产生的影响;75 ℃或95 ℃热处理WPI再与CS混合制备的WPI-CS颗粒经剪切处理能形成粒径更小、稳定性更好的复合颗粒。

表2 剪切后WPI颗粒和WPI-CS复合颗粒的粒径与电位Tab.2 Particle size and ζ potential of WPI particles and WPI-CS composite particles after shearing
2.4 WPI-CS复合颗粒的微观结构分析
根据2.1、2.2、2.3中的实验结果,制备在75、95 ℃热处理条件下剪切处理的WPI-CS(热- 混)颗粒。图3为WPI和WPI-CS颗粒在60×物镜下观察到的荧光图像,其中绿色荧光为CS,红色荧光为WPI。从图3(a)可以看到,75 ℃热处理后的WPI以小颗粒状均匀地分布在体系中。从图3(b)可以看出,几乎整个视野内呈现黄色荧光。这是因为75 ℃热处理后WPI解折叠,内部疏水基团展开,在疏水相互作用下发生聚集。CS在静电相互作用和疏水相互作用下包裹在聚集的WPI表面,发生共定位现象,表现为黄色荧光,形成以WPI为核、CS为壳的复合颗粒。观察图3(c)可以发现,视野内呈现红色、绿色、黄色3种荧光,说明只有部分WPI与CS发生共定位现象,这是因为95 ℃热处理后WPI解折叠程度过高,疏水相互作用增强,聚集程度更高,CS难以完全覆盖WPI表面,最终形成 “核壳”结构残缺的复合颗粒。本研究表明,75 ℃热处理条件下WPI能够更好地与CS结合,形成的复合颗粒结构更加完整。

图3 WPI颗粒和WPI-CS复合颗粒的微观结构Fig.3 Microstructure of WPI particles and WPI-CS composite particles
3 结 论
乳清蛋白和壳聚糖是构建具有核壳结构复合微粒的理想原料。当盐离子浓度为0、pH值为5.47时,二者复合程度最高。热处理温度越高,颗粒粒径越大。采用先加热WPI再与CS复合,所制备的颗粒粒径更小且电位绝对值更大。剪切处理可有效降低颗粒粒径。本研究表明,75 ℃热处理、热- 混方式可以制备具有完整“核壳”结构、粒径为744.5 nm的复合微粒。研究结果旨在为蛋白质- 多糖生物聚合物颗粒的制备及将其作为包封材料或脂肪替代物的开发提供重要数据。本研究探索了WPI-CS复合颗粒的形成条件及结构特性,后续可进一步研究颗粒体系的流变性、乳化性能、润滑性等,明确WPI-CS复合颗粒的应用特性。

