陈皮心血管药理作用的网络解析
郭 杰
(鹤壁职业技术学院 医学院,河南 鹤壁 458030)
心血管疾病(cardiovascular disease,CVD)是心脏及外周动脉、静脉、微血管等血液循环系统疾病的统称.临床上常见的CVD有高血压、心肌病、心肌炎、冠心病、心脏瓣膜疾病等,具有发病率高、致残率高、死亡率高等特点,已成为人类死亡的头号病因[1].由于CVD发病机制复杂,单靶点药物难以统筹兼顾,患者往往要服用抗凝、降压、调脂等多种药物.
中药具有多靶点、多环节和整体调节等特点,在CVD的预防和治疗中具有很大潜力.陈皮(CitriReticulataePericarpium)始载于《神农本草经》[2],为芸香科植物橘及其栽培变种的干燥成熟果皮,性温,味辛、苦,归脾经、肺经,具有理气健脾、燥湿化痰等功效,主要用于治疗消化系统脾胃气滞、呕吐、呃逆[3],以及呼吸系统湿痰、寒痰所致的咳嗽[4].近年研究[5-7]发现陈皮的很多化学成分,特别是黄酮类,具有调血脂、抑制血小板聚集、抗凝、抗炎、抗氧化等多种心血管药理效应,但具体机制仍不清晰.本研究运用网络药理学的方法,探究陈皮治疗心血管疾病的药效物质、作用靶点、生物过程及信号通路,以期系统阐释陈皮治疗CVD的科学内涵,为其临床应用拓展提供证据.
1 资料与方法
1.1 陈皮活性成分及成分-靶点网络构建
通过中药系统药理学分析平台(TCMSP,http://ibts.hkbu.edu.hk/LSP/tcmsp.Php)收集陈皮的主要化学成分,根据OB≥30% 和 DL≥0.18初筛候选化学成分,同时结合文献报道补充活性成分.以陈皮活性成分为研究对象,在TCMSP数据库中检索活性成分已知靶点,利用Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov)查找活性成分的3D分子结构式,将.SDF格式导入DTPS靶点预测系统(http://demo.dtps.iprexmed.com/#/index)找出活性成分潜在靶点;再运用UniProt数据库(http://www.uniprot.org/)将靶点统一转换为基因名称.将上述两个来源的基因合并,构建陈皮靶基因集合,最后利用Cytoscape 3.7.2软件构建陈皮活性成分-靶点网络.
1.2 陈皮治疗CVD相关基因库的构建
运用GeneCards、DisGeNET、OpenTargets数据库获取CVD相关基因;将获取的CVD基因按照相关性分值依次取排名前100的基因,筛除重复后合并,构建CVD基因库.利用Venny 2.1(http://bioinfogp.cnb.csic.es/tools/venny/index.html)对CVD相关靶点与陈皮活性成分靶点映射取交集,确定陈皮治疗CVD的靶点.
1.3 靶蛋白相互作用研究
利用String平台(https://string-db.org/)研究陈皮治疗CVD靶蛋白间的相互作用(protein-protein interaction,PPI),将蛋白种类设置“Homo Sapiens”进行操作,最低相互作用阀值设为“medium confidence =0.4”,其余参数保持默认,结果保存为.TSV格式并导入Cytoscape 3.7.2软件,再利用“Network Analysis” 插件进行网络拓扑属性分析,设置节点大小反映度值(degree)变化,边的粗细反映介度值(betweenness)大小,建立靶点蛋白相互作用网络.
1.4 基因本体(Gene Ontology,GO)分析
运用 Cytoscape 3.7.2 软件中“ClueGO”插件对核心靶点进行GO富集分析,探讨关键靶点在体内可能实现的生物分子过程.设置:定义来源为“Homo sapiens”(智人),P值≤0.05,Interval Min Level =2,Max Level =3;选择生物过程(biological process)模块对基因进行生物功能注释.
1.5 KEGG通路研究
通路分析能显示蛋白质相互关系网络中不同信号通路的重要性程度,本研究利用DAVID平台(Version 6.8)结合Omicshare数据库筛选核心通路,将结果以气泡图形式呈现,并根据富集因子值分析核心通路富集程度,以探究陈皮治疗CVD可能的作用机制.其中,节点大小表示富集的靶点数量.
2 结果
2.1 陈皮活性成分及活性成分-靶点网络构建
按照OB≥30%和DL≥0.18筛选活性成分,虽然橙皮苷、柚皮苷、柠檬烯和辛弗林等陈皮成分的OB值或DL值较低,但它们含量较高且文献[8-10]证实它们确有药理活性,故最终纳入11个活性成分,见表1.根据结构特点,11个活性成分可分为黄酮类(柚皮素、橙皮素、米橘素、川陈皮素、橙皮苷、桔皮素、柚皮苷)、挥发油类(柠檬烯、α-蒎烯)和生物碱类(辛弗林、N-甲基酪胺).
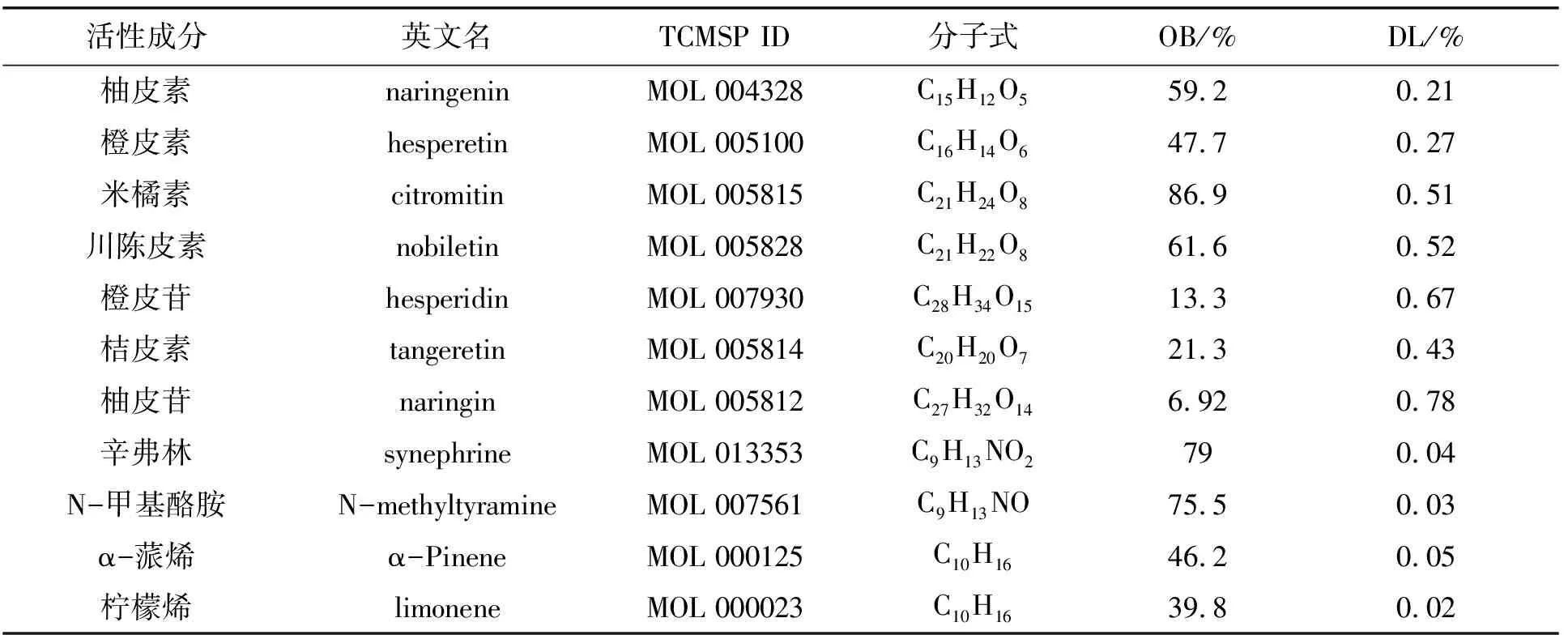
表1 陈皮活性成分及其信息
图1系活性成分-靶点网络,共有223个节点和275条边.其中7个箭头节点代表黄酮类成分,2个八边形节点代表挥发油类成分,2个菱形节点代表生物碱类成分,212个圆形节点代表陈皮的作用靶点,275条边代表陈皮活性成分对靶点的作用.
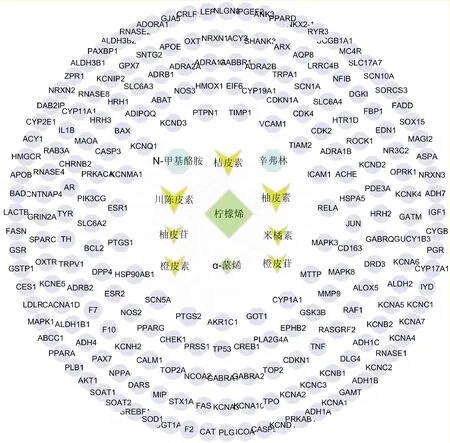
图1 “活性成分-靶点”网络
2.2 陈皮活性成分治疗CVD靶点分析
从TCMSP平台和DTPS靶点预测系统获得212个活性成分作用靶点;综合GeneCards、DisGeNET、OpenTargets数据库筛得232个CVD靶点.如图2所示,应用Venny 2.1将两者映射取交集得到陈皮治疗CVD靶点32个,依据靶点功效可分为炎症反应类、血压调节类、糖脂代谢类、凝血纤溶类以及离子通道类等,均与心血管系统主要病理机制密切相关,见表2.

图2 成分-CVD靶点韦恩图

表2 陈皮治疗CVD靶点的归类
2.3 PPI网络分析
如图3所示,32个CVD治疗靶点均参与了PPI网络,248条连线代表了靶点间的相互作用,其中度值较大的靶点包括蛋白激酶B(degree=27)、一氧化氮合酶(degree=24)、肿瘤坏死因子(degree=23)、载脂蛋白E(degree=22)、内皮素-1(degree=22)、胰岛素样生长因子1(degree=22)、细胞肿瘤抗原p53(degree=21)、过氧化物酶体增殖物激活受体γ(degree=21)、瘦素(degree=21)、基质金属蛋白酶-9(degree=21)、白细胞介素-1β(degree=21)、前列腺素内过氧化物合酶2(degree=21)、脂联素基因(degree=20)、细胞间黏附分子1(degree=20)等,说明上述靶点在网络中处于主要位置,可能是陈皮活性成分治疗CVD的关键靶点.
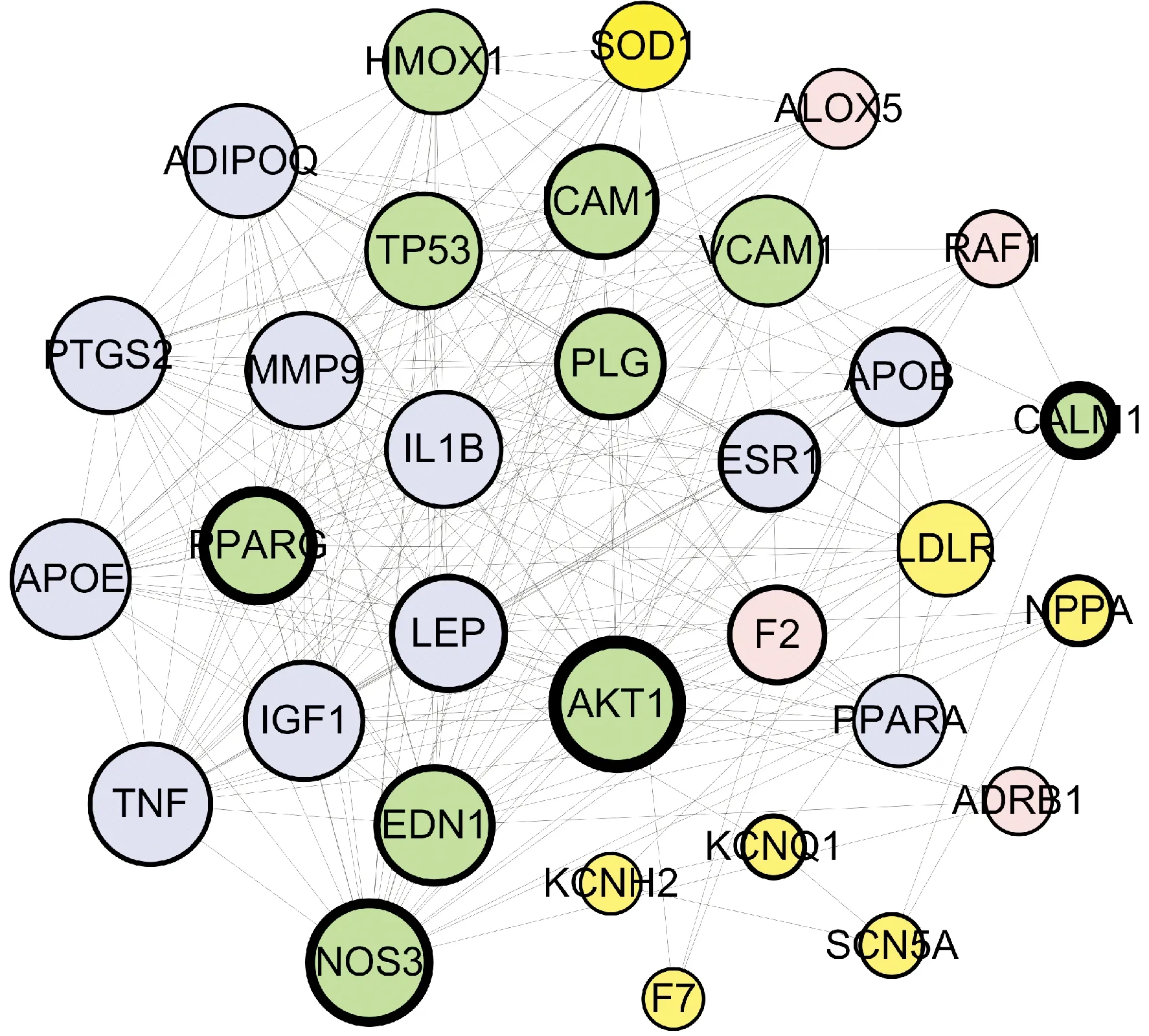
图3 靶蛋白PPI网络
2.4 GO富集注释
32个靶点参与了113个GO条目,包含610条层级关系连线,可分为活性氧生物合成过程(34.74%)、脂质代谢过程正向调控(14.74%)、小分子代谢过程正向调控(8.95%)、脂质定位(8.95%)、血液凝固(6.84%)、平滑肌细胞增殖(5.26%)、平滑肌细胞增殖调控(3.68%)、肌肉适应(3.16%)、活性氮代谢过程(3.16%)、氧化还原酶活性调控(2.63%)、平滑肌适应性(2.63%)、平滑肌细胞增殖负调控(2.11%)、脂肪蓄积负调控(1.58%)、饮食过量的反应(0.53%)、血压调节(0.53%)、寒冷反应(0.53%)等16大类,见图4、图5.
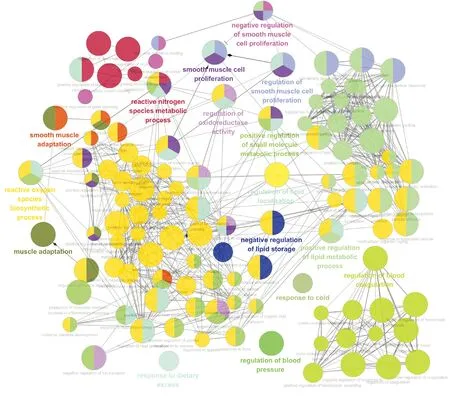
图4 GO功能注释网络
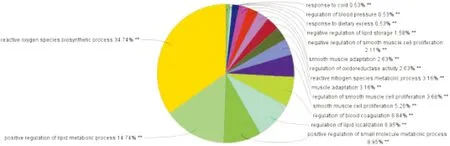
图5 GO功能注释饼状图
2.5 KEGG信号通路分析
KEGG信号通路富集共筛出16条与CVD形成、发展密切相关的信号通路,结果见表3.其中富集因子(Richfactor,靶基因/该通路所有基因的数量)较大的包括肿瘤坏死因子信号通路、HIF-1信号通路、雌激素信号通路、NF-kappa B信号通路、AMPK信号通路、VEGF信号通路、心肌细胞肾上腺素能信号、cGMP-PKG信号通路、cAMP信号通路、胰岛素抵抗、MAPK信号通路、脂肪细胞脂解的调控、mTOR 信号通路、催乳素信号通路、PPAR信号通路、补体和凝血级联等,见图6.
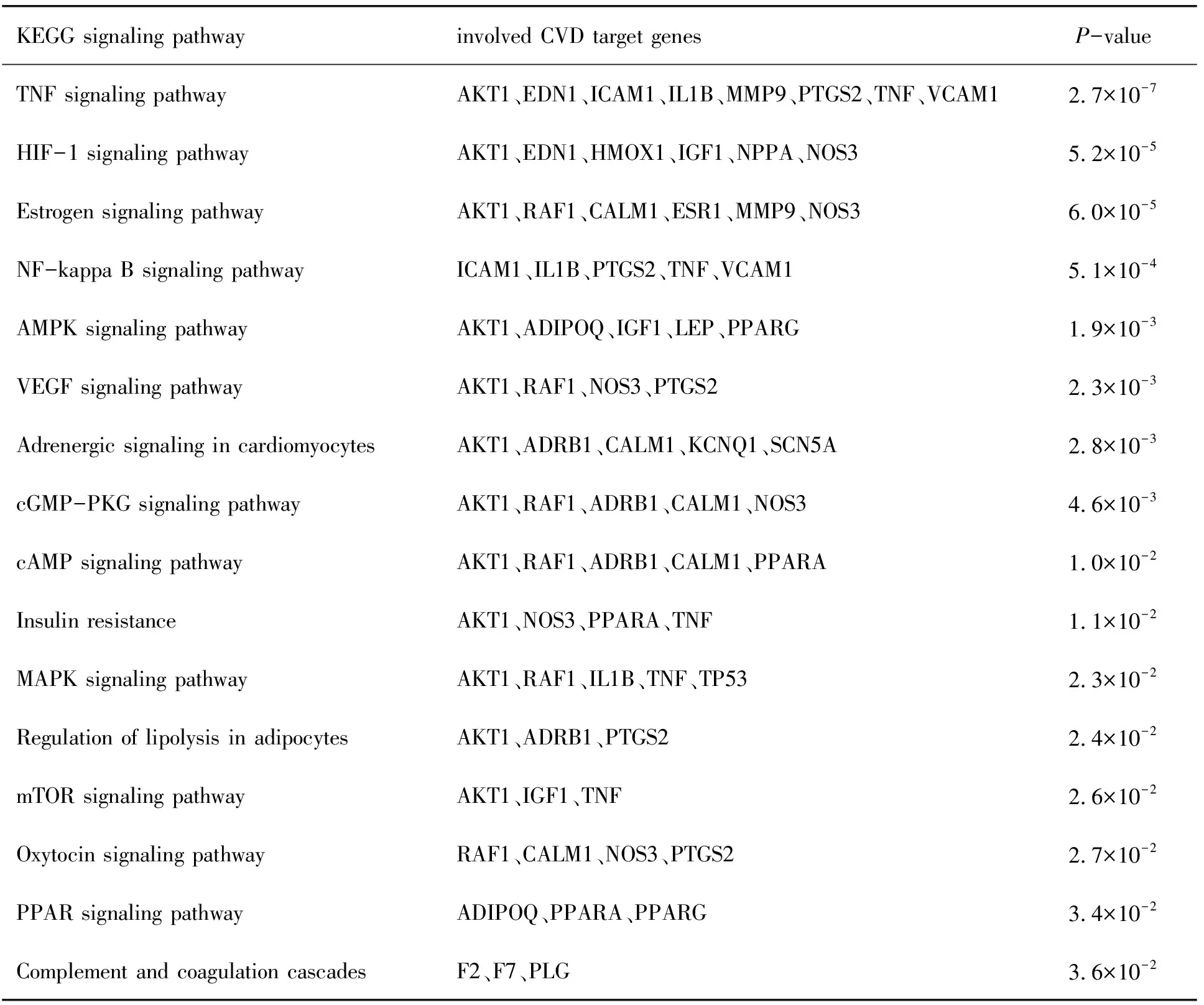
表3 KEGG信号通路

图6 KEGG信号通路点状图
3 讨论
CVD是全球发病率最高的非传染性疾病之一,也是人类致死、致残的主要原因.据估算,中国现有2.9亿CVD患者,CVD的患病率和死亡率持续上升,占居民疾病死因首位,已成为严重的公共卫生问题[11].临床治疗CVD的药物主要有他汀类降脂药、阿司匹林等抗血小板聚集药,以及多种降压药等[12],但这些药物在使用中存在一定的不良反应及耐药现象[13].
陈皮具有调血脂[14]、抗血栓[15]、抗动脉粥样硬化[16]、心肌保护[17]等多重心血管药理作用,但具体药效物质和作用机制尚未系统明确.本研究发现陈皮作用于ESR1和NOS3等调节血压;作用于APOB和PPARG等调节脂代谢;作用于F2和PLG等平衡凝血纤溶系统;作用于SCN5A、KCNQ1等离子通道抗心律失常.研究[18-19]表明ESR1可促进NOS3的表达,进而增加血管内NO释放来舒张血管;而NOS3的+G894T多态性位点则可能是高血压继发左室肥厚遗传易感性的标志之一.冠状动脉粥样硬化患者血浆中APOB水平明显升高[20],PPARG缺乏的小鼠很容易发生严重的脂肪代谢异常[21].此外,SCN5A、KCNQ1基因突变均会导致严重的心律失常[22-23].这些靶点涉及的活性成分主要包括柚皮苷、柚皮素、橙皮素、橙皮苷等,实验[24]证实橙皮苷可降低高血脂大鼠血清总胆固醇、低密度脂蛋白水平,升高高密度脂蛋白水平;抑制由胶原、花生四烯酸、ADP和凝血酶诱导的大鼠血小板凝聚,延长小鼠尾静脉出血时间.橙皮素可减轻动脉粥样硬化病变[25];促进脂肪酸氧化和三羧酸循环,降低肝内脂肪酸的量.刘正兵等[26]还发现橙皮苷、橙皮素及其衍生物可抗心肌凋亡、抑制血管平滑肌增殖、迁移,在心肌损伤、心脏重构、心肌缺血、梗死等方面均有良好作用.柚皮苷主要通过抑制VCAM-1、MCP-1和ICAM-1表达,抑制巨噬细胞渗入、平滑肌细胞增殖、免疫细胞黏附、内皮功能紊乱,减少高脂动物血管斑块的发展,从而发挥抗动脉粥样硬化的作用[27].与此同时,柚皮素、柚皮苷可使小鼠主动脉粥样斑块中SRA、LOX-1和ACAT1表达下调,进而抑制小鼠主动脉粥样硬化斑块的形成[28].
GO富集分析发现这些靶点主要富集在血脂调节方面的脂质代谢过程正调控、脂质定位、脂肪蓄积负调控,血管平滑肌方面的平滑肌细胞增殖、平滑肌细胞增殖调控、平滑肌细胞增殖负调控,氧化损伤方面的活性氧生物合成过程、氧化还原酶活性调控,以及血液凝固、血压调节等.这些生物过程大都与CVD密切相关,如血管平滑肌细胞增殖和迁移对动脉粥样硬化的发生具有重要作用[29];活性氧(ROS)是体内细胞重要的第二信使,研究[30]证实其在体内的生物合成和抗氧化防御体系的不平衡会导致人体代谢性疾病和心血管疾病中的血管损伤.KEGG富集包括脂肪代谢相关的PPAR信号通路和脂肪细胞脂解调控;血凝调控的补体和凝血级联;心血管调控的VEGF、心肌细胞肾上腺素能信号通路;炎症调控的TNF和NF-kB信号通路;以及雌激素、胰岛素抵抗等内分泌通路.这些KEGG通路与GO生物过程相互印证,显示陈皮活性成分通过调血脂、抗炎、抗血栓、心肌保护等多个效应治疗CVD.如NF-κB信号通路的异常激活与动脉粥样硬化的发生发展密切相关[31],抑制NF-κB信号通路可减少ICAM-1、VCAM-1等基因的表达进而发挥延缓动脉粥样硬化病变的作用[32].目前已证实,VEGF对维持正常血压具有重要的作用,其可促使血管内皮细胞释放一氧化氮和前列腺素等继而使血管舒张、血压降低[33].另外,经研究[34]发现β肾上腺素受体与心衰的发生密切相关,其机制可能是通过肾上腺素能信号通路改变、交感神经兴奋等过程实现.
综上所述,本研究基于网络药理学构建陈皮活性成分-靶点网络、靶蛋白互作网络,富集靶点GO生物过程及KEGG通路,进而预测到陈皮抗炎、抗氧化、抗凝、保护心肌,以及调节血脂等心血管药理作用,为陈皮治疗CVD的实验研究提供了方向与线索.

