变叶榕根总黄酮提取工艺及其抗氧化活性研究
习丹,陈明,吴文明,张菁华,陈途*
1. 江西省人民医院(南昌医学院第一附属医院)药学部(南昌 330006);
2. 咸宁市公共检验检测中心(咸宁 437100);3. 咸宁市中医医院(咸宁 437100)
变叶榕(Ficus variolosa)属双子叶植物桑科(Moraceae)榕属植物,产自我国浙江、江西、福建、广东(及沿海岛屿)、广西、湖南、贵州、云南东南部及南部,常生于溪边林下潮湿处。越南、老挝也有分布[1]*。据《浙江植物志》记载,茎清热利尿,叶敷跌打损伤,根亦入药,补肝肾,强筋骨,祛风湿等功效。从桑科榕属植物中分离得到的化合物有三萜类化合物、黄酮类化合物、倍半萜、香豆素、生物碱、甾醇等[2]*。对变叶榕较为系统的化学成分研究还不多见。试验采用微波辅助提取,利用高频电磁波加速细胞破裂,促进黄酮类物质溶出,进一步优化总黄酮提取工艺,并考察其体外抗氧化活性,为变叶榕总黄酮高效提取及进一步研发提供依据。
1 材料与方法
1.1 材料与试剂
变叶榕根(采自江西省资溪县,经江西省人民医院药学部副主任应萍鉴定为正品)。芦丁对照品(纯度>98%,R189033-5 g,Aladdin);亚硝酸钠(S818033-500 g,麦克林);氢氧化钠(2110281,西陇科学);硝酸铝(A800886-500 g,麦克林);2, 2’-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(d6132-1 g,麦克林);2, 2-联苯基-1-苦基肼基(D141336-250 mg,Aladdin);过二硫酸钾(2107162,西陇科学);铁氰化钾(P111564-100 g,Aladdin);L(+)-抗坏血栓(2110142,西陇科学);其他化学试剂均为分析纯。
1.2 仪器与设备
NP80 touch型超微量分光光度计(德国Implen公司);CW-2000型超声微波协同萃取仪(上海亚荣生化仪器厂);RE-2000B型旋转蒸发仪、SHZ-Ⅲ型循环水真空泵(上海亚荣生化仪器厂);HH·SII-Z-S型电热恒温水浴锅(上海新苗医疗器械制造有限公司);FBC1002型超纯水机(青岛富勒姆科技有限公司);Mettler AE240电子天平(万分之一,美国梅特勒-托利多仪器公司);DZF-6050AB真空干燥箱(邦西仪器科技有限公司)。
1.3 方法
1.3.1 样品预处理
变叶榕根样品放入恒温干燥箱内60 ℃烘干至恒重,粉碎,过0.250 mm孔径(60目)筛,收集粉末,备用。
1.3.2 总黄酮提取工艺
精密称取1.00 g供试品粉末于50 mL圆底烧瓶中,分别在不同的乙醇体积分数、微波功率、提取时间和料液比因素的条件下提取,减压过滤提取液,用旋转蒸发仪进行旋转制成浸膏,按照配比加入乙醇溶解,用离心机进行离心,得到的溶液定容到容量瓶中,再进行稀释,配成待测溶液,测定其吸光度,计算提取率。
1.3.3 总黄酮含有量测定
1.3.3.1 线性关系考察[3]*
精密称取26.47 mg芦丁标准品,加适量75%乙醇溶解并定容至50 mL,作为储备液。用移液管精密取0,0.25,0.50,1.00,1.25和1.50 mL储备液分别置于10 mL量瓶中,加0.4 mL 5%亚硝酸钠溶液,摇匀静置6 min,加入0.4 mL 10%硝酸铝溶液,摇匀静置6 min,加4 mL 4%氢氧化钠溶液,加无水乙醇定容,摇匀放置15 min。在510 nm处测定吸光度。以吸光度为纵坐标(A),溶液质量浓度为横坐标(X)进行回归,得方程A=0.008 3X-0.029 2(R2*=0.996 3),在0~79 μg/mL范围内线性关系良好。
1.3.3.2 提取率测定
提取率按式(1)计算。

1.3.3.3 重复性试验[4]*
配制0.1 mg/mL芦丁对照品溶液,于0,2,4,6,8和10 h测定吸光度,测得其SRSD为0.192%,表明该方法重复性良好。
1.3.3.4 精密度试验
0.1 mg/mL芦丁对照品溶液,连续测定吸光度6次,测得其SRSD为0.283%,表明仪器精密度良好。
1.3.3.5 加样回收率试验
取10 mL 0.053 94 mg/mL提取液,共9份,置于50 mL量瓶中,加入10 mL 0.061,0.053和0.042 mg/mL芦丁对照品溶液,共3份,用75%乙醇定容,测定吸光度,计算加样回收率。结果显示,3份溶液的回收率分别为99.4%,98.7%和99.8%,SRSD为0.96%。
1.3.4 单因素试验
以变叶榕根总黄酮提取率为指标,在固定其他试验条件的情况下,分别考察乙醇体积分数、微波时间、微波功率、料液比对变叶榕根总黄酮提取率的影响。用紫外分光光度计测定提取液中总黄酮含量,根据变叶榕根中总黄酮提取率,考察分析微波萃取中的单个因素影响。
1.3.4.1 微波功率
固定样品粉末用量1.0 g、乙醇体积分数60%、料液比1∶40(g/mL)、微波时间20 min,选择微波功率200,300,400,500和600 W,取1 mL,按1.3.3.1的方法稀释到10 mL,测定吸光度。
1.3.4.2 微波时间
固定样品粉末用量1.0 g、乙醇体积分数60%、料液比1∶40(g/mL)、微波功率500 W,选择微波时间5,10,15,20和25 min,取1 mL,按1.3.3.1的方法稀释到10 mL,测定吸光度。
1.3.4.3 料液比
固定样品粉末用量1.0 g、乙醇体积分数60%、料液比1∶40(g/mL)、微波功率500 W、微波时间20 min,选择料液比1∶10,1∶20,1∶30,1∶40和1∶50(g/mL),取1 mL,按1.3.3.1的方法稀释到10 mL,测定吸光度。
1.3.4.4 乙醇体积分数
固定样品粉末用量1.0 g、料液比1∶40(g/mL)、微波功率500 W、微波时间20 min,选择乙醇体积分数40%,50%,60%,70%和80%,取1 mL,按1.3.3.1的方法稀释到10 mL,测定吸光度。
1.3.5 响应面法优化[5]*
在单因素试验基础上,进一步对4个单因素条件(乙醇体积分数、液料比、微波功率、微波提取时间)进行考察,以总黄酮提取率为响应指标,应用Design-Expert 13.0.1.0软件,优化试验条件。
1.3.6 抗氧化活性测定
1.3.6.1 药液配制
将最优条件下得到的提取液在50~55 ℃下浓缩至2.01 mg/mL,用75%乙醇依次稀释至5.00,10.00,15.00,20.00和25.00 μg/mL,并配制相同质量浓度维生素C、芦丁溶液作为对照,冷藏备用。
1.3.6.2 对DPPH·的清除能力
参照Yu等[6]*报道的方法,略有改动。精密吸取100 μL不同质量浓度的样品溶液(6.25,12.5,25,50和100 μg/mL),加入100 μL的100 μg/mL DPPH溶液,充分混匀后,避光,于37 ℃反应30 min,于酶标仪在517 nm处测定吸光度As。同时设定溶剂空白组(An,DPPH溶液用等体积甲醇代替)和样品空白组(A0,样品溶液用等体积甲醇代替)。以VC为阳性对照。试验重复3次。按式(2)计算各组分对DPPH·清除率,并依此计算IC50值。
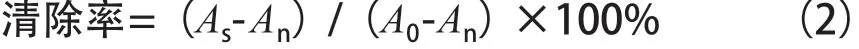
1.3.6.3 对ABTS+*·的清除能力[7]*
参照王荣等[7]*报道的方法。避光称取15 mg ABTS自由基粉末,加4 mL超纯水溶解,得7.0 mmol/L的ABTS水溶液。称取5 mg K2S2O8加7.5 mL超纯水溶解,将以上2种溶液按体积比1∶1等量混合,制备ABTS+*·母液,置于4 ℃冰箱保存10~12 h,备用。使用时,用无水乙醇稀释至吸光度在0.7±0.02范围内即可。将各组分的母液用无水乙醇稀释成不同质量浓度的样品溶液(6.25,12.50,25.00,50.00和100.00 μg/mL)。以100 μL各组分样品溶液和100 μL ABTS+*·水溶液为试验组,对照组为100 μL无水乙醇代替ABTS+*·水溶液,以加入100 μL ABTS+*·水溶液和100 μL无水乙醇为标准组,每个浓度设置3个复孔。避光反应30 min,用酶标仪在734 nm下测定吸光度。以VC为阳性对照。上述试验重复3次。按式(2)计算ABTS+*·清除率,计算IC50值。
1.3.6.4 对 Fe3+*还原能力
参照Mazor等[8]*与朱伟等[9]*报道的方法,取0.8 mL不同质量浓度的样品溶液(6.25,12.50,25.00,50.00和100.00 μg/mL),加入2 mL磷酸盐缓冲液(pH 6.6)和2 mL 1%铁氢化钾,于50 ℃水浴20 min,加2 mL 10%三氯乙酸,以3 000 r/min离心10 min,取2 mL上清液加2 mL去离子水、0.4 mL 0.1%三氯化铁,反应5 min,于700 nm测吸光度,以VC为阳性对照,试验平行操作3次,测得的吸光度越大表示还原能力越强[10]*。
还原力试验的原理是样品将铁氢化钾还原成亚铁氢化钾,亚铁氰化钾与铁离子作用,生成普鲁士蓝,在700 nm波长处测定吸光度,吸光度越大,表明其对Fe3+*还原的活性越强。吸光度0.5时的样品浓度,即为IC50值,IC50值越小表示样品还原能力越强[11]*。
2 结果与分析
2.1 单因素试验
2.1.1 微波功率[12]*
图2显示,总黄酮提取率随着微波功率升高而先升高后降低,其原因是微波离子传导作用可随其功率增大而增强,促使变叶榕根细胞膜膨化、破裂,总黄酮在功率500 W时全部溶出,继续增大微波功率,不但损耗能量,黄酮提取率还会随之下降,可能是热效应导致黄酮分解[13]*,故确定微波功率为500 W。
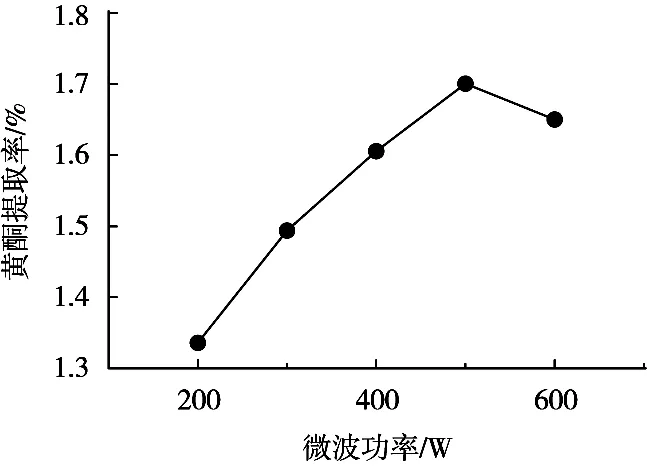
图2 微波功率对总黄酮提取率的影响
2.1.2 微波时间
图3显示,微波提取时间小于20 min时,总黄酮提取率随着时间延长热效应逐渐加强,释放量随之增大,20 min时最高,表明该成分已完全释放。25 min时,提取率迅速下降,主要是由于过量热效应可使总黄酮分解,故确定微波时间为20 min。

图3 微波时间对总黄酮提取率的影响
2.1.3 料液比
提取溶液料液比对提取率产生影响,选取合适的料液比可以增加黄酮的提取量[14]*。图4显示,随着料液比中乙醇用量增加,总黄酮逐渐被溶出,提取率逐渐增加。但其过量时,反而会因杂质溶出而导致总黄酮提取率下降,故确定料液比为1∶40(g/mL)。

图4 料液比对总黄酮提取率的影响
2.1.4 乙醇体积分数
图5显示,乙醇体积分数小于60%时,总黄酮提取率随着其升高而增加,并在60%时达到溶解平衡,提取率最高。大于60%时,过量渗透压会将变叶榕根中杂质溶出,提取率反而下降,故确定乙醇体积分数为60%。

图5 乙醇体积分数对总黄酮提取率的影响
2.2 响应面优化变叶榕根黄酮的提取工艺
2.2.1 因素水平设计
通过Design-Expert 13.0.1.0软件分析,以总黄酮提取率为评价指标(Y)进行优化[15]*,因素水平设计见表1,结果见表2。回归方程为Y=17.64+0.24A-0.69B+0.18C+0.29D-0.067AB+0.005AC-1.41AD-0.095BC+0.56BD-0.59CD-0.69A2*-1.75B2*-0.82C2*-1.98D2*。

表1 响应面因素水平设计
2.2.2 响应面优化设计试验结果及方差分析
Box-Behnken试验设计及试验结果见表2。
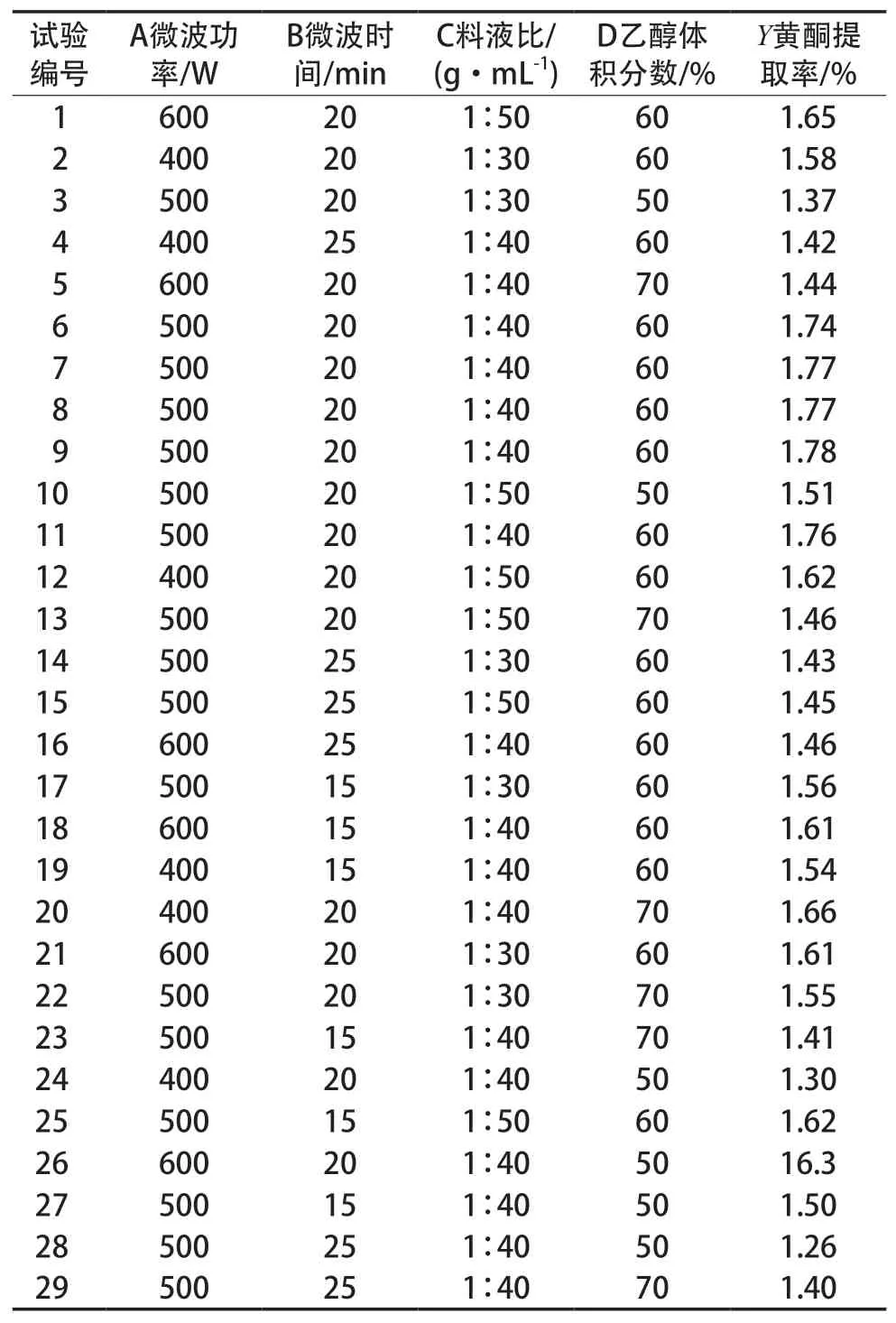
表2 Box-Behnken试验设计及试验结果
方差分析见表3。由此可知:模型P<0.000 1,表明模型显著;失拟项P>0.05,表明模型失拟性不显著;R2*为0.990,表明模型回归显著,准确度高;Radj2*为0.981,表明总黄酮提取率与各因素之间相关度较高;C.V.仅为1.29%,表明模型可靠性高;模型F值与变量对响应值影响呈正比[16]*,故各因素影响程度依次为微波时间(B)>乙醇体积分数(D)>微波功率(A)>料液比(C),与单因素试验结果一致;两因素相互作用影响程度依次为AD>CD>BD>BC>AB>AC。响应面分析见图6~图11。

图1 芦丁标准曲线
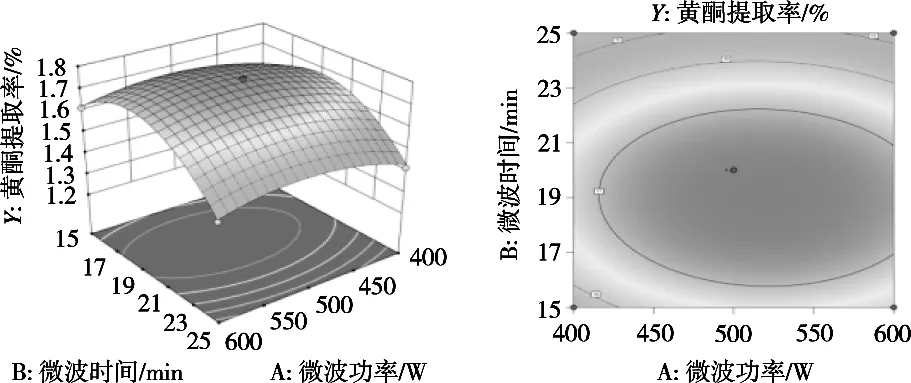
图6 微波功率(A)和微波时间(B)交互作用对提取率的影响

图11 料液比(C)和乙醇体积分数(D)交互作用对提取率的影响

表3 方差分析
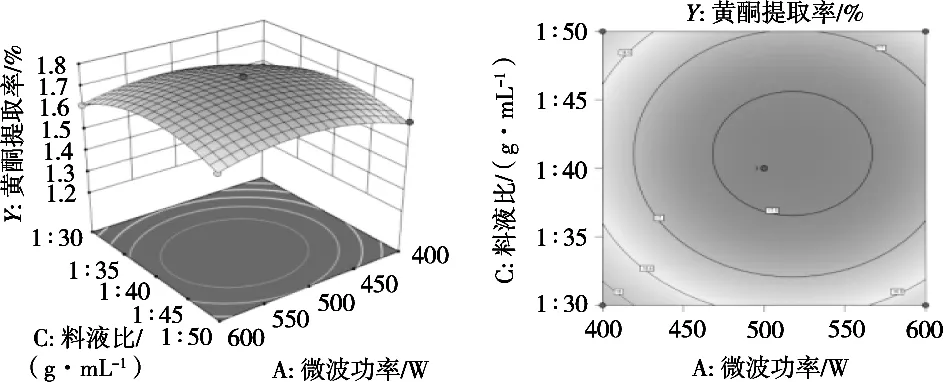
图7 微波功率(A)和料液比(C)交互作用对提取率的影响

图8 微波功率(A)和乙醇体积分数(D)交互作用对提取率的影响

图9 料液比(C)和微波时间(B)交互作用对提取率的影响

图10 乙醇体积分数(D)和微波时间(B)交互作用对提取率的影响
2.3 验证试验
最优工艺为乙醇体积分数59.3%、料液比1∶41.4(g/mL)、微波功率525.7 W、微波时间18.9 min,此时总黄酮提取率为1.77%。结合实际生产操作,将其修正为微波功率500 W、微波时间20 min、乙醇体积分数60%、料液比1∶40(g/mL),其他条件不变。开展3批验证试验,测得总黄酮平均提取率为1.771%,接近预测值1.774%,表明模型拟合情况良好。
2.4 抗氧化活性
2.4.1 对DPPH·的清除能力
图12显示,随着提取物质量浓度的增大,变叶榕根总黄酮和VC对DPPH·的清除能力逐渐上升,但均低于VC,在100 μg/mL时达到最大值,自由基清除率为总黄酮96.83%、VC 99.22%,且在高浓度时变叶榕根总黄酮清除率与VC相当。总黄酮的IC50值25.62 μg/mL,阳性对照VC的IC50值8.47 μg/mL。从而可以证明,变叶榕根总黄酮具有良好的抗氧化活性,其活性随浓度升高而增强。

图12 不同浓度总黄酮提取物对DPPH·的清除率
2.4.2 对ABTS·的清除能力
图13显示,总黄酮随着质量浓度升高对ABTS·的清除能力也随之加强,在低质量浓度下与VC差距较大,在质量浓度高于12.5 μg/mL时,总黄酮清除率迅速升高逐渐接近VC,总黄酮的IC50值6.99 μg/mL,阳性对照VC的IC50值2.31 μg/mL。与DPPH·比较,总黄酮对 ABTS·的清除能力相对较强,在质量浓度均低于25.00 μg/mL时明显高于对DPPH·的清除能力。
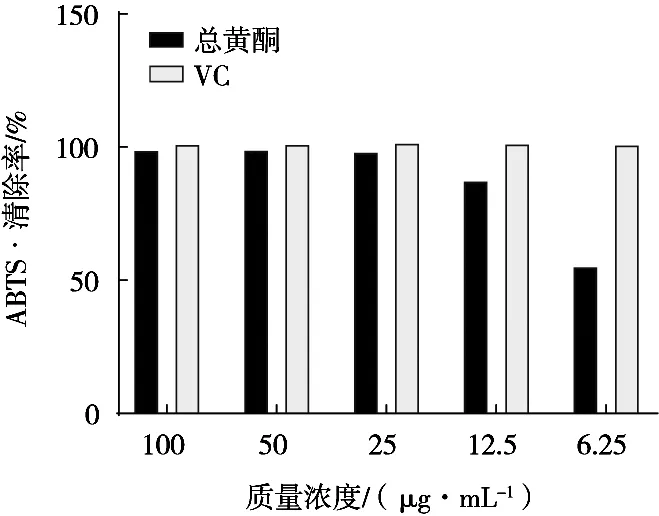
图13 不同浓度总黄酮提取物对ABTS·的清除率
2.4.3 还原能力测定结果
还原力试验的原理是样品将铁氢化钾还原成亚铁氢化钾,亚铁氰化钾与铁离子作用,生成普鲁士蓝,在700 nm波长处测定吸光度,吸光度越大,表明其对Fe3+*还原的活性越强。吸光度0.5时的样品浓度,即为IC50值,IC50值越小表示样品还原能力越强[17]*。
如图14所示,在6.25~100 μg/mL浓度的范围内,变叶榕根总黄酮对Fe3+*还原活性随着浓度的增加活性增强。总黄酮的IC50值大于100 μg/mL,阳性对照VC的IC50值48.26 μg/mL。由此可见,变叶榕根总黄酮对Fe3+*还原活性明显低于VC。

图14 不同浓度总黄酮提取物对Fe3+*的还原能力
3 结论
试验所得最优变叶榕根总黄酮微波辅助提取工艺为乙醇体积分数60%、料液比1∶40(g/mL)、微波功率500 W、微波时间20 min,此时总黄酮提取率为1.77%,接近于预测值,表明工艺准确可靠。变叶榕根总黄酮提取液对DPPH·、ABTS·均有较强的清除能力,在质量浓度高于20 μg/mL仅略低于VC,对Fe3+*还原活性明显低于VC。综上所述,变叶榕根总黄酮具有较强的抗氧化能力,表明该植物可作为天然抗氧化剂应用于食品、保健品等行业,开发前景广阔。

