稻米品质遗传分析研究现状
陈燕红 胡标林 张帆涛*
(1江西师范大学生命科学学院,南昌 330022;2江西省农业科学院水稻研究所/水稻国家工程实验室,南昌 330200;第一作者:xiaofeiyan0508@163.com;*通讯作者:zhang84004@163.com;hubiaolin992@126.com)
水稻是我国主要的粮食作物之一,在我国粮食生产、消费乃至社会稳定中具有至关重要的地位,我国近65%人口以稻米为主食。近年来,随着社会发展和人民生活水平的提高,人们对大米的需求已从量的阶段向质的阶段转变,优质稻米的消费需求持续增长。但目前市场上稻米品质整体形势不容乐观,主要存在垩白粒率和垩白度高、整精米率低以及食味不佳等问题。
稻米品质属于综合性状,包括外观、加工、蒸煮食味和营养品质等方面。其中,外观品质有粒型(粒长、粒宽、长宽比)、垩白、透明度等指标,直接决定稻米商品价值;加工品质包括糙米率、精米率、整精米率等;蒸煮与食味品质主要有直链淀粉含量(AC)、胶稠度(GC)、糊化温度(GT)、RVA 谱等指标,直链淀粉含量决定稻米的适口性、粘性和膨胀性,RVA 谱则可区分直链淀粉含量相近品种的品质优劣,胶稠度影响着米饭的软硬程度,糊化温度的高低反映了米饭煮熟的难易程度[1];营养品质主要包括蛋白质含量,蛋白质不仅具有营养价值,还影响稻米的软硬程度和适口性[2]。稻米品质性状是多基因控制的数量性状,且易受环境影响,传统育种方法难以实现综合改良。随着生物技术的迅猛发展以及稻米品质基因定位克隆、功能研究不断深入,为稻米品质综合改良提供了契机和可行途径[3]。
1 外观品质遗传分析
经典遗传学认为,稻米外观品质主要受母体遗传效应调控,其次受细胞质遗传和种子遗传效应调控,同时还存在环境互作,其中,稻米的长、长宽比和透明度主要以母体遗传效应为主,垩白则主要受种子遗传效应调控[4]。
1.1 粒型
随着分子生物学的迅速发展,稻米外观品质相关基因的定位、克隆和功能研究取得了很大进展。迄今有800 多个QTLs 被报道,其广泛分布水稻12 条染色体上,其中3 号染色体上最多,其次为2 号染色体,10 号染色体最少,表型贡献率介于0.80%~57.50%,粒长QTL 至少有208 个,粒宽QTL 至少有181 个,千粒重QTL 至少有254 个,长宽比和粒厚QTL 数量较少[5-12]。其中,精细定位的QTL 已超过30 个,如粒长QTL gl-3[13]和粒宽QTL gw-5[14]精细定位于87.5 kb 和49.7 kb 区域。另外,粒长QTL qGL7[15]同时影响粒宽、粒厚和千粒重等性状,可能由于一因多效或是基因成簇分布,这为稻米外观品质的协同改良提供了候选位点。此外,超过20 个粒型基因被克隆(数据来自国家水稻数据中心http://www.ricedata.cn),如GS2、GS3、GS5、GS6、GL3.1、GW2、GW5、GW7、GW8、TGW6、BG2 和GW6a 等。
在控制粒长方面,GS3 是1 个负向调控籽粒长度和籽粒质量的主效QTL,其编码1 个由232 个氨基酸组成的结构域跨膜蛋白,无义突变后导致了籽粒长度增加[16]。类似地,GL3.1 /OsPPKL1(编码1 个含Kelch 功能域的PPKL 家族磷酸酶)[17]和GL3.2 /OsPPKL2[18]以及TGW6(编码IAA-葡萄糖水解酶)[19]都负向调节籽粒长度,突变后导致长粒表型。相反,XU 等[20]克隆的BG2 因细胞色素P450(CYP78A13)的编码区有8 个SNPs,其高表达而产生大粒表型。GW6a 编码组蛋白乙酰转移酶类GNAT 蛋白OsglHAT1,因启动子差异表达促进细胞分裂从而增加粒长[21]。另外,SRS3 是通过图位克隆鉴定的1 个水稻小圆粒突变体表型基因,其编码1 个13亚家族驱动蛋白,编码区序列突变导致水稻籽粒粒长变短[22]。
在粒宽基因中,GW2 基因(编码1 个具有E3 泛素连接酶活性的环状蛋白)[23]、GW5 基因(编码1 个富含精氨酸核定位蛋白)[24]和GS6 基因[25](编码1 个含GRAS 基因家族成员的蛋白质)都是籽粒宽度和质量负调控因子,功能缺失时通过促进细胞分裂来增加籽粒宽度和质量,GW2 基因还参与调控垩白。而GS5 基因编码1 个丝氨酸羧肽酶[26],HGW 编码一种泛素相关(UBA)结构域蛋白[27],GW6 编码GAST 基因家族成员蛋白OsGSR1[28],都正调控籽粒宽度和质量,基因高表达时通过促进细胞扩张增加粒宽和粒质量。
在控制粒型方面,GW7 基因(编码拟南芥LONGIFOLIA 蛋白的同源蛋白) 和GW8 基因(编码SQUAMOSA 启动子结合蛋白)是正向调控籽粒长度和籽粒宽度的主效QTLs,OsSPL16-GW7 调控网络可以同时增加水稻产量和提高品质[29]。WG7 是一种编码含有半胱氨酸-色氨酸(CW)域的转录激活子的正调控籽粒大小因子,因结合启动子上调OsMADS1 的表达,增强启动子组蛋白H3K4me3 的富集,最终增加谷粒宽度[30]。相反,OsGRF4/ GS2 是1 个负向调控水稻籽粒大小和质量的半显性QTL,其编码生长调节因子OsGRF4 突变后使粒长和粒宽增加[31]。GSN1(编码丝裂原活化蛋白激酶磷酸酶OsMKP1)[32]和LARGE1/OML4(编码具有3个RRM 结构域的蛋白OML4)[33]都是负调控水稻籽粒长度和宽度因子,功能缺失时可促进穗壳细胞的扩张来增加籽粒大小和质量。
1.2 垩白
垩白是指大米胚乳中由于淀粉颗粒疏松而产生的不透明部分,影响稻米的外观和加工品质,以及食味和商品价值。稻米垩白度高,加工时极易破碎,外观变差,适口性不好,影响商品流通[34]。研究表明,水稻垩白是受多基因控制的、复杂的数量性状,且易受环境影响。其中,温度对垩白的影响极大。WANG 等[35]在灌浆过程中进行了不同垩白度敏感性的高温处理,发现高温降低了PPDK 活性和cyPPDK(丙酮酸正磷酸盐二激酶)mRNA 以及蛋白水平,导致粒质量下降和垩白增加。
迄今已报道超过500 个垩白QTL,表型贡献率介于1.10%~57.70%,其中第5 号染色体上最多,然而精细定位和克隆垩白QTL 较少[7,36-40]。如qACE9[41]和qPGWC-7[42]精细定位于22 kb 和44 kb 区域。此外,ZHAO 等[43]通过单一环境和9 个环境分析,分别检测到16 个和4 个QTLs,并将这些QTLs 定位于第4 号染色体上的垩白QTL 簇,检测到的双基因上位性QTL 可解释高达13.00%的表型变异,说明上位性在水稻垩白的遗传控制中起重要作用,且每个QTL 簇对垩白均有显著影响。
首个被克隆垩白基因Chalk5 编码一种液泡H+-焦磷酸转移酶,其高表达破坏了内膜转运系统的pH 稳态,从而对蛋白质体的合成造成胁迫,最终导致胚乳垩白度增加[34]。胚乳粉质基因OsRab5a 编码1 个GTP酶,通过调控胚乳细胞液泡中蛋白质的转运来影响淀粉体的合成从而导致垩白的形成[44]。PDIL1-1 编码1 个类二硫键异构酶PDIL1-1,该基因缺失时干扰了淀粉体的形成,导致淀粉的累积减少而形成垩白[45]。Os-SMK1 编码1 个线粒体的五肽重复蛋白,突变后影响特定位点的胞苷(C)修饰为尿苷(U),表现为胚乳发育异常,最终导致胚垩白质胚乳[46]。WANG 等[47]发现,OsLTPL36 仅在胚乳糊粉细胞和种皮中表达,抑制其表达将导致转基因植株结实率和千粒重下降以及胚乳白垩化。RYO 等[48]通过图位克隆法将SSG4 定位在1 号染色体上的62 kb 区域内,发现SSG4 是一种新型蛋白质,可以促进淀粉颗粒的形成和积累,突变后导致垩白形成。此外,HARMOKO 等[49]对FucT 突变体和WANG等[50]对G1F1 突变体进行功能分析发现,这些突变体会引起淀粉颗粒发育异常且松散,从而表现出明显的垩白和质量下降,且直链淀粉和支链淀粉水平也显著降低。
2 加工品质遗传分析
糙米率、精米率和整精米率是评价水稻加工品质的3 个重要指标,影响稻米产量和商品价值。我国水稻存在整精米率低等问题,对水稻加工品质研究不够深入,因此对其进行遗传改良有待进一步提高。
BAZRKAR-KHATIBANI 等[51]在1、6、9、12 号染色体上检测到6 个控制加工品质QTLs,其贡献率均低于10.18%。QIU 等[52]报道了8 个加工品质主效QTL(qBRR2.2、qBRR3.1、qBRR4.1、qBRR7.1、qMRR2.1、qMRR7.1、qHMRR4.1 和qHMRR6.1) 和8 个微效QTL(qBRR2.1、qMRR1.1、qMRR3.1、qMRR11.1、qHMRR3.1、qHMRR5.1、qHMRR8.1 和qHMRR12.1),这些QTL 仅在一种环境表达。DONG 等[53]检测7 个加工品质QTL(q MHP-1、q MHP-3、q MHP-5、qBRP-9、qBRP-10、q MRP-11 和q MRP-12),其中,qBRP-10 表型贡献率最高,为22.10%。REN 等[54]检测到4 个影响糙米率的QTLs(qBRR-1、qBRR-8、qBRR-9 和qBRR-10),并将qBRR-10 缩小到39.5 kb 区域,确定了2 个候选基因LOC_Os10g32124 和LOC_Os10g32190。综上,稻米加工品质QTL 分布在12 条染色体上,是典型的多基因控制的数量性状。
3 蒸煮与食味品质遗传分析
稻米的蒸煮与食味品质主要是指米饭的香、色、味,人的感官品尝米饭是评价稻米蒸煮与食味品质的传统方法,但是难以对大量的样品进行快速而有效的食味特征鉴定,而且要耗费大量的人力。因此,一般采用AC、GC、GT 和RVA 谱等理化指标来间接衡量稻米的蒸煮与食味品质。这些理化指标都主要受种子效应和母体效应控制,细胞质效应影响较小,而且它们之间的关联性很强[55]。随着分子标记和相关统计分析软件的发展,利用分子标记定位水稻数量性状基因座位的研究不断得到深入,有关稻米蒸煮与食味品质QTL 的研究报道也越来越多[56-70],各不相同,但比较一致的是AC、GC 和大部分RVA 特征值主要由Wx 调控,而GT主要受Alk 控制。此外,SSSI、SSSII-3、SSIII-2、SSSIV-2、SBE3、PUL、ISA、DPE1、AGPlar、AGPiso 等基因也参与调控稻米蒸煮食味品质[71]。
3.1 直链淀粉含量(AC)
AC 是指直链淀粉在精米粉干质量中的比例,由于淀粉和碘会发生颜色反应,所以一般用碘比色法对稻米的直链淀粉含量进行测定。通常,直链淀粉含量在13.0%~18.0%之间的稻米具有适口性好、黏性和膨胀性适中且米饭有光泽,而直链淀粉含量过高的稻米,其米饭的黏性小、膨胀性大、口感较差且光泽度低[72]。
目前,报道了直链淀粉含量的QTLs 广泛分布于水稻的12 条染色体上,其中第6 号染色体上较多,第5和10 号染色体上较少,这些QTLs 的表型贡献率介于2.25%~91.10%之间,主效QTL 达52 个(见表1)。
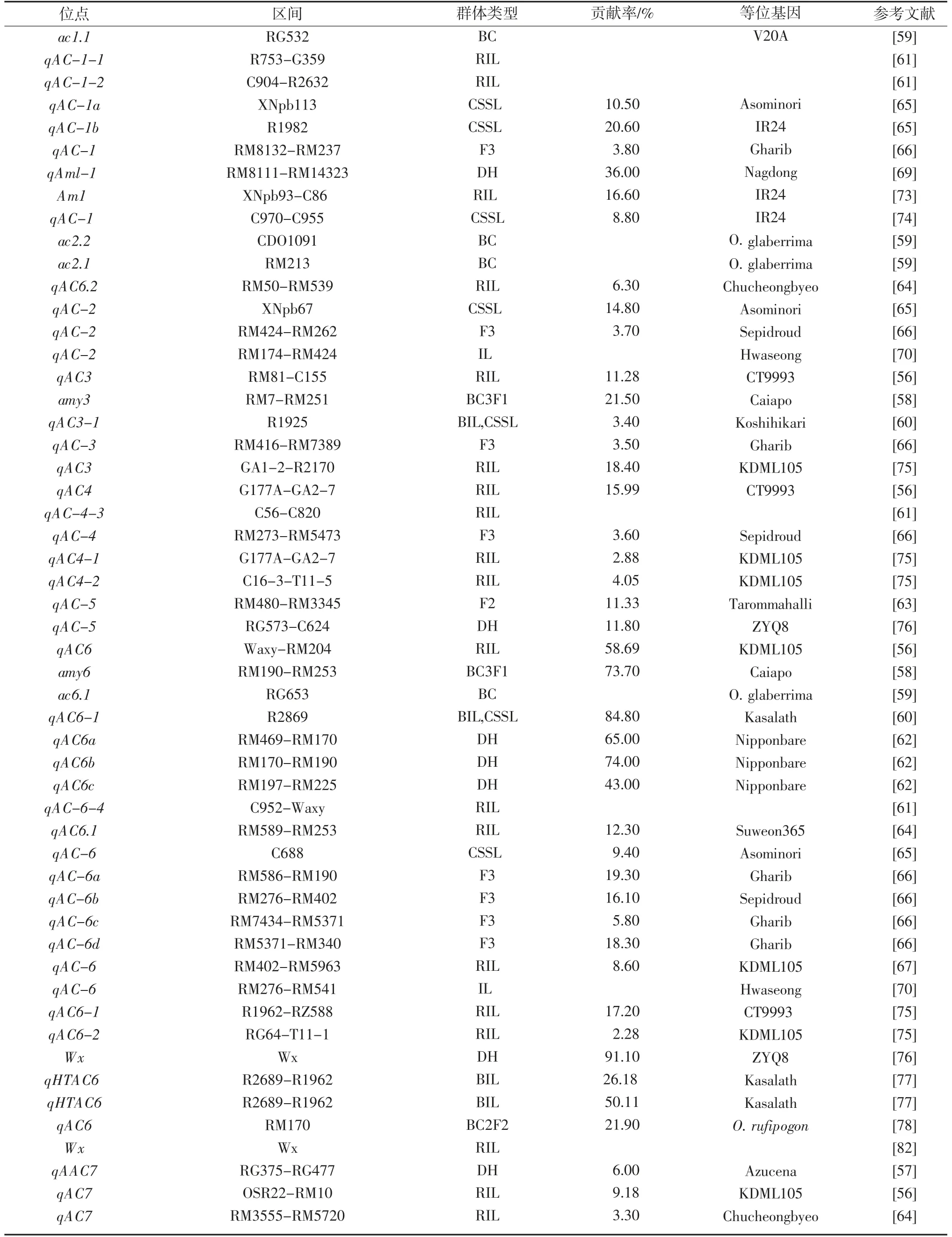
表1 稻米直链淀粉含量QTL 定位

续表1
在水稻的第1 号染色体检测到9 个控制直链淀粉含量的QTL,其中有4 个主效QTL。YUN 等[69]报道的qAml-1 表型贡献率最高,为36.0%;其次是LIU 等[65]报道的qAC-1b,为20.6%;剩下7 个QTL 成簇分布在染色体相近区域[58-59,61,65,73-74]。6 号染色体发现了24 个QTL,其中15 个为主效QTL,表型贡献率高达91.1%,这些QTL 受Wx 基因调控或成簇分布在Wx 基因附近[56,58-60,62,64-65,70,75-78],YACOUBA 等[67]报道的微效QTL qAC-6 与Alk 基因位点重合。7 号染色体发现了2 个主效QTL qAmy-7[68]和Am2[73],表型贡献率分别为33.0%和13.2%;其余4 个为微效QTLs。其中,KWON等[64]检测的微效QTL qAC7 有2 个重要的候选基因——蔗糖合酶3(S3)和海藻糖磷酸酶(Tre),都与蒸煮食味品质有关。BRUNO 等[79]发现的qAC7 的13 个候选基因中,有3 个类似于短链脱氢酶/还原酶片段、4 个短链脱氢酶/还原酶含SDR 结构域蛋白、1 个含醛脱氢酶结构域蛋白、5 个短链脱氢酶/还原酶家族蛋白,这些候选基因都参与次生代谢产物的合成,可能参与淀粉代谢过程,有待进一步分析。8 号染色体报道了10 个主效QTL 和1 个微效QTL[58-59,63-65,67,73-74,80-81],这些QTLs都成簇分布在8 号染色体相近位置。其中,WAN 等[81]报道的qAC-8 与支链淀粉合成酶III(SSSIII)基因区域重叠。SABOURI 等[63]发现的qAC-8a 和qAC-8b 簇同时控制着AC、GT 和GC。LIU 等[65]报道的qAC-8 位点存在异淀粉酶(ISA)。同样地,LI 等[80]报道的qAC-8-2 与ISA 位于同一位点,但SSR 标记检测结果表明qAC-8-2不是ISA,选择2 个显著上调的候选基因Os08g0534900和Os08g0536000 进一步研究,发现这2 个基因分别参与了细胞防御机制和碳水化合物代谢,影响垩白或淀粉代谢的发生。由此可见,8 号染色体上的QTL 簇与SSSII、ISA 之间存在密切的连锁或等位关系,是Wx重要的非等位基因资源。9 号染色体上报道了10 个QTL[65,73-75,77,81],其中,qAC-9a[65]和qAmy-9[68]的表型贡献率较高,分别为26.3%和34.0%。在11 号染色体的6 个QTL[59,65,75]中,LEE[68]等检测到3 个主效QTLs,表型贡献率均高于27.0%,增效等位基因均是Nagdong。其余6条染色体上共检测到11 个主效QTL,表型贡献率在2.25%~21.5%之间[56,58-61,63-65,67-68,70,75-76,79,81-82]。
以上研究发现,稻米直链淀粉含量由主效基因和微效基因协同调控,其中主效基因是水稻蜡质基因(Wx),位于第6 号染色体的短臂上,编码胚乳直链淀粉合成所需的淀粉合成酶I,通过改变前体mRNA 内含子和外显子引起基因的不同等位变异,从而调控直链淀粉含量,同时还调控胶稠度和糊化温度[83-84]。近年来,许多作物育种学者利用基因组定点编辑技术,对Wx 进行定点突变,以获得直链淀粉含量理想的品种,达到培育优质稻的目的。杨平等[72]采用CRISPR/Cas9系统对Wx 进行定点突变,将构建的2 个双靶点CRISPR/Cas9 载体导入中早35,其直链淀粉含量从24.6%降为12.2%。汪秉琨等[85]亦利用CRISPR/Cas9 基因编辑技术把超级稻楚粳27 的直链淀粉含量由17.5%降为1.9%。另外,在水稻Wx 的等位基因和功能位点研究中,已报道Wxa、Wxb、Wxhp、Wxmq、Wxop、Wxmp、Wxin等多个Wx 的等位基因[86-91]。其中,Wxa和Wxb主要存在于非糯稻中,直链淀粉含量较高的籼稻(25.0%以上)主要受Wxa调控,直链淀粉含量较低的粳稻(15.0%~18.0%)主要受Wxb调控[84]。
3.2 RVA 谱
RVA 谱是指淀粉在水中因加热、高温和冷却引起黏度变化而产生的糊化曲线,从曲线中可以直接得到峰值黏度、热浆黏度、冷胶黏度、峰值时间和糊化温度等数据,经过二次演算还可得到消减值、崩解值和回复值等数据。早期研究表明,RVA 谱主要受胚乳遗传效应控制,其次受母体效应和细胞质效应影响[92]。在不同的定位群体中鉴定了超过200 个RVA 谱性状相关的QTL,一些QTL 已被精细定位或克隆(具体见国家水稻数据中心数据http://www.ricedata.cn/)。
在非糯稻中,淀粉粘滞性主要受Wx 基因和微效多基因共同控制,分支酶IIb(BEIIb 或SBE3)基因簇对峰值黏度、热浆黏度、冷胶黏度、崩解值、回复值有影响[93]。而在糯稻中,支链淀粉酶PUL 在控制峰值黏度、热浆黏度、冷胶黏度、崩解值、峰值时间和糊化温度中起主导作用[94];可溶性淀粉合酶IIa(SSIIa)调控热浆黏度、冷胶黏度、崩解值、消减值、峰值时间和糊化温度[95]。
3.3 胶稠度(GC)
经典遗传学认为,GC 遗传主要受种子遗传效应和母体遗传效应调控,同时还受胚乳基因型和细胞质效应以及互作效应影响,存在加性效应和显性效应[96]。
已有研究发现胶GC 的QTLs 主要分布于水稻第1、2、6 和7 号染色体上,其中第6 号染色体上最多,表型贡献率介于4.50%~70.00%,主效QTL 达33 个(表2)。TAN 等[82]发现,GC 主要受Wx 调控,随后几位学者陆续证实了这一观点[56,61-63,67,78,81]。除了Wx 外,LAPITAN等[62]检测到的qGC6a 和qGC6c 位于Wx 区域的上端和下端,有待进一步研究以确定它们是否属于Wx 基因家族或其他基因,在2 号染色体发现的qGC2 似乎与淀粉分枝酶III(SBE)的基因位点一致,还需要进一步研究确定。ZHANG 等[97]报道了主效QTLqGC10 并将其定位在SNP-1 和IND-4 之间约181 kb 的区间内,LOC_Os10g04900 可能是qGC10 的候选基因。其编码1个F-box 结构域蛋白,在胚乳籽粒中表达,这为蒸煮食味品质改良提供了新的遗传资源。

表2 稻米胶稠度QTL 定位
3.4 糊化温度(GT)
GT 是指淀粉粒在热水中开始吸水并发生不可逆膨胀,丧失其双折射性时的临界温度,一般用碱消值来间接评价糊化温度。GT 的高低反映了米饭煮熟的难易程度,一般GT 高的稻米需要更长的时间煮熟。
目前已报道超过50 个控制GT 的QTLs,第6 号染色体上最多,第10 号染色体上最少,表型贡献率高达60.3%[56-57,62-63,66,76,82-83,98-99]。目前一致的观点是糊化温度主要受Alk 或Wx 调控,Alk 编码可溶性淀粉合酶II(SSSII),基因编码区内的碱基替换引起了支链淀粉晶体层结构的改变,从而导致GT 的变化[2,100]。另外,BAO等[57]在6 号染色体长臂末端发现qGT6,该位点还控制消减值和回复值,可能覆盖了编码淀粉分支酶I(SBEI)的基因。
4 营养品质遗传分析
4.1 蛋白质含量
蛋白质含量不仅是评价稻米营养品质的重要指标之一,还影响着稻米的外观、加工和食味品质[3]。高蛋白质含量的米粒结构比较致密,导致米饭较硬、适口性差,进食质量下降。稻米蛋白质含量以母体效应为主,同时受种子直接效应和细胞质效应影响。
近年,在水稻的12 条染色体中共检测到46 个控制蛋白质含量的QTLs,其中第4 号和第9 号染色体上较少,第3 号和第11 号染色体上较多,表型贡献率介于1.18%~53.70%,主效QTL18 个(表3)。在水稻的1号染色体检测到4 个主效QTLs 和3 个微效QTLs,其中qPC1[64]表型贡献率最高,为17.00%,qPC-1a[65]次之,为14.20%。在2 号染色体发现4 个微效QTLs(qGPC2、qPC-2、qPC-2、qPC2),其增效等位基因均来自于父本[65,70,101-102]。在3 号染色体检测到的6 个QTLs 中,qGPC3-1[102]表型贡献率最大,为16.86%,其余5 个QTLs为微效,表型贡献率介于2.50%~9.90%之间[65,102-103],qGPC3-1[102]和qPC-3a[65]分布在染色体相近区段。在4号染色体仅检测到1 个微效QTL qGPC4,表型贡献率为5.61%,增效等位基因是JZ1560[102]。在5 号染色体发现2 个微效QTL(qGPC5[102]和qPC-5[101])和1 个主效QTL qPC-5[103],qPC-5 的表型贡献率为17.53%。在6 号染色体检测到3 个微效QTLs(qPC-6[103]、qPC-6[65]、qPC-6[70])。在7 号染色体仅检测到1 个微效QTL qGPC7[102]和1 个主效QTL qPC7[79],增效等位基因分别是JZ1560 和Cheongcheong,其中,qPC7 是具有重要育种价值的绿色基因,能够同时提高产量和品质[79,102]。在8号染色体检测到4 个QTLs,仅qPC-8a[65]为主效QTL,表型贡献率为53.70%,增效等位基因是IR24。PARK[104]在9 号染色体的34 kb 区段上定位到1 个稳定的主效QTL qPro9,表型贡献率为15.61%。在10 号染色体检测到4 个主效QTLs 和1 个微效QTL,其中QTL qPC10.1[105]的表型贡献率最高,为19.04%,增效等位基因是籼稻昌恢,QTLq GPC10[102]的表型贡献率最低,为5.18%,增效等位基因是HHZ。在11 号染色体检测到6 个蛋白质含量QTL,QTLqPC-11[65]表型贡献率最高,为23.60%,qPC-11[103]、qPC-11[101]和qPC11[70]成簇分布在染色体相近区段。在12 号染色体上检测到4 个蛋白质含量QTLs,其中TGP12[3]在不同环境稳定表达,增效等位基因是Koshihikari,qPC-12[103]表型贡献率最高,为20.04%。
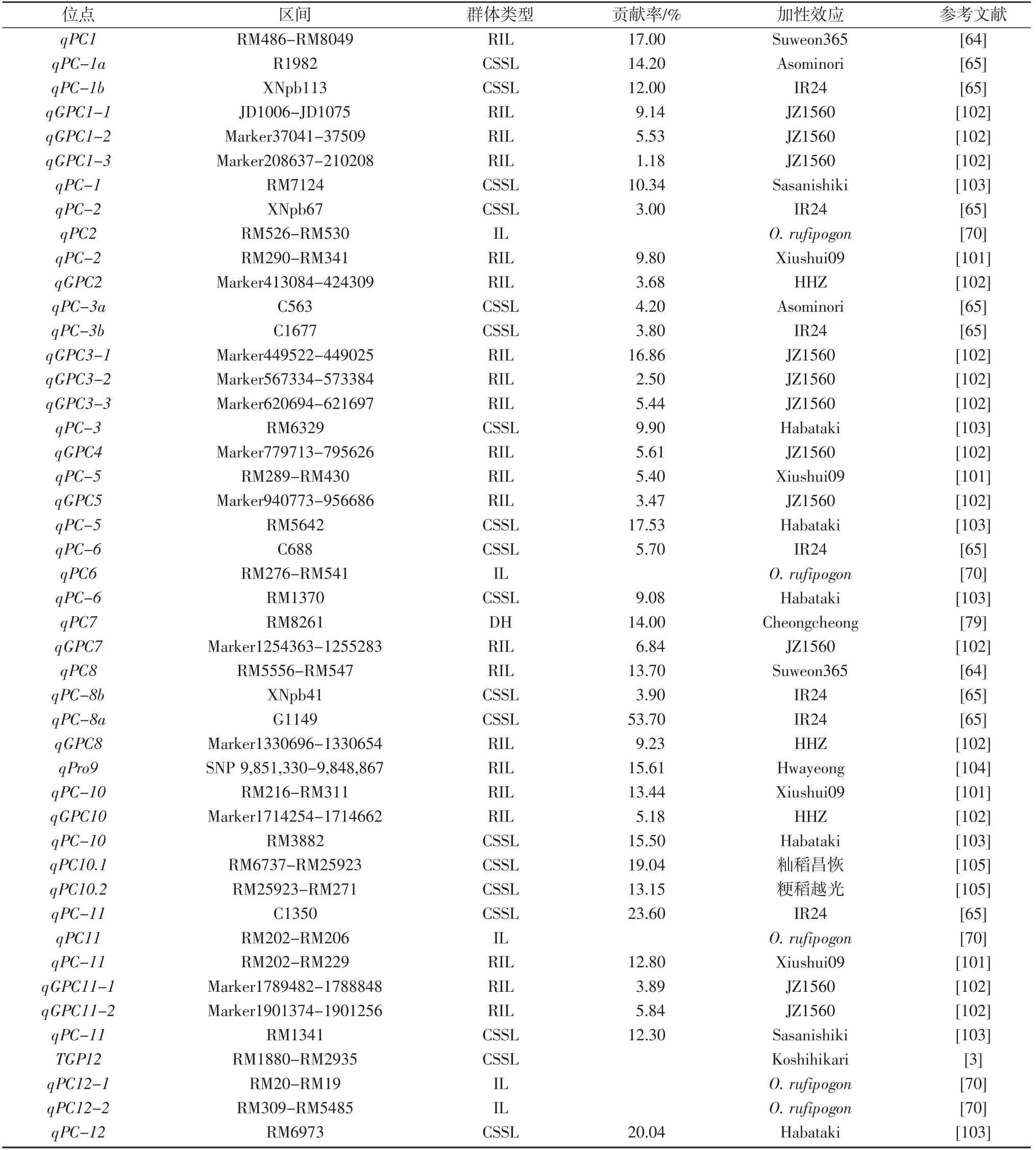
表3 部分稻米蛋白质含量QTL 定位
上述报道的QTLs 表明稻米蛋白质含量遗传机制极其复杂,使用的群体类型、亲本间性状值差异、作图方式、表型分型方法和分子标记不同以及受互作效应的影响,检测到的QTL 丰富,但稳定性不高,易受外界因素的影响。
因此,迄今为止对稻米蛋白质精细定位和相关基因克隆的报道很少。如qPC1[103]定位于1 号染色体长臂的41 kb 区段上,进一步遗传分析发现,qPC1 编码一种氨基酸转运蛋白OsAAP6。OsAAP6 的表达促进稻谷醇溶蛋白、白蛋白、球蛋白、谷蛋白等蛋白和淀粉的合成和积累,有利于多种氨基酸的吸收,从而正向调控蛋白质含量。qGPC-10[106]精细定位于标记RM5758 和RM467 之间的35 kb 区段内。qGPC-10/OsGluA2 位于10 号染色体上,编码一种谷蛋白A2 型前体,通过差异转录表达调节谷蛋白的合成和积累,从而正向调控蛋白质含量。进一步挖掘相关调控基因,探明其遗传和变异机制,利于培育蛋白含量相对较低的水稻新品种,以满足糖尿病患者的需求,同时加速稻米品质改良进程。
5 展望
5.1 强化优质稻米基因发掘在优质水稻选育中的利用
我国水稻育种长期偏重产量提高,稻米品质研究起步较晚,应强化稻米品质遗传基础研究,发掘更多优质稻米等位基因,并开发更多实用的分子标记或基因内的功能标记。QTL 定位是分析稻米品质遗传基础的有效方法,但基于图谱的经典克隆策略非常耗时和麻烦,这是当前育种家所面临的挑战之一。近年来基于SNP 的全基因组关联研究(GWAS)已成为研究水稻品质性状的重要方法,可以高效、快速地鉴定水稻种质中的优良等位基因,在一定程度上加速水稻品质遗传研究进程。
5.2 强化生物育种技术在优质水稻选育中的利用
稻米品质是复杂的数量性状遗传,尽管很多基因功能已阐明,但将相关优良基因用于优质稻米育种方面研究仍比较薄弱。通过基因编辑技术改良稻米品质是一种快捷和高效的方法,将加速稻米品质改良进程。如沈兰等[107]采用CRISPR/Cas9 基因编辑技术获得突变体gs3 和gs3gn1a,其粒长变长、千粒重增加;杨平等[72]编辑水稻Wx 和Badh2,获得了稳定遗传、较低直链淀粉含量且带有香味的突变体;周优等[108]编辑GluA3 基因,成功获得两种低谷蛋白突变体材料。另外,在稻米品质改良过程中会存在相悖之处,比如长粒型米的垩白度、直链淀粉含量和蛋白质含量低,食味品质较好,但加工品质较差;而宽粒型米的垩白度高,但充实度和加工品质较好[23];直链淀粉含量高的品种往往胶稠度和蛋白质含量会降低[34-55]。因此,育种家需根据育种目标协调各品质间的关系,或者在各品质间作出一些选择以满足消费者的不同需求。
5.3 强化保优栽培技术研究及其在优质稻米形成中的应用
此外,稻米品质育种过程中,侧重于对稻米品质进行遗传分析,而稻米品质的形成是遗传和环境相互作用的结果。温度、肥料和光照等环境因素对稻米品质均有影响,如水稻生育期遇高温会导致糙米率、整精米率降低,抽穗期遇高温则会引起垩白度升高;光照时数不够会造成直链淀粉含量增加;增施氮肥在一定程度上可以提升外观和加工品质,但会降低食味品质[109]。因此,需要提升水稻栽培保优管理技术,注重肥水耦合,微量元素肥料合理使用,综合防治病虫害,以提高稻米品质。

