盐和糖含量对食品复合袋中二氨基二苯甲烷迁移的影响
马俊杰,胡长鹰,2,*,王志伟
(1.暨南大学包装工程学院,广东省普通高校产品包装与物流重点实验室,广东 珠海 519070;2.暨南大学理工学院食品科学与工程系,广东 广州 510632)
食品接触材料(food contact materials,FCM)是影响食品安全的重要因素之一,包括各种已经或预期可能与食品接触的材料和制品。这种接触可能会导致化学物质从材料迁移到食品中,这意味着有必要通过直接分析食品或使用标准制定的食品模拟物进行迁移实验以及进一步评判可能导致的食品安全隐患。GB 31604.1—2015《食品接触材料及制品迁移试验通则》[1]规定,10%乙醇溶液或水作为非酸性(pH≥5)水性食品的食品模拟物、4%乙酸溶液作为酸性食品模拟物以及植物油作为油脂类食品模拟物等。值得注意的是,法规中没有设置用于测试高盐和高糖食品的模拟物。然而盐和糖普遍存在一些食品中,它们的存在可能会对FCM中物质迁移产生影响[2]。
初级芳香胺(primary aromatic amines,PAAs)是一类典型的有毒有害物质,近年来受到普遍关注。一些PAAs已被国际癌症研究机构列为“可能对人类致癌”[3]。欧盟FCM最新法修订指令(EU)NO.1245-2020[4]规定一些PAAs迁移量不得检出(检出限(limit of detection,LOD)为2 μg/kg)。食品包装用多层复合材料中聚氨酯黏合剂的使用可能会带来PAAs的迁移,引起食品安全问题[5-7]。由于固化反应不完全而残留在复合材料中的芳香族二异氰酸酯与水反应生成PAAs[8],这一来源的芳香胺种类取决于黏合剂中固化剂类型。甲苯二异氰酸酯(toluene diisocyanate,TDI)与二苯甲烷二异氰酸酯(diphenyl methane diisocyanate,MDI)是常用的两类固化剂主要成分[8]。当遇到水时,TDI型固化剂残留可能产生2,4-二氨基甲苯(2,4-diaminotoluene,2,4-TDA)、2,6-二氨基甲苯(2,6-diaminotoluene,2,6-TDA),MDI型固化剂残留可能会产生4,4’-二氨基二苯甲烷(4,4’-diaminodiphenylmethane,4,4’-MDA)、2,4’-二氨基二苯甲烷(2,4’-diaminodiphenylmethane,2,4’-MDA)、2,2’-二氨基二苯甲烷(2,2’-diaminodiphenylmethane,2,2’-MDA)及其他同分异构体[9]。气相色谱-质谱法和液相色谱-质谱或串联质谱法是常用的PAAs迁移量检测方法[10-14]。GB 31604.52—2021《食品接触材料及制品芳香族伯胺迁移量的测定》[15]采用液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LCMS/MS)定量分析FCM中PAAs迁移量。但仪器价格昂贵,常规的实验室可能不具备仪器条件,此方法的使用受到一定程度的限制。
当食品模拟液中含有不挥发性盐或糖时,直接检测会对质谱造成损伤,因此需进行适当的样品前处理将目标物与盐、糖分离。在食品农残检测领域,固相萃取常用于除去样品基质中的无机盐,但该方法耗材成本高,操作繁琐,同时也可能会影响微量物质的检测精度[16]。盐析、糖析辅助液液萃取已经被广泛用于食品中农残检测、生物医药分析领域[17-21],最近也被应用于FCM中物质迁移研究领域[22]。盐析效应和糖化诱导使水相与有机相的混合溶液发生相分离,降低目标物在水中的溶解度,使目标物从水相转移到有机相[23]。使用盐析、糖析辅助液液萃取分别对含盐、糖的食品模拟物进行样品前处理,可将目标物与盐、糖分离,并且能够有效提取目标物,从而避免对质谱造成损伤。
本实验应用LC-MS建立TDA和MDA及其同分异构体等7 种PAAs迁移量的检测方法,用于快速分析市场上10 种食品包装袋中TDA和MDA迁移量。同时,将盐析和糖析辅助液液萃取方法与LC-MS方法结合,探讨氯化钠和蔗糖对食品复合袋中2,4’-MDA和2,2’-MDA向10%乙醇溶液和水迁移的影响。
1 材料与方法
1.1 材料与试剂
10 种聚酰胺/聚丙烯(polyamide/cast polypropylene,PA/CPP)食品复合蒸煮袋(样品编号:1~10号),分别购自不同厂家。包装袋规格:12 cm×17 cm,热封宽度1 cm。所有包装袋均未印刷,排除油墨中可能存在的PAAs对实验造成干扰。
2,4-TDA(99%)、2,6-TDA,(97%)、4,4’-MDA(>97.6%),2,4’-MDA(>98%)、2,2’-MDA(>95%)、3,3’-二氨基二苯甲烷(3,3’-diaminodiphenylmethane,3,3’-MDA,>98%)、3,4’-二氨基二苯甲烷(3,4’-diaminodiphenylmethan,3,4’-MDA,>98%)标准品 德国Dr.Ehrenstorfer公司;乙腈、甲醇、乙酸、乙醇(均为色谱纯) 上海麦克林生化科技有限公司;蔗糖、氯化钠 天津市大茂化学试剂厂。
1.2 仪器与设备
EC-C18色谱柱(4.6 mm×100 mm,2.7 μm)、InfinityLab LC/MSD单四极杆HPLC-MS(配有电喷雾离子源) 安捷伦科技(中国)有限公司;DHG-9145A电热鼓风干燥箱 上海一恒科学仪器有限公司;FA1604 N电子天平(准确度等级I) 上海菁海仪器有限公司;TPTC超纯水器 湖南力辰仪器科技有限公司;Vortex-Genie2涡旋振荡器 美国Scientific Industries公司。
1.3 方法
1.3.1 色谱条件
色谱柱:EC-C18色谱柱(4.6 mm×100 mm,2.7 μm);柱温36 ℃;进样量10 μL;流速0.6 mL/min;流动相:A为0.1%甲酸溶液(甲酸-水,0.1∶99.9,V/V),B为甲醇溶液;梯度洗脱条件:0~1.0 min,70% A、30% B;1.0~2.0 min,70%~30% A、30%~70% B;2.0~4.0 min,30%~60% A、70%~40% B;4.0~5.0 min,60%~90% A、40%~10% B;5.0~6.0 min,90% A、10% B;6.0~7.0 min,90%~70% A、10%~30% B,7.0~8.0 min,70% A、30% B。
1.3.2 质谱条件
电喷雾电离正离子模式;扫描模式为选择离子模式;正电喷雾电压4500 V;离子传输温度320 ℃;雾化气流速8 L/h;干燥气温度300 ℃,干燥气流速35 L/h。7 种PAAs的质谱参数见表1。

表1 7 种PAAs质谱参数Table 1 Mass spectrometric parameters of seven PAAs
1.3.3 标准溶液的配制
标准储备溶液(1000 mg/L):准确称取7 种PAAs标准品各0.01 g并分别放入10 mL容量瓶中,用甲醇进行稀释定容,得到质量浓度为1000 mg/L的标准储备液,于4 ℃冰箱避光密封保存。
标准中间溶液(10 mg/L):分别吸取100 μL 7 种标准储备液于10 mL容量瓶中,用甲醇进行稀释定容后,即得到质量浓度为10 mg/L的混合标准中间液,中间液于4 ℃冰箱保存。
标准工作溶液:准确吸取100 μL混合标准中间液于10 mL容量瓶中,用4%乙酸溶液、20%乙腈溶液进行稀释定容,得到质量浓度100 μg/L工作溶液。再依次将100 μg/L的混合标准工作溶液依次稀释得到质量浓度为0.5、1.0、2.0、5.0、10.0、20.0、50.0、100.0 μg/L的混合标准工作溶液。
基质匹配标准溶液:根据样品前处理,对水和10%乙醇溶液食品模拟物分别采用优化后的盐析、糖析辅助液液萃取,将上层提取清液与水按照体积比1∶4稀释,得到基质溶液。准确吸取100 μL混合标准中间液于10 mL容量瓶中,使用基质溶液进行稀释定容,得到质量浓度100 μg/L混合标准工作溶液。再分别用4 种基质溶液依次将100 μg/L混合标准工作溶液依次稀释,得到质量浓度为0.5、1.0、2.0、5.0、10.0、20.0、50.0、100.0 μg/L的基质标准工作溶液。
1.3.4 液液萃取含盐、糖食品模拟物中的PAAs
1.3.4.1 盐析辅助液液萃取
将2 mL水和10%乙醇溶液食品模拟物分别转移到含有NaCl(20、30、40 g/100 mL)和2,4’-MDA、2,2’-MDA混标(质量浓度均为50 μg/L)的离心管中。然后均匀混合至氯化钠充分溶解,加入等体积2 mL乙腈,涡旋振动5 min,将小瓶以4000 r/min离心5 min,得到含有目标物的上层乙腈溶液。为减少基质乙腈的溶剂效应,将上层提取溶液取出并超纯水稀释5 倍,最终获得20%乙腈溶液。每组3 个平行,同时做空白对照。将等分试样通过PTFE 0.22 μm针式过滤器过滤,并在LC-MS系统上注入10 μL。共研究了辅助萃取剂含量、涡旋时间并进行评估,以优化目标物的提取效率。
1.3.4.2 糖析辅助液液萃取
当蔗糖质量浓度至40 g/100 mL时,食品模拟物(水、10%乙醇溶液)和乙腈等体积(2 mL)混合溶液出现相分离。考察40、50、60、70 g/100 mL蔗糖的萃取效率。同1.3.4.1节盐析辅助同样操作步骤。
1.3.5 样品分析
酸性食品模拟物被认为是PAAs迁移的最恶劣情况,因此选择4%乙酸溶液作为迁移实验的食品模拟物,以了解样品中TDA和MDA迁移情况。根据GB 23296.1—2009《食品接触材料 塑料中受限物质 塑料中物质向食品及食品模拟物特定迁移试验和含量测定方法以及食品模拟物暴露条件选择的指南》[24],按照2 dm2食品接触面积比100 mL食品模拟物,将10 种食品复合袋统一制成10 cm×10 cm大小的食品复合袋,倒入100 mL 4%乙酸食品模拟物,使用热封机封口。由于所有样品均可用作高温蒸煮袋在高温下使用,考虑到消费者可能会使用蒸、煮等方式对包装内的食物进行复热,因此选择100 ℃,2 h的条件组合进行迁移实验。迁移实验完成后,待样品袋冷却至室温,用注射器抽取1 mL模拟液过0.22 μm有机滤膜后装入进样瓶,存放在4 ℃冰箱中待测,每组3 个平行,同时做空白对照。
1.3.6 水性食品模拟物中盐和糖对PAAs迁移的影响
对于盐和糖对PAAs迁移影响研究,选择氯化钠和蔗糖分别作为食品中盐和糖的替代物加入到食品模拟物(水、10%乙醇溶液)中,测试6 种不同质量浓度的氯化钠和蔗糖,0、2、5、10、15、20 g/100 mL。根据样品分析结果,选择10号样品用于实验。将100 mL含盐、糖食品模拟物装入2 dm2(10 cm×10 cm)的食品复合袋中,进行60 ℃、10 d的迁移实验,以模拟长期贮存期间PAAs的迁移情况。迁移实验完成后,待样品袋冷却至室温,按照最终萃取方案,分别对含不同质量浓度的盐、糖食品模拟液进行液液萃取。每组3 个平行,同时做空白对照。
1.4 数据处理与统计分析
利用Chemstation工作站进行数据分析,用Excel和Origin 9.0软件对数据结果进行统计分析和作图,SPSS 26.0软件对结果进行显著性分析(P<0.05)。
2 结果与分析
2.1 流动相选择
以EC-C18为色谱柱,考察不同流动相对7 种PAAs混合标准品的影响。相关研究表明,PAAs在甲醇中的信号响应优于乙腈。因此选择甲醇作为分离物质的流动相,在此基础上分别比较甲醇、0.1%甲酸溶液、水和它们不同比例混合物的响应。结果表明,甲醇-甲酸水体系对PAAs的离子化、色谱峰、信号响应均优于甲醇-水体系、以流动相A为体积分数0.1%甲酸溶液,流动相B为甲醇溶液,进一步优化洗脱梯度。7 种PAAs标准溶液的色谱图见图1。

图1 LC-MS检测7 种PAAs总离子流图(10 μg/L)Fig.1 LC-MS Total ion current chromatograms of seven PAAs (10 μg/L)
2.2 液液萃取条件优化
2.2.1 辅助萃取剂选择
考虑到本实验待测的食品模拟液中已含有不同质量浓度的氯化钠或蔗糖,且氯化钠和蔗糖均能在合适的萃取溶剂下触发水相和有机相混合液的相分离[23],因此对含盐模拟液和含糖模拟液萃取时,分别使用氯化钠和蔗糖作为辅助萃取剂,作为触发相分离的物质。
2.2.2 萃取溶剂
将等体积(2 mL)甲醇加入分别含20 g/100 mL氯化钠和蔗糖的水中,混合溶液未能发生分层。异丙醇、乙腈和乙醇是盐析萃取中使用最广泛的3 种溶剂,它们在各种比例下都可与水混溶[25]。相关研究表明,使用等体积的水和上述3 种溶剂进行盐析萃取,异丙醇和乙醇的结果非常相似,氯化钠不能够促使两相的分离,且大多使用醇-水混合物进行相分离的实验都导致上层相具有较高的水含量,这不利于目标物与氯化钠的分离。另一方面,乙腈也是本研究检测方法中的流动相,具有较好的色谱分离效果,避免目标物的峰形失真[25-26],因此选择乙腈作为萃取溶剂。考察乙腈与食品模拟液不同体积比(1∶2、1∶1和2∶1)的萃取效果,1∶1的萃取效果最好。确定最终萃取溶剂与食品模拟液体积比为1∶1。
2.2.3 辅助萃取剂含量
图2显示了辅助萃取剂(氯化钠、蔗糖)的不同质量浓度对目标物的萃取效率。在等体积(2 mL)的乙腈和水、乙腈和10%乙醇溶液的混合溶液的加标溶液中,分别加入不同质量浓度的氯化钠(20、30、40 g/100 mL)和蔗糖(40、50、60、70 g/100 mL),根据萃取效率优化选择萃取剂的最佳质量浓度。随着氯化钠质量浓度的增加,2 种MDA回收率并未发生显著变化(P>0.05),因此选择20 g/100 mL的氯化钠作为合适的质量浓度,在此条件下2,4’-MDA和2,2’-MDA在10%乙醇溶液中回收率分别为95.6%、94.2%,在水中的回收率分别为105.9%、104.1%。


图2 辅助萃取剂不同质量浓度下2,4’-MDA和2,2’-MDA的回收率Fig.2 Recoveries of 2,4’-MDA and 2,2’-MDA at different auxiliary extractant concentrations
随着蔗糖质量浓度的增加,两目标物的回收率均显著升高(P<0.05)。当质量浓度为70 g/100 mL时,两物质的回收率均达到最大,在10%乙醇溶液中回收率分别为92.6%、90.1%,在水中回收率分别为103.4%、104.7%。最终选择质量浓度70 g/100 mL蔗糖。
2.2.4 萃取时间
选择涡旋是为了增强乙腈与水之间的接触,涡旋时间影响目标物的回收率[26]。研究1、2、5、8、10 min五个涡旋时间,选择20 g/100 mL氯化钠溶液根据1.3.4.1节进行实验。如图3所示,随着涡旋时间的延长,两物质回收率先增加后降低,在5 min时观察到2,4’-MDA和2,2’-MDA的回收率均达到最高,分别为104.3%、103.4%。最终涡旋时间为5 min。

图3 不同涡旋时间下2,4’-MDA和2,2’-MDA的回收率Fig.3 Recoveries of 2,4’-MDA and 2,2’-MDA at different vortex times
2.3 LOD、线性范围及线性方程
分别以不含目标物质的4%乙酸食品模拟物和20%乙腈溶液作为样品空白,配制7 种PAAs混合标准工作溶液。以定量离子峰面积(y)为纵坐标,对应的质量浓度(x,μg/L)为横坐标,绘制标准曲线,外标法定量。以信噪比不小于3计算LOD,以信噪比不小于10计算定量限(limit of quantitation,LOQ),所有物质的LOQ均低于2 μg/L,满足欧盟对PAAs的检测要求。表2结果显示,PAAs的定量离子峰面积与其质量浓度在一定范围内呈良好的线性关系,相关系数(R2)均不低于0.991。
选取经检测不含7 种PAAs的空白样品,装入用4%乙酸溶液分别配制成2、10、50 μg/L 3 个质量浓度的7 种PAAs的加标溶液,进行迁移实验。每个质量浓度做6 个平行实验,计算加标回收率和精密度。由表2可知,3 个加标水平下的回收率为76.7%~95.7%,相对标准偏差(relative standard deviation,RSD)(n=6)为1.0%~6.5%,满足分析方法相关要求。

表2 7 种PAAs的LOD、线性范围及线性方程Table 2 Detection limits,linear ranges and linear equations of seven PAAs
2.4 基质效应
分别配制基质溶液标准曲线和食品模拟物溶剂标准曲线,通过斜率比较法评估基质效应[2]。
结果显示,2,4’-MDA和2,2’-MDA在4 种基质溶液中的基质效应较弱(η值在-0.71~9.87之间),基质效应可忽略不计,实验中氯化钠、蔗糖实验均采用20%乙腈溶液配制的标准曲线定量目标物。
2.5 样品分析结果
应用方法检测市场上10 种食品复合袋中PAAs的迁移量,迁移结果见表3。由于样品用途广泛,无法估计包装袋的实际接触面积(S)与食品或食品模拟物的体积(V)的比率(S/V)。根据GB 31604.1—2015,所有测得含量均按照每1 kg食品模拟物接触6 dm2的包装材料比率进行校正。所有食品模拟物的相对密度按惯例假定为1。
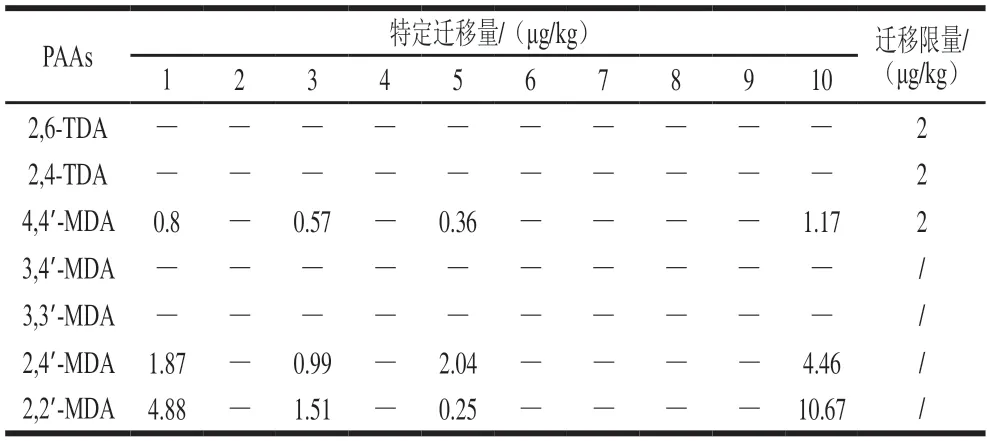
表3 10 种食品复合袋中PAAs在4%乙酸中的迁移量(100℃,2 h)Table 3 Migration of PAAs from laminated food packaging bags to 4%acetic acid (100℃,2 h)
欧盟法规规定4,4’-MDA特定迁移限量不超过2 μg/kg(在食品模拟液中)、总PAAs迁移量不超过10 μg/kg。在检测的10 种样品中,1、3、5、10号的食品模拟液中检测到4,4’-MDA、2,4’-MDA和2,2’-MDA。其中,10号样品中MDA总迁移量为16.3 μg/kg,超出总迁移限量。由于2,4’-MDA和2,2’-MDA迁移量相对较高,作为后续盐、糖含量对PAAs迁移影响的研究对象。
2.6 氯化钠、蔗糖对2 种MDA向10%乙醇溶液和水中迁移的影响
由聚酰胺/聚丙烯组成的多层复合包装袋常用于包装新鲜肉类、蒸煮食品。根据实际食品(例如肉类、饮料、液体酱汁)中的盐糖含量选择测试范围。食品中氯化钠质量浓度最高可达15 g/100 mL,例如咸鳕鱼被发现含有15 g/100 mL的氯化钠[2]。蔗糖组分在大部分含糖食品中含量高于其他单体糖成分,液态食品如饮料中糖类物质质量浓度在1.75~21.45 g/100 mL范围内[27]。
如图4A、B所示,在60 ℃、10 d迁移实验后,2,4’-MDA和2,2’-MDA在10%乙醇溶液和水中的迁移量随着氯化钠质量浓度的增加显著减少(P<0.05)。与不含氯化钠的食品模拟物相比,氯化钠质量浓度20 g/100 mL时2,4’-MDA和2,2’-MDA向10%乙醇溶液中迁移量分别下降了31%和64%,向水中迁移量分别下降了39%和59%,而且无论是在10%乙醇溶液还是水中,2,2’-MDA比2,4’-MDA迁移量下降更多,表明2,2’-MDA迁移量更易受到氯化钠的影响。可见氯化钠对不同物质迁移影响有差异。如图4C、D所示,当蔗糖质量浓度大于15 g/100 mL时,两物质在10%乙醇溶液和水中的迁移量均发生显著下降(P<0.05)。课题组前期研究[28]发现4,4’-MDA的迁移量随着蔗糖质量浓度的升高而降低,与本实验结果一致。


图4 2,4’-MDA和2,2’-MDA在不同盐(A、B)、糖(C、D)含量的食品模拟物中的迁移量(60℃,10 d)Fig.4 Migration levels of 2,4’-MDA and 2,2’-MDA into food simulants with different salt and sucrose contents
与其他的FCM添加剂迁移行为不同,2,4’-MDA和2,2’-MDA分别是复合材料中残留的2,4’-MDI和2,2’-MDI迁移到食品模拟液中与水的反应产物[8],属于非有意添加物(non-intentional added substances,NIAS)。盐能够对非电解质物质的溶解度产生影响[29]。当氯化钠加入水或10%乙醇溶液中时,电离出氯离子和钠离子,通过分子间作用力和静电作用结合水分子形成不稳定水合氯离子和水合钠离子[30]。蔗糖加入水中后,与水分子通过氢键结合[23]。有研究表明,蔗糖的存在同样会对物质的溶解度产生影响[31]。当盐、糖加入食品模拟物后,一定程度上改变了食品模拟物原有的溶液性质。一方面降低了MDI在水中的溶解度,不利于MDI向食品模拟物中的迁移。另一方面,离子或蔗糖分子与水的结合减少了可参与反应的自由水分子,一定程度上抑制了MDI与水的反应。最终导致MDAs迁移量减少。
水性食品模拟物中盐、糖的存在会对2 种MDAs迁移量产生显著影响,氯化钠和蔗糖的存在降低了物质的迁移量。但Tsochatzis等[2]发现,在所有迁移测试条件下,己内酰胺从聚酰胺/聚乙烯复合膜向10%乙醇溶液中的迁移量随着氯化钠质量浓度的增加(2、5、10、15 g/100 mL)显著增加(P<0.05)。因此,应该重视盐、糖含量可能对FCM中小分子物质迁移产生的影响,包括对产生NIAS的过程影响从而对NIAS迁移量的影响。我国食品安全国家标准和欧盟法规(EU) No.10/2011号条例均没有设置含高盐、高糖类型的食品模拟物。建议在将来可以增设盐糖类型的食品模拟物或修正现有的FCM迁移实验中的食品模拟物。此外,目前关于迁移过程中食物/食品模拟物的盐、糖含量对迁移物质的影响研究尚少,还需要进一步深入研究。
3 结论
通过LC-MS建立一种快速检测TDA和MDA的方法,能够用于检测复合食品包装材料中7 种PAAs的迁移量。分析市场上10 种复合包装袋中PAAs迁移量,发现4,4’-MDA、2,4’-MDA和2,2’-MDA是主要迁移物质。
将盐析、糖析辅助液液萃取与LC-MS结合,探讨氯化钠和蔗糖对食品复合袋中2,4’-MDA和2,2’-MDA向10%乙醇溶液和水迁移的影响。盐析辅助液液萃取降低了无机盐对MS系统的潜在危害,同时它比传统的液体萃取更快,溶剂使用量也更低,比固相萃取和其他样品制备技术更具成本效益[16]。
研究了水性食品模拟物中盐、糖含量对食品复合袋中2,4’-MDA和2,2’-MDA迁移的影响。测试了在60 ℃、10 d迁移条件下,2,4’-MDA和2,2’-MDA向不同盐、糖含量的水性食品模拟物(10%乙醇、水)中的迁移水平。结果表明,盐和糖的存在对MDAs的迁移产生显著影响:盐和糖的存在降低了2 种MDA的迁移量。尽管这里的研究表明对MDAs安全评价没有影响,但是盐、糖对化学物质的迁移会产生影响,甚至可能促进某些小分子物质的迁移。说明对用于高盐、糖含量食品的包装迁移测试时,可能需要调整食品模拟物。

