诺邓火腿红色素的分离纯化及结构鉴定
杨子江,张丽红,廖国周,田 梅,吕东霖,何 颖,葛长荣,王桂瑛,
(1.云南农业大学食品科学技术学院,云南 昆明 650201;2.云南农业大学 云南省畜产品加工工程技术研究中心,云南 昆明 650201)
诺邓火腿产于云南省大理州云龙县诺邓古村,是我国的传统美食之一,其以当地散养的诺邓黑猪为原料,采用独特的诺邓井盐腌制,经过复杂的加工工序腌制发酵成熟,具有独特的风味和质地,与宣威火腿、鹤庆圆腿并称为云南三大著名火腿[1-2]。发酵成熟的诺邓火腿醇厚馨香,切口新鲜嫩红,口感纯正,深受消费者的喜爱[3]。
肌肉颜色是评价干腌火腿食用品质的重要指标之一,也是消费者对于干腌火腿可接受性的最直观指标,影响干腌火腿的可销售性[4-5]。因此,在加工和贮藏过程中如何保持干腌火腿良好的色泽状态一直是研究热点[6]。干腌火腿的色泽主要由肌红蛋白(myoglobin,Mb)和血红蛋白(hemoglobin,Hb)的含量决定,特别是Mb的化学形式和含量[7]。硝盐(亚硝酸盐和硝酸盐)是国家认可并允许在肉制品中使用的一种食品添加剂,人们常常将其应用于干腌火腿的加工过程中以促进其发色[8-9]。Skibsted[10]报道,在加硝干腌火腿中,其红色色泽的主要化学成分为亚硝基肌红蛋白(nitroso myoglobin,NOMb)。然而,残留在干腌火腿中的亚硝酸盐在一定条件下会与仲胺反应生成亚硝胺,容易致畸致癌,这引起了人们的广泛关注[11-12]。因此,国外的著名火腿,如帕尔玛塞拉诺和伊比利亚火腿等在腌制过程中都不添加硝盐,但仍然表现出诱人的鲜红色[13]。Parolari等[14]研究发现,无硝帕尔玛火腿红色素的紫外-可见光光谱显著不同于加硝干腌火腿。Wakamatsu等[15]提取纯化帕尔玛火腿红色素,通过荧光光谱、高相液相色谱和质谱检测,结果证实无硝帕尔玛火腿中红色素的主要化学成分为Zn-原卟啉IX(Zn protoporphyrin IX,ZnPP)。后续研究发现无硝伊比利亚火腿红色素的主要化学成分也为ZnPP,由此推断,在无硝干腌火腿中,红色色泽的主要贡献者为ZnPP[16]。
目前国内生产干腌火腿也不添加硝盐,但有关国内无硝干腌火腿红色色泽的主要化学成分还鲜见报道。干腌火腿的色泽受到其独特的加工方式、加工时间、原料猪品种、添加剂和微生物等多种因素的影响[17]。根据产地气候条件和文化传统不同,各干腌火腿的加工工艺略有差异[18]。Bou等[19]报道,干腌火腿的加工工艺和选取的原料肉可能对红色素的形成产生影响。Stanišić等[20]以不同原料猪种为研究对象,发现在不同猪种中,其肌红蛋白的各化学形态有所不同。李享等[21]以三元猪肉和长白山黑猪肉为原料肉,加工广式腊肠,结果表明腊肠瘦肉部分的红度值(a*)受原料肉来源的影响。Liu Hui等[22]报道,在肉制品中添加NaCl会对肌红蛋白的构象产生影响。Liu Hui等[23]也研究报道,不同的NaCl处理会导致肌红蛋白中血红素的结构发生变化。国内生产的干腌火腿与国外相比,所采用的加工工艺、原料猪品种和NaCl添加量等都有所差异,因此有必要鉴定国内无硝干腌火腿中红色素的化学本质。基于此,本研究旨在通过紫外-可见光光谱(ultraviolet spectroscopy,UVVis)、荧光光谱、超高效液相色谱-串联质谱(ultrahigh performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)及傅里叶变换红外光谱(Fourier transform infrared,FTIR)和核磁共振(nuclear magnetic resonance,NMR)分析诺邓火腿红色素的主要化学结构特征,阐明诺邓火腿中红色素的化学本质,以期为诺邓火腿的色泽调控提供理论依据。
1 材料与方法
1.1 材料与试剂
选用3 头同批次饲养、日龄相同、体质量相近的诺邓黑猪,屠宰后取6 条后腿,按照诺邓当地传统加工工艺(鲜腿的选择、修整、去血水、喷酒、上盐、抹盐泥、腌制和上挂发酵8 道工序)在云南省瑞通牧业科技开发有限公司进行加工,腌制发酵时间为2018年10月—2020年10月。
ZnPP 美国Enzo公司;原卟啉IX 上海源叶生物科技有限公司;其他化学药品和试剂均为分析纯。
1.2 仪器与设备
XHF-D型高速分散器 宁波新芝生物科技股份有限公司;固相萃取仪 天津市富城达科技有限公司;Classic C18型固相萃取小柱(1000 mg/6 mL) 德国西蒙-奥德里奇生物与化学制品有限公司;UV-1800双光束紫外分光光度计 日本岛津公司;Synergy H1型全波长荧光酶标仪 美国伯腾仪器有限公司;Vanquish Q Exactive HFX LC-MS 美国赛默飞世尔科技公司;ALPHA型红外光谱仪、Avance NEO 600 MHz超导核磁共振波谱仪 德国Bruker公司。
1.3 方法
1.3.1 样品预处理
诺邓火腿经洗霉、修割后,取下股二头肌部分,去除肉眼可见的脂肪和结缔组织,放入斩拌机搅碎,将斩拌后的肉糜样品真空包装,放入-80 ℃冰箱保存备用,实验前将样品置于4 ℃缓慢解冻,样品进行3 次重复分析测定。
1.3.2 邓火腿红色素的提取
称取5.00 g绞碎火腿肉糜样品于50 mL离心管中,加入25 mL 75%丙酮溶液,将离心管浸入冰中,使用高速分散器以10000 r/min高速匀浆30 s,在冰浴条件下,静置提取20 min,整个提取过程在避光条件下进行。然后以4 ℃、10000 r/min离心5 min,所得上清液通过滤纸过滤并收集到避光离心管中,样品残渣再加入25 mL 75%丙酮溶液重复上述步骤提取1 次,合并2 次提取所得上清液并摇匀。
1.3.3 诺邓火腿红色素的分离纯化
使用微固相萃取装置对75%丙酮溶液提取所得的红色素粗提液进行纯化。将粗提液用蒸馏水1∶1(V/V)稀释,随后转移到一次性C18柱上进行纯化,先依次加入10 mL甲醇和10 mL蒸馏水预洗活化C18固相萃取小柱,然后使待净化液以1 mL/min的速率过柱,待样品溶液流尽后,再加入15 mL蒸馏水洗涤柱子,最后用10 mL 75%丙酮溶液洗脱截留在C18固相萃取小柱上的红色物质,收集纯化洗脱液。
1.3.4 诺邓火腿红色素的UV-Vis测定
纯化红色素提取液通过UV-1800双光束紫外分光光度计检测。以75%丙酮溶液作为参比溶液,扫描速率为中速,扫描间隔为0.2 nm,在190~900 nm的波长范围内进行全波段扫描,确定红色素的特征吸收峰。再向纯化所得红色素提取液中添加1%的HCl溶液(HCl∶溶液红色素提取液,V/V,下同),重复上述操作记录紫外吸收光谱。
1.3.5 诺邓火腿红色素的荧光光谱测定
移取纯化后的红色素提取液200 μL,加样到96 微孔板上,以75%丙酮溶液作为空白,使用Synergy H1型全波长荧光酶标仪记录红色素的荧光发射光谱。激发波长420 nm,扫描间隔1 nm,温度20 ℃,记录500~700 nm波长范围内的荧光发射光谱。再向纯化所得红色素提取液中添加不同比例(0.5%、0.7%、1%)的HCl溶液,重复上述操作记录荧光发射光谱。
为了衡量算法的检测精度,定义均方根误差(Root Mean Square Error,RMSE),其数学表达式如下:
1.3.6 诺邓火腿红色素的UPLC-MS/MS测定
1.3.6.1 样品前处理
取1 mL红色素纯化样品,去除丙酮后进行冷冻干燥,向冻干样中加入400 μL 80%甲醇溶液,涡旋30 s混匀,4 ℃冰浴超声30 min,-40 ℃静置1 h,然后4 ℃静置0.5 h,于4 ℃、12000 r/min离心15 min。最后移取200 μL上清液,加入内标(0.14 mg/mL二氯苯丙氨酸)5 μL,转入进样小瓶中待检测。
1.3.6.2 UPLC-MS/MS分析
基于UPLC-MS/MS分析平台(Waters,UPLC;Thermo,Q Exactive),通过ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm)液相色谱柱对目标化合物进行色谱分离。柱温40 ℃;流动相:A为水+0.05%甲酸,B为乙腈;流速0.3 mL/min;进样量6 μL;自动进样器温度4 ℃。流动相梯度洗脱程序见表1。

表1 流动相洗脱程序Table 1 Mobile phase composition for gradient elution
质谱检测参数:正模式:加热器温度300 ℃;鞘气流速45 arb;辅助气流速15 arb;尾气流速1 arb;电喷雾电压3.0 kV;毛细管温度350 ℃;S-Lens RF Level,30%。负模式:加热器温度300 ℃;鞘气流速45 arb;辅助气流速15 arb;尾气流速1 arb;电喷雾电压3.2 kV;毛细管温度350 ℃;S-Lens RF Level,60%。扫描模式:一级全扫描(m/z70~1050)与数据依赖性二级质谱扫描(dd-MS2,TopN=10);分辨率:70000(一级质谱);17500(二级质谱)。碰撞模式:高能量碰撞解离。
1.3.7 诺邓火腿红色素的FTIR测定
1.3.8 诺邓火腿红色素的NMR测定
使用Bruker AV-600型超导核磁共振波谱仪,配备5 mm反向几何1H/13C探头进行检测。将红色素样品(20 mg)溶于0.5 mL氘代DMSO试剂中,使用超声溶解,高分辨率1H-NMR和13C-NMR分别在600 MHz和150 MHz下被记录,工作温度为25 ℃。以1H的内部DMSO-D6信号(δH=2.09)和13C的内部DMSO-D6信号(δC=30.89)为参考。
1.4 数据统计与图表绘制
采用Origin 2019和Mestre Nova 11.0.0软件分析数据及作图。
2 结果与分析
2.1 诺邓火腿红色素的UV-Vis光谱分析
如图1所示,诺邓火腿红色素在Soret带附近有一个强吸收峰(416 nm),在可见光区(Q带)有两个吸收峰(546 nm和584 nm),并且Q带的两个吸收峰具有高度对称性。与75%丙酮溶液中的ZnPP标准品吸收光谱(416、547、585 nm)比对后,二者的吸收峰高度相似,此研究结果与Wakamatsu等[15]报道相似。用75%丙酮溶液提取的帕尔玛火腿红色素,在417 nm处有最大吸收峰,546 nm和584 nm处有两个对称吸收峰。将诺邓火腿红色素提取液用1% HCl溶液处理后,相比于75%丙酮溶液提取的火腿红色素,酸处理后的火腿红色素在Soret带的吸收峰发生蓝移,在396 nm附近处有最大吸收峰,并且Q带的吸收峰由高度对称的两个峰变为不对称的4 个峰(498、538、579、624 nm)。Q带的4 个吸收峰是卟啉配体的特征紫外-可见吸收峰,并且4 个峰的相对强度随着波长的增加而逐渐减弱[24-25]。强酸处理会导致金属离子从卟啉环中解离出来,当金属离子脱离后,使卟啉分子的不对称性提高,表现为Q带吸收峰的个数增加,Soret带发生位移,这是卟啉配合物脱除金属离子的光谱特征[26]。与酸化丙酮溶液中原卟啉IX(protoporphyrin IX,PPIX)标准品的吸收光谱(394、490、525、561、617 nm)比对,发现其吸收峰高度相似,都有1 个大吸收峰和4 个小吸收峰,但相对于标准品,酸处理后的火腿红色素吸收峰整体发生了红移,这可能是由于添加的酸含量不足以使所有金属卟啉都脱去金属离子变为卟啉配体(PPIX)[27]。
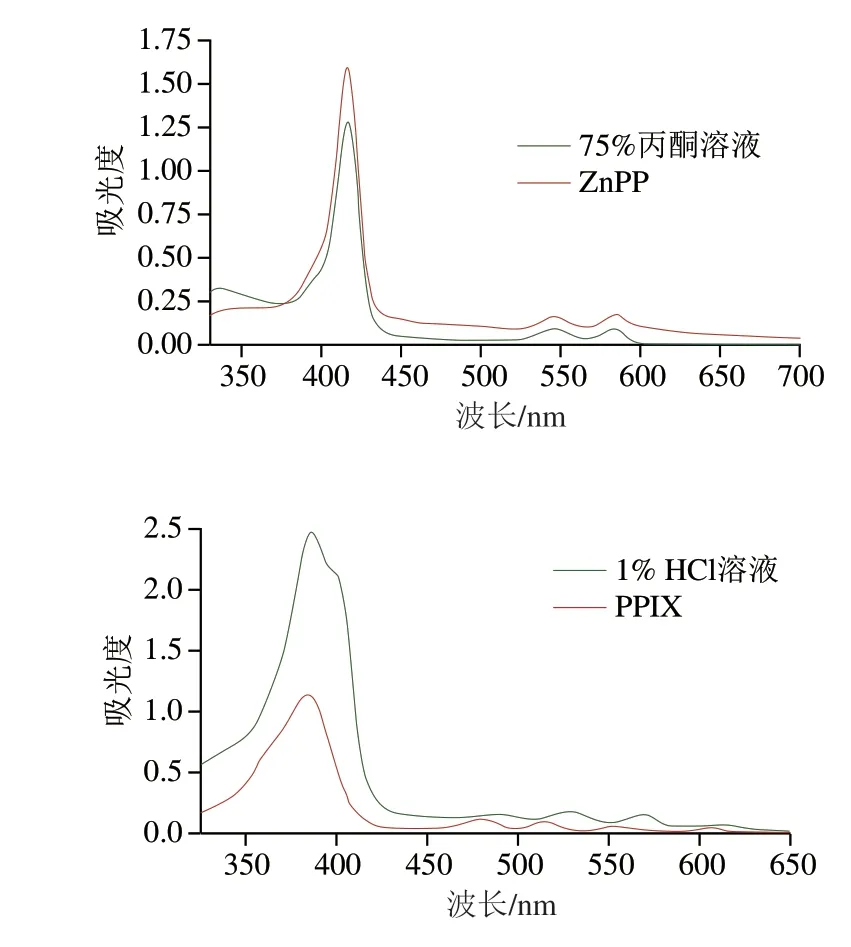
图1 诺邓火腿红色素的UV-Vis光谱图Fig.1 UV-Vis spectra of red pigment in Nuodeng dry-cured ham
2.2 诺邓火腿红色素的荧光光谱分析
荧光是一种光致发光的冷发光现象,激发的荧光波长与物质的内部组织结构相关,从而可以对如卟啉类化合物等的不同荧光物质进行快速有效地鉴别[28-29]。如图2A所示,75%丙酮溶液中诺邓火腿红色素的荧光光谱图,以420 nm波长激发,在590 nm处有一个强荧光发射峰,644 nm处有一个弱荧光发射峰,这两个荧光峰是ZnPP的特征荧光发射峰,与75%丙酮溶液中的ZnPP标准品荧光发射峰高度重合(590、644 nm)。这与Møller等[30]的研究报道相似。Bou等[31]也报道,ZnPP在590 nm的发射波长下有最强荧光发射峰,与本研究结果相同。卟啉本身也会发出强烈的红色荧光,其荧光发射峰如图2B所示。卟啉与金属配位后(比如锌离子),仍然会发射强烈荧光,但与部分金属离子配位(比如铁离子),其荧光发射峰会减弱,甚至荧光消失,有研究认为铁卟啉是非荧光活性的,也有研究认为铁卟啉可以发射597 nm的荧光[15,32]。但铁卟啉的荧光现象显著不同于本研究所得到的结果,表明该红色素化合物的结构不是铁卟啉。当添加不同比例的HCl溶液处理后,红色素提取液的荧光光谱发生显著变化。随着HCl溶液比例的增加,590 nm处荧光发射峰的荧光强度逐渐降低,644 nm处荧光发射峰向短波长方向移动并且荧光强度逐渐减低,这是由于强酸的处理使得金属离子不断从卟啉环中解离出来,从而导致荧光发射峰发生变化。当添加1% HCl溶液时,其在590 nm处的荧光发射峰消失,在633 nm处有单一荧光发射峰,与PPIX标准品的荧光发射峰相似。Parolari等[33]报道,可以用激发波长400 nm,发射波长630 nm处的荧光强度定量PPIX的含量,本研究得到的PPIX最大荧光发射波长在633 nm,稍有偏差,可能是由仪器误差造成。

图2 诺邓火腿红色素的荧光光谱图Fig.2 Fluorescence spectra of red pigment in Nuodeng dry-cured ham
2.3 诺邓火腿红色素的UPLC-MS/MS鉴定
采用Compound discoverer软件对UPLC-MS/MS检测数据进行提取分析,通过高分辨质谱数据信息推导可能的分子式,利用主要碎片离子信息在数据库中检索匹配,并搜索公共数据库Metlin及HMDB进行补充。如表2所示,在正、负离子模式下(一级质谱)均检测出ZnPP的存在。在正离子模式下,保留时间为11.710 min的组分,其分子离子峰为m/z625.1779[M+H]+,通过分析质谱数据信息,鉴定得出此化合物为ZnPP,其二级质谱图如图3A所示,m/z566.1638[M-58]+处的碎片离子峰表明ZnPP中—CH2COO的丢失,m/z506.1468[M-118]+处的碎片离子峰由ZnPP中侧链2分子的—CH2COOH丢失形成,在m/z165.2512和m/z149.0260处分别发现ZnPP卟啉环中—C9H11N O2和—C8H7N O2的特征碎片离子峰,在m/z59.0501处发现ZnPP侧链—CH2COOH的碎片离子峰。在负离子模式下,保留时间为11.706 min的组分,其分子离子峰为m/z623.1614[M-H]-,比对后也鉴定为ZnPP,其二级质谱图如图3B所示,在m/z165.1929处发现ZnPP中—C9H11NO2的碎片离子峰,在m/z59.6335处发现ZnPP侧链—CH2COOH的碎片离子峰。Møller等[30]报道,Zn以5 种同位素的形式存在,分别为64Zn:45.89%,66Zn:27.81%,67Zn:4.11%,68Zn:18.57%,70Zn:0.62%,同时在伊比利亚火腿红色素负离子模式质谱图中观察到m/z623.1614的最强离子峰,认为此为ZnPP去质子化的结果,与本研究结果相同。

表2 诺邓火腿红色素的UPLC-MS/MS分析结果Table 2 Analysis of red pigment in Nuodeng ham by UPLC-MS/MS
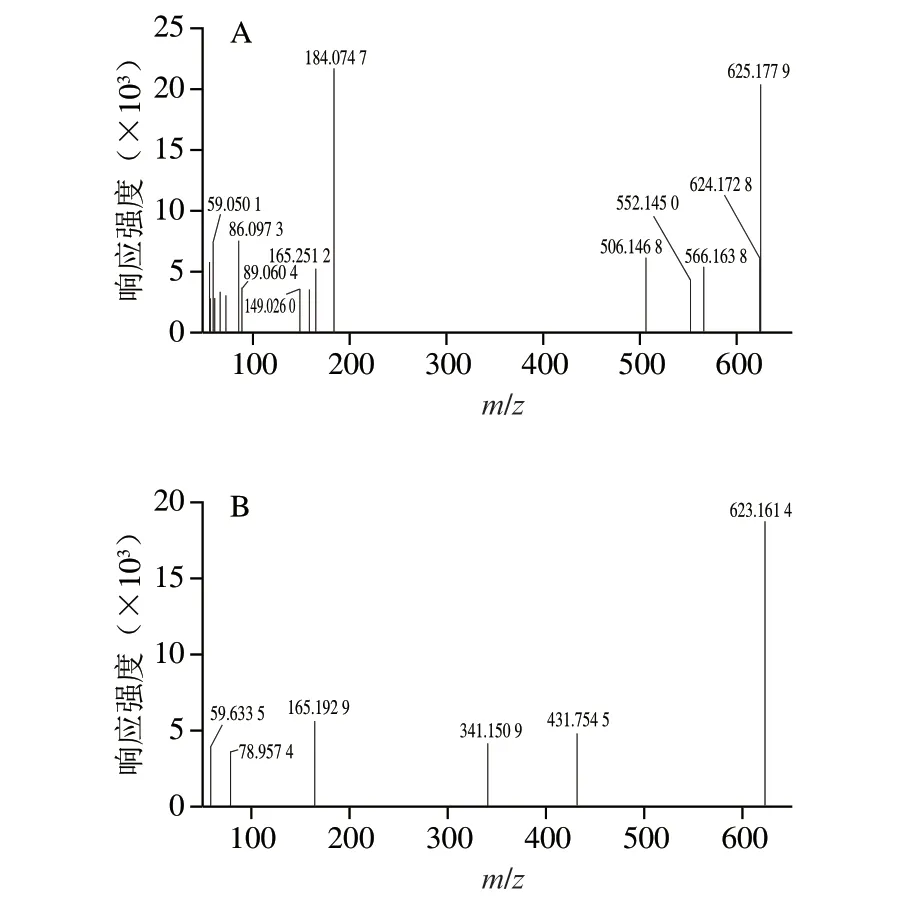
图3 诺邓火腿红色素的二级质谱图Fig.3 Secondary mass spectra of red pigment in Nuodeng dry-cured ham
2.4 诺邓火腿红色素的FTIR分析
FTIR是一种重要的非破坏性分析方法,它可以提供样品中的官能团信息,已被广泛用于研究色素的结构特征[34]。由图4可知,红色素在3008.69、2924.20、2852.60、1709.84、1553.75、1464.96、1411.98、1377.61、937.98、721.74 cm-1处有吸收峰,这些吸收峰反映了红色素的官能团信息。在特征频率区:3008.69 cm-1处的吸收峰归属为烯烃(C=C—H)上的C—H伸缩振动[35];2924.20 cm-1和2852.60 cm-1处的吸收峰是由甲基(—CH3)和亚甲基(—CH2—)的不对称和对称伸缩振动形成的[36];在1709.84 cm-1处还有一个吸收峰,归属为羧基(—COOH)中C=O的伸缩吸收[37]。FTIR指纹区的谱带对于鉴定分子结构至关重要[38]。在指纹区:1553.75 cm-1处的吸收峰为卟啉环上C=N的伸缩吸收;1411.98~1464.96 cm-1的吸收归属为吡咯环的骨架振动或芳香族的C=N伸缩振动;1377.61 cm-1是—CH3弯曲振动所形成的特征吸收峰[39];1245.86 cm-1和1285.96 cm-1的吸收峰归属为—COOH中—C—OH的伸缩;烷基链C-C的伸缩导致在1058.27 cm-1和1088.34 cm-1处形成吸收峰;937.98 cm-1处是—COOH中—C—OH的面外弯曲振动吸收峰;在721.74 cm-1处出现吸收峰,可以归属为—CH2—的摇摆振动[40]。诺邓火腿红色素的红外光谱结果具有卟啉特征官能团的吸收振动,并且在红外光谱中并未发现卟啉环上的N—H伸缩振动(大约在3412.00 cm-1处有较宽的吸收峰)[41],这表明已有金属离子进入到卟啉环中,与卟啉环配位形成金属卟啉配合物,结合前面研究结果,该配合物很可能为ZnPP。
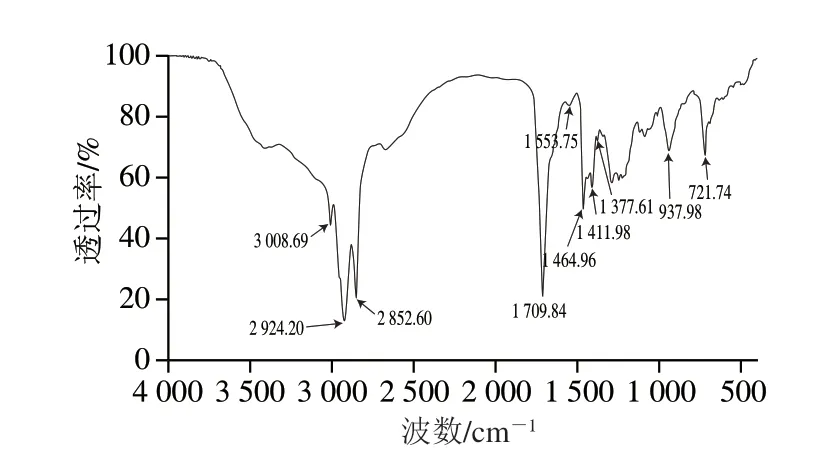
图4 诺邓火腿红色素的FTIR光谱图Fig.4 FTIR spectrum of red pigment in Nuodeng dry-cured ham
2.5 诺邓火腿红色素的NMR谱峰归属
图5为ZnPP的化学结构,对诺邓火腿红色素的核磁数据进行归属如下:1H-NMR(600 MHz,DMSO-D6)分析如下:δ5.32~5.30(m,3H,H-45,46,47)归属为卟啉环上的3 个H信号,δ5.29~5.24(m,6H,H-48,49,50,51,52,53)是卟啉环侧链2 个乙烯基上的6 个H信号,δ2.13~2.11(m,6H,H-35,36,37)归属为卟啉环侧链3 个亚甲基上的6 个H 信号,δ1.53(t,3H,J=9.0 Hz,H-34,44)归属为卟啉环上的1 个H 和侧链1 个亚甲基上的2 个H 信号,δ1.28~1.21(m,12H,H-23,24,32,33)归属为卟啉环侧链4 个甲基上的12 个H 信号,没有检测到卟啉环侧链羧基中的核磁H 信号,羧基中的H 属于活泼H,在N M R 检测时可能没有信号出现[42];13C-NMR(150 MHz,DMSO-D6)分析如下:δ174.63(C-39),δ129.46(C-3),δ129.42(C-2),δ34.05(C-37),δ28.86(C-34),δ22.27(C-35),δ13.82(C-23,24)。诺邓火腿红色素的1H-NMR归属与目标化合物ZnPP结构一致,13C-NMR归属后发现有部分13C信号峰的丢失。

图5 ZnPP化学结构Fig.5 Chemical structure of Zn protoporphyrin IX
3 结论
采用75%丙酮溶液提取,结合C18固相萃取小柱对诺邓火腿红色素进行分离纯化。UV-Vis检测结果表明在416 nm处有1 个强吸收峰,546 nm和584 nm处有2 个弱对称吸收峰,这是金属卟啉(具有高度对称性)的特征吸收峰;经强酸处理后,由于金属离子解离,对称吸收峰消失,出现4 个弱吸收峰(498、538、579、624 nm)。以420 nm波长激发,红色素在590 nm处有1 个强荧光发射峰,644 nm处有1 个弱荧光发射峰,与ZnPP标准品的荧光光谱比对后,高度重合,证明卟啉环中的金属离子为Zn2+,经强酸处理后,随着Zn2+解离,590 nm处荧光发射峰消失,633 nm处出现单一荧光发射峰,与PPIX荧光发射峰高度相似。进一步经UPLC-MS/MS检测,在正离子(m/z625.1779[M+H]+)和负离子(m/z623.1614[M—H]-)模式下均鉴定出ZnPP的存在。在FTIR中检测到—CH3、—CH2—、C=O、卟啉环C=N、羧基中—C—OH和烯烃上的C—H等的伸缩振动,这些都是卟啉环上的特征官能团。解析诺邓火腿红色素1H-NMR发现与目标化合物ZnPP匹配完整,综上所述,诺邓火腿红色素的化学本质为ZnPP。

