花椒果皮多酚类成分鉴定及降血糖活性
杨成峻,陈明舜,刘成梅,周 伟,李积华,陈 军,
(1.南昌大学 食品科学技术国家重点实验室,江西 南昌 330047;2.中国热带农业科学院农产品加工研究所,广东 湛江 524001)
II型糖尿病是最常见的糖尿病类型,其患病率在世界范围内迅速增加[1]。而现有的药物治疗方案如阿卡波糖和米格列醇等往往会出现胃肠道紊乱等的副作用[2]。许多植物中发现的多酚类化合物,具有降血糖功效且副作用较少,具有成为改善血糖和预防II型糖尿病有效制剂的潜力,有望成为现有药物的替代品[3]。
花椒(Zanthoxylum bungeanum)属芸香科(Rutaceae)植物,目前全世界大约有250 个花椒品种,分布于亚洲、非洲、美洲及大西洋地区,其中,我国有50余种[4]。花椒是我国常用的调味品,为药食同源原料,具有独特的风味[5]。花椒中含有多种生物活性物质,在医药、食品和化妆品等领域具有巨大的应用潜力[6]。花椒多酚类物质已经被证明具有抗氧化、抑菌、镇痛抗炎和降血糖等活性[7-10],Zhang Zecai等[11]发现花椒果皮提取物(总黄酮含量80.92 mg/g)对小鼠结肠炎有显著改善作用。Ma Yao等[12]发现花椒果皮提取物具有抗氧化和抗癌活性。Zhang Yali等[13]研究发现从花椒叶中分离出的金丝桃苷对糖尿病小鼠具有降血糖和肝细胞保护作用,Li Wei等[14]发现花椒茎中分离出的橙皮苷和金丝桃苷具有对α-葡萄糖苷酶的抑制活性,但目前鲜见花椒果皮多酚的降血糖活性研究,其降血糖效果需要进一步研究。同时,前期研究主要采用不同溶剂提取花椒果皮多酚粗提物,缺乏对花椒果皮多酚的纯化鉴定,及其活性的相关研究[12,15]。
本研究以花椒果皮原料,采用无水乙醇提取,不同极性溶剂分级萃取花椒果皮多酚,对其主要化学成分进行定性定量分析,并研究其体内外降糖活性,为花椒的综合利用提供理论依据。
1 材料与方法
1.1 材料与试剂
宜昌大红袍花椒(Zanthoxylum bungeanumMaxim.)果皮,由中国热带农业科学院农产品加工研究所提供。
α-葡萄糖苷酶、链脲佐菌素、盐酸二甲双胍、对硝基苯基-β-D-吡喃葡萄糖苷、阿卡波糖、没食子酸、芦丁标准品、山柰酚标准品 上海源叶生物科技有限公司;原儿茶酸、香草酸标准品 北京索莱宝科技有限公司;没食子酸、金丝桃苷、柚皮苷、槲皮苷、柚皮素、异鼠李素、山柰素标准品 上海麦克林生化科技有限公司;原儿茶醛、绿原酸、咖啡酸、丁香酸、表儿茶素、阿魏酸、槲皮素、芹黄素标准品 上海阿拉丁生化科技股份有限公司;木犀草素-7-O-β-D-葡萄糖醛酸苷、山柰酚-3-O-芸香糖苷标准品 北京中科质检生物有限公司;对香豆酸标准品 美国Sigma-Aldrich公司。
3 周龄SPF级雄性KM小鼠50 只,体质量(35±2)g,由湖南斯莱克景达实验动物有限公司提供,实验动物生产许可证号:SCXK(湘)2019-0004,动物饲养在SPF级动物房中,温度(24±2)℃。
1.2 仪器与设备
TU-1810型紫外-可见分光光度计 北京普析通用仪器有限公司;Multiskan spectrum全波长酶标仪美国Thermo Fisher科技公司;Eksigent ekspert ultraLC 110-XL超高效液相色谱仪、Triple TOFTM5600+电喷雾飞行时间高分辨质谱仪 美国AB SCIEX公司;血糖仪及血糖试纸 三诺生物传感股份有限公司。
1.3 方法
1.3.1 花椒果皮多酚的提取和分级萃取
花椒果皮多酚的提取按照Sun Xiaoxia等[7]的方法并稍作修改,将花椒果皮使用中药粉碎机粉碎过20 目筛后,称取1 kg,使用锥形瓶以1∶20的料液比加入花椒果皮干粉和无水乙醇,超声辅助提取20 min后(400 W),3000 r/min离心20 min,取上清液合并,减压浓缩后,真空冷冻干燥得到花椒果皮多酚粗提物78.00 g。将花椒果皮多酚粗提物加适量水溶解后等体积加入石油醚,萃取3 次除去油脂。向剩余水层中加入等体积二氯甲烷,萃取3 次合并减压浓缩后,真空冷冻干燥得到二氯甲烷萃取相(F1)3.33 g。向剩余水层中加入等体积乙酸乙酯,萃取3 次后合并减压浓缩后,真空冷冻干燥得到乙酸乙酯萃取相(F2)4.98 g。再向剩余水层加入等体积正丁醇,萃取3 次,合并减压浓缩后,真空冷冻干燥得到正丁醇萃取相(F3)8.94 g。萃取后的剩余水层在减压浓缩后,真空冷冻干燥得到水相(F4)47.86 g。
1.3.2 花椒果皮总酚和总黄酮含量的测定
使用福林-酚法测定花椒果皮多酚各组分中的总酚,分别移取0.5 mg/mL花椒各组分多酚溶液各1 mL于比色管中,加入0.5 mL福林-酚试剂和6.5 mL水,静置2 min后,再加入2 mL 7.5%碳酸钠溶液,涡旋振荡1 min,70 ℃水浴中反应10 min,在暗处静置1 h后,立刻在750 nm波长条件下使用紫外-可见分光光度计测定吸光度。以没食子酸标准品作标准曲线,由标准曲线计算得总酚含量,以每克干质量的没食子酸当量表示总酚值[16]。
总黄酮的测定采用亚硝酸钠-三氯化铝法。分别移取0.5 mL待测液,加入5%亚硝酸钠溶液0.3 mL振荡摇匀,放置6 min后加入10%硝酸铝溶液0.3 mL振荡摇匀,放置6 min后加入4%氢氧化钠溶液4 mL,加乙醇定容至刻度,摇匀,放置15 min,使用紫外-可见分光光度计在波长510 nm处测定吸光度,以芦丁标准品作标准曲线,由标准曲线计算得总黄酮值。以每克干质量的芦丁当量表示总黄酮值。
1.3.3 超高效液相色谱-电喷雾飞行时间串联质谱法分析
将F1、F2、F3、F4的冻干粉末和多酚标准品分别用适量75%甲醇溶液(色谱纯)溶解,经过0.22 μm尼龙66滤头过滤后上样。
超高压液相色谱测定条件:T3色谱柱(100 mm×2.1 mm,1.8 μm);流速0.3 mL/min;柱温40 ℃;进样量10 μL;流动相A:水(色谱纯);流动相B:乙腈(色谱纯)。梯度洗脱条件:0~5 min,99% A、1% B;5~15 min,99%~50% A、1%~50% B;15~25 m i n,50%~10% A、50%~90% B;25~30 min,10% A、90% B。
质谱测定条件:电喷雾离子源为负离子模式;质量扫描范围m/z50~1500;鞘气流速45 arb;辅助气体流速15 arb;喷雾电压-3.6 kV;毛细管温度400 ℃;full MS分辨率70000;MS/MS分辨率17500;碰撞能量20/40/60 eV。
定性和定量的数据处理软件为PeakViewTM2.0谱图数据分析处理工作站。
1.3.4α-葡萄糖苷酶的抑制活性
按照Xu Yaqin等[17]的方法稍作修改,以对硝基苯基-β-D-吡喃半乳糖苷为底物测定α-葡萄糖苷酶的活性。用PBS(0.1 mol/L,pH 6.8)溶液将F1、F2、F3、F4和阿卡波糖配制成50~1000 μg/mL的系列样品溶液。其中阿卡波糖作为阳性对照,PBS溶液(0.1 mol/L,pH 6.8)为阴性对照。首先将40 μL样品、阳性对照和阴性对照分别加入48 孔板中与80 μLα-葡糖苷酶(1 U/mL)混合,37 ℃孵育5 min后,加入80 μL 2.5 mmol/L硝基苯基-β-D-吡喃半乳糖苷底物以启动反应。37 ℃反应15 min,加入320 μL碳酸钠(1.0 mol/L)终止反应,立即在波长405 nm处测定吸光度,按式(1)计算抑制率。α-葡萄糖苷酶抑制实验重复3 次。

式中:A0为空白对照的吸光度;A1为样品或阳性对照的吸光度。
利用SPSS分析软件,根据样品浓度和α-葡萄糖苷酶活性的抑制率计算IC50值,样品IC50值越低表明其对酶的抑制能力越强。
1.3.5α-葡萄糖苷酶的抑制类型的确定
根据Michaelis-Menten动力学的原理分析α-葡萄糖苷酶反应动力学。对α-葡萄糖苷酶的抑制类型的确定由Lineweaver-Burk图在特定酶的浓度和反应时间确定,硝基苯基-β-D-吡喃半乳糖苷的浓度范围为0.5~10 mmol/L,按照1.3.4节方法测定,记录底物质量浓度及α-葡萄糖苷酶的反应速率,依此绘制Lineweaver-Burk图,同时计算米氏常数(Km)和最大初始反应速率(Vm)。
1.3.6 荧光猝灭
将α-葡萄糖苷酶与各组分样品在3 个不同的温度(297.15、303.15、310.15 K)下混合后孵育5 min。295 nm的激发波长测定α-葡萄糖苷酶的发射荧光,并收集300~400 nm波长下酶的发射荧光,激发和发射狭缝宽度均设置为2.5 nm。结合常数(Ka)、荧光猝灭常数(Kq)和结合位点数(n)的值按式(2)、(3)计算[18]。

式中:F0和F分别为加入花椒果皮多酚前后α-葡萄糖苷酶的荧光强度(340 nm);τ0为荧光团的寿命(10-8s);Ksv为Stern-Volmer猝灭常数/(mL/mg);Kq为猝灭速率常数/(mL/(mg·s));[Q]为猝灭剂的质量浓度/(mg/mL)。
1.3.7 II型糖尿病小鼠的造模和给药
选择健康雄性KM小鼠40 只,自由采食、自由饮水,适应性喂养7 d后,随机分为2 组,即空白对照组(n=8)和建模组(其余)。建模期间空白对照组给予普通饲料喂养,建模组给予高脂高糖饲料喂养,4 周后,将小鼠不禁水禁食12 h后,腹腔注射30 mg/kg的链脲佐菌素(链脲佐菌素溶解于冰浴的0.1 mol/L柠檬酸钠缓冲液中,30 min内注射于体内),每3 d重复注射1 次,总共注射6 次。注射结束3 d后,将小鼠不禁水禁食12 h后,尾静脉采血,使用血糖仪测定小鼠12 h空腹血糖,12 h空腹血糖大于11.10 mmol/L的小鼠判定为建模成功的二型糖尿病小鼠。将建模成功的小鼠按体质量和血糖值随机分为4 组,每组8 只,分别为低剂量组(100 mg/kg F3)、高剂量组(300 mg/kg F3)、阳性对照组(100 mg/kg盐酸二甲双胍)、模型对照组(等体积0.1 mol/L柠檬酸钠缓冲液),继续喂养28 d,期间空白对照组给与等体积的0.1 mol/L柠檬酸钠缓冲液灌胃,每天在同一时间给予不同剂量的受试物(盐酸二甲双胍和F3)进行灌胃。
1.3.8 小鼠体质量和摄食量、饮水量的测定
实验开始后,小鼠实验期间自由饮水,自由采食,在每天的同一时间(15:00)测量小鼠的体质量,监测小鼠每日的体质量变化,同一时间取出饲料及水瓶称量,记录每日小鼠摄食量和饮水量。
1.3.9 小鼠空腹血糖和口服糖耐量的测定
实验第0、5、10、15、20、25天同一时间从禁食8 h(9:00—17:00)小鼠的尾尖采血使用血糖仪测量小鼠的空腹血糖。
实验期结束后,小鼠禁食不禁水12 h(21:00至次日9:00),给小鼠灌胃2 g/kg的葡萄糖溶液(用0.1 mol/L柠檬酸钠缓冲液溶解),于灌胃后0、0.5、1 h和2 h,分别测定各时间点的血糖值并记录为小鼠口服葡萄糖耐量,并按式(4)计算血糖曲线下面积:

式中:G0、G30、G60、G120分别为灌胃葡萄糖后0、0.5、1 h和2 h的血糖值/(mmol/L)。
1.4 数据处理
所有实验均重复3 次,实验结果采用SPSS 25.0软件进行统计分析,数据以表示,并在5%置信水平下使用Tukey检验进行比较。
2 结果与分析
2.1 总酚和总黄酮含量的测定
如表1所示,不同组分花椒果皮多酚的总酚和总黄酮含量具有显著差异(P<0.05),且呈现相同的趋势,为F2>F3>F4>F1。经过分级萃取后,多酚类物质主要富集于F2(总酚(351.769±2.512)mg/g,总黄酮(421.973±7.293)m g/g)、F 3(总酚(202.662±15.544)mg/g,总黄酮(321.793±2.225)mg/g)中,可能是因为花椒中大部分多酚类物质的极性和介电常数与乙酸乙酯和正丁醇的极性和介电常数接近,所以大部分多酚更易溶解在这2 种有机溶剂中而被分离开[19-20],说明分级萃取能够很好地富集花椒中的多酚类化合物。

表1 花椒果皮中总酚和总黄酮含量Table 1 Contents of total phenolics and total flavonoids in Z.bungeanum pericarps mg/g
2.2 超高效液相色谱-电喷雾飞行时间串联质谱法分析
使用超高效液相色谱-电喷雾飞行时间串联质谱法技术结合外标法对花椒果皮多酚各组分进行分析以确定其中多酚的种类及含量,结果如表2所示。共鉴定出20 种化合物,包括9 种酚酸及其衍生物和11 种黄酮类化合物(表3)。
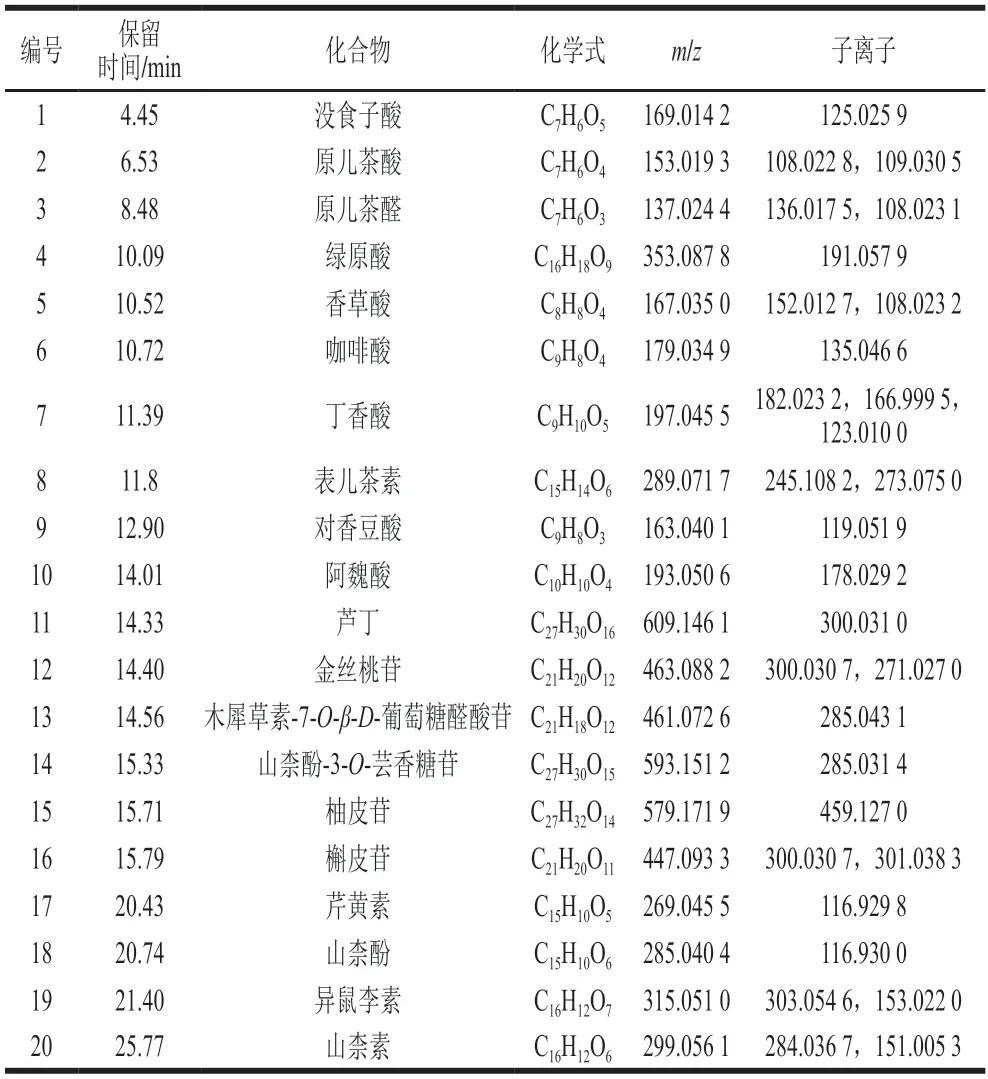
表2 花椒果皮多酚各相中化合物的鉴定Table 2 Identification of phenolic compounds in Z.bungeanum pericarps

表3 花椒果皮多酚各相中化合物的含量Table 3 Contents of phenolic compounds in Z.bungeanum pericarps
黄酮类化合物是F2和F3中鉴定出化合物的主要成分,共鉴定出11 种黄酮类化合物,分别为表儿茶素、芦丁、金丝桃苷、木犀草素-7-O-β-D-葡萄糖醛酸苷、山柰酚-3-O-芸香糖苷、柚皮苷、槲皮苷、芹黄素、山柰酚、异鼠李素、山柰素。其中,芦丁(13.200 g/kg)是F3中黄酮类化合物的主要成分,占F3鉴定出黄酮类化合物含量的74.55%。芦丁(4.044 g/kg)和槲皮苷(4.577 g/kg)是F2中黄酮类化合物的主要成分,分别占F2鉴定出黄酮类化合物含量的30.82%和34.89%。Yang Lichen等[21]的研究发现,花椒叶片的黄酮类化合物中金丝桃苷(886.36 g/kg)含量较高而表儿茶素(77.80 g/kg)和芦丁(89.41 g/kg)的含量较低。Yu Li等[22]报道奉贤大红袍花椒和秦安一号花椒中芦丁含量分别为14.175 g/kg和12.728 g/kg,含量与F3中的芦丁含量接近。Ma Yao等[12]研究中发现花椒果皮乙酸乙酯提取物含有金丝桃苷含量65.1 mg/kg,远低于本实验F2中金丝桃苷的含量(1885 mg/kg),这可能是本研究中分级萃取时乙酸乙酯对金丝桃苷有富集效果。
对于酚酸及酚酸衍生物,从花椒果皮多酚各组分中共鉴定出9 种酚酸及酚酸衍生物:没食子酸、原儿茶酸、绿原酸、香草酸、咖啡酸、丁香酸、原儿茶醛、阿魏酸和对香豆酸。F2和F3中鉴定出的总酚酸含量显著高于F1和F4,分别为7.064 g/kg(35.00%)和5.106 g/kg(22.38%),其中绿原酸为F2和F3鉴定出的酚酸中的主要成分,占到60.88%和89.32%。这与Bhatt[23]和Yang Lichen[21]等在花椒叶片多酚和Yu Li等[22]在花椒果皮多酚中鉴定出的结果一致,说明绿原酸是花椒酚酸的主要成分。Ma Yao等[12]乙酸乙酯提取的花椒果皮提取物中,绿原酸(0.5 mg/kg)和对香豆酸含量(7.7 mg/kg)显著低于本实验乙酸乙酯相F2中的绿原酸(4.300 g/kg)和对香豆酸(1.56 g/kg)含量,再次印证了分级萃取时乙酸乙酯对多酚的富集效果。
总之,不同组分多酚类化合物含量不同,但趋势为F2>F3>F4>F1,这与总酚和总黄酮含量的趋势一致。因此,使用不同极性的有机溶剂进行分级萃取对不同极性的多酚类物质能够起到较好的富集作用。
2.3 α-葡萄糖苷酶的抑制活性
α-葡萄糖苷酶是位于小肠绒毛表面的消化酶,可以催化寡糖、二糖和三糖水解为单糖从而可被人体吸收,是人类吸收碳水重要的消化酶[24]。因此,抑制α-葡萄糖苷酶的活性可以有效地降低二型糖尿病患者餐后血糖升高的峰值,调节餐后血糖水平[3,25]。由图1可知,花椒果皮的4 个组分均对α-葡萄糖苷酶的活性有抑制作用,且抑制率均呈现明显的剂量依赖。所有的4 个组分样品对α-葡萄糖苷酶活性的抑制率均低于阿卡波糖,其中F3(IC50=0.176 mg/mL)对α-葡萄糖苷酶的活性抑制作用明显较强,对α-葡萄糖苷酶抑制率最高可以达到85.86%,说明花椒果皮多酚中对α-葡萄糖苷酶活性抑制较强的化合物极性可能中等偏高。
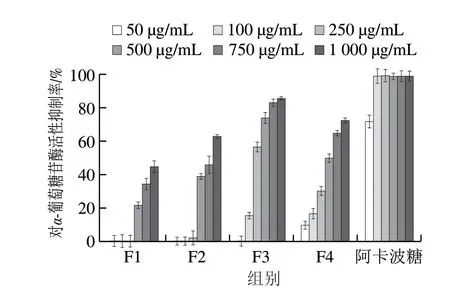
图1 花椒果皮多酚对α-葡萄糖苷酶活性的抑制率Fig.1 Inhibitory effects of polyphenols from Z.bungeanum pericarps against α-glucosidase
采用SPSS 25.0软件,对2.2节中鉴定出的花椒果皮多酚中含量较高的18 种化合物与花椒果皮多酚各组分对α-葡萄糖苷酶活性的抑制率进行Pearson法相关性分析,由图2可以看出,绿原酸、芦丁和金丝桃苷与对α-葡萄糖苷酶活性的抑制率相关性较好,且具有极显著相关性(P<0.01),而槲皮苷对α-葡萄糖苷酶活性的抑制率相关性较弱。结合2.2节的鉴定结果,芦丁有可能是花椒果皮多酚中对α-葡萄糖苷酶活性的抑制贡献较大的化合物,芦丁已经被证实对α-葡萄糖苷酶活性具有很强的抑制作用[26],并且它在F3中含量较高,浓度更高更易与α-葡萄糖苷酶发生相互作用,从而相比其他多酚更能发挥其对α-葡萄糖苷酶活性的抑制作用。

图2 花椒果皮多酚中主要成分与α-葡萄糖苷酶活性的抑制率相关性分析Fig.2 Correlation analysis between major phenolic components in Z.bungeanum pericarps and percentage of α-glucosidase inhibition
2.4 α-葡萄糖苷酶的抑制类型的确定
结合α-葡萄糖苷酶的活性抑制实验,选取对α-葡萄糖苷酶活性抑制作用最强的组分F3,研究其对α-葡萄糖苷酶的抑制动力学,以确定花椒果皮多酚对α-葡萄糖苷酶的抑制类型。
由图3可以看出,随着F3的质量浓度增加,横截距(-1/Km)降低,纵截距(1/Vm)增加。米氏常数(Km)和最大初始反应速率(Vm)均下降,呈现出明显反竞争性抑制作用的特征,这与报道的牡荆素的反竞争性抑制特征类似[27]。可以推测F3可能是与酶的活性位点入口部分结合,从而与酶和底物形成的中间产物结合,并阻止产物从酶的活性位点释放出来,使可参与反应的酶浓度下降,从而抑制α-葡萄糖苷酶的活性,所以出现Km和Vm均下降的现象[28]。
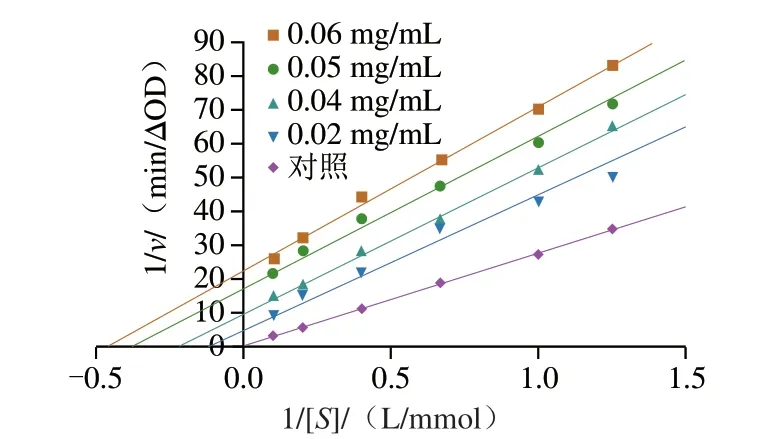
图3 花椒果皮多酚F3对α-葡萄糖苷酶的抑制作用的Lineweaver-Burk图Fig.3 Lineweaver-Burk plots of α-glucosidase inhibition by ZPP F3
2.5 花椒果皮多酚与α-葡萄糖苷酶的荧光猝灭光谱分析
为了进一步研究花椒果皮多酚与α-葡萄糖苷酶的相互作用,测量F3对α-葡萄糖苷酶的荧光光谱,并应用Stern-Volmer方程做双对数图,计算Ksv、Ka值及n值,以研究花椒果皮多酚与α-葡萄糖苷酶的结合机制、结合常数和结合位点[29-30]。由图4A可见,α-葡萄糖苷酶在295 nm波长的激发光激发后在340 nm左右处显示出强烈的荧光发射峰。随着体系中F3质量浓度增加,α-葡萄糖苷酶的荧光强度均随之降低,表明F3能够与α-葡萄糖苷酶相互作用并猝灭其固有荧光的强度[31]。

图4 不同质量浓度F3对α-葡萄糖苷酶荧光的影响(A)和不同温度下F3对α-葡萄糖苷酶荧光猝灭的双倒数图(B)Fig.4 Effects of different concentrations of F3 (A) on α-glucosidase fluorescence and double reciprocal diagram of fluorescence quenching of α-glucosidase by F3 (B) at different temperatures
从图4B表格可以看出,对于F3,Ka值随着温度升高而明显升高,表明F3与酶的亲和力随着温度的升高而变强,推测F3与α-葡萄糖苷酶的猝灭过程可能是放热反应。F3的n值在3 个温度下接近1,表明F3与α-葡萄糖苷酶可以直接形成一对一的复合物[32],而且n值在较高温度下出现了一定程度的下降,可能是因为在较高温度下F3与α-葡萄糖苷酶的相互作用变得不稳定或F3的猝灭能力受损[25]。
2.6 小鼠体质量和摄食量、饮水量的测定
由表4可知,实验期间糖尿病小鼠均出现了多饮多食的现象,而高剂量组的小鼠的摄食量较模型对照组明显下降,说明高剂量的F3可以缓解糖尿病小鼠的多食现象。相对于模型对照组,低剂量组、高剂量组和阳性对照组小鼠饮水量没有显著性差异。由表4还可以看出,除了空白对照组在实验期间体质量增加外,其余各模型组均出现了一定程度的体质量减轻,高剂量组的体质量下降最少,说明高剂量的F3可能对糖尿病小鼠的体质量减轻症状有一定的改善作用。

表4 给药前后各组小鼠饮水量、摄食量和体质量Table 4 Water intake,food intake and body mass of mice from different groups before and after administration
2.7 小鼠空腹血糖和口服糖耐量的测定
由表5可知,开始灌胃后,各模型组空腹血糖值均开始降低,而高剂量组的降低幅度最大,4 周后血糖下降64.2%,幅度接近阳性对照组(下降58.1%),显著高于低剂量组(下降29.2%),表明F3对糖尿病小鼠长期的血糖有一定的改善作用,且体现出剂量依赖。
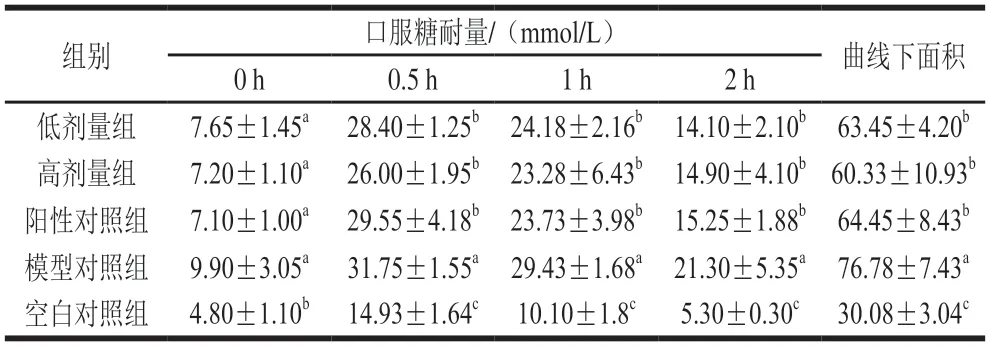
表5 各组小鼠口服糖耐量值和曲线下面积Table 5 Oral glucose tolerance and area under the curve in mice from different groups
由表6可知,在口服糖耐量实验中,所有小鼠在灌胃葡萄糖0.5 h后血糖均达到峰值,随后开始缓慢下降,相比空白对照组,所有模型小鼠的血糖全程均高于同时期的空白对照组,而相对于模型对照组,低剂量组、高剂量组和阳性对照组均能够降低灌胃葡萄糖后血糖的峰值,并且血糖下降更快。低剂量组、高剂量组和阳性对照组的曲线下面积也均低于模型对照组,高剂量组下降最明显,相比模型对照组下降21.42%,说明F3和盐酸二甲双胍一样能够改善小鼠对葡萄糖的耐受能力,提高小鼠抗高血糖的能力[33]。

表6 小鼠灌胃期间各组空腹血糖值Table 6 Fasting blood glucose in mice from different groups during the oral treatment period
3 结论
重点分析花椒果皮中多酚成分的组成和降血糖活性,结果显示,不同极性的有机溶剂萃取的花椒果皮多酚组分的多酚组成、含量及降血糖效果存在差异。通过分级萃取,花椒果皮中的多酚主要富集于乙酸乙酯萃取相(F2)和正丁醇萃取相(F3)中,总酚和总黄酮第二高的F3体外降血糖能力最强,从中鉴定出的主要酚酸绿原酸和主要黄酮芦丁对α-葡萄糖苷酶活性抑制率具有极显著相关性。给与F3灌胃治疗的糖尿病小鼠,其体质量减轻和饮食异常现象得到一定的改善,空腹血糖值和口服糖耐量也明显降低。因此,花椒果皮多酚在体内和体外条件下均具有降血糖的功效,有潜力成为预防和治疗糖尿病的活性成分。

