乳清酒发酵过程中细菌群落演替与风味物质变化的相关性分析
王 慧,吴小燕,夏亚男,王玉荣,洋 洋,乌有娜,双 全
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010000)
乳清作为制造干酪和干酪素的加工副产物,营养价值丰富,如果将其排放,不仅会造成资源浪费,同时也会造成环境污染。目前,一些乳业发达国家如荷兰、德国、美国已经拥有了较强的乳清加工能力,与这些国家相比,我国对于乳清废液的处理能力相对落后[1]。因此,乳清资源的合理开发和利用已经成为了急需解决的问题。
近年来,研究人员一直致力于将乳清更加合理利用,实现乳清的商业价值。毛婷等[2]研制一款发酵型牦牛乳清酒,口感独特,得到了大量开发应用。孙子羽等[3]对黑枸杞乳清酒中挥发性风味物质进行研究分析,检测到的挥发性风味物质中,以酯类物质为主,主要成分是癸酸乙酯和辛酸乙酯,其次是醇类、酸类、醛类、烃类物质。张敏[4]研制一款低醇乳清酒,筛选出最佳发酵菌种并对乳清酒的氨基酸含量进行分析得出含量由高到低依次是谷氨酸、半胱氨酸、丝氨酸等。乳清酒发酵过程中微生物在其生产和风味形成过程中发挥了至关重要的作用。但截至目前,缺少对乳清酒微生物多样性和风味的相关研究,无法为乳清酒的生产及工艺优化提供指导。
本研究拟采用气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)联用仪对乳清酒发酵过程中的挥发性风味物质变化进行分析,运用高通量测序技术对乳清酒发酵过程中的细菌菌落结构进行解析,并进一步展开相关性分析,揭示乳清酒发酵过程中微生物群落结构演替对风味物质形成的推动作用,以期为乳清发酵酒的风味调控及乳清产业链的发展奠定基础。
1 材料与方法
1.1 材料与试剂
红枣、桑葚、枸杞、葡萄干、白砂糖、乳清粉均为市售。
酵母菌为ALE -514 澳洲马利酿酒干酵母(Saccharomyces cerevisiae),商品名Maurivin。
乳酸菌为PC-01 食用乳酸菌,配料:嗜热链球菌(Streptococcus thermophilus)、保加利亚乳杆菌(Lacotbacillus bulgaricus)、植物乳杆菌(Lactobacillus plantarum)。
1.2 仪器与设备
TAISITE高速万能粉碎机 天津市泰斯特仪器有限公司;bluepard生化培养箱 天津泰斯特仪器有限公司;GeneAmp®9700型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司;Illumina MiSeq测序仪 美国Illumina公司。
1.3 方法
1.3.1 乳清酒酿造工艺
原料→清洗→粉碎→灭菌→调糖→调pH值→发酵→过滤→装瓶
操作要点:1)原料:挑选大小均匀、成熟且无虫害溃烂;枸杞、桑葚、红枣、葡萄干和乳清液的添加量为20.0、20.0、15.0、10.0 g/L和10%。2)清洗:将原料用去离子水清洗2 次,除去原料表面灰层等杂质。3)粉碎:使用高速万能粉碎机将原料进行粉碎。4)灭菌:将灌装好的乳清发酵酒进行水浴灭菌,温度99 ℃,时间30 min。5)调糖度:使用白砂糖将可溶性固形物调整到6.0%左右。6)调pH值:使用柠檬酸、柠檬酸钠将pH值调整到5.2。7)发酵:分别加入酵母菌和乳酸菌200.0 mg/L和60.0 mg/L,发酵温度22 ℃,发酵时间28 d,发酵前1 周进行适合摇晃,1 周后保持无氧发酵。8)过滤:发酵后的乳清酒含有残渣、沉淀物;使用5 层纱布过滤,将发酵残渣、沉淀物分离除去。9)取样:取发酵第0、7、14、21、28天的样品保存,以备后续实验。
1.3.2 挥发性风味物质的测定
1.3.2.1 样品准备
取5 mL样品加入20 mL顶空瓶中,加盖密封。
1.3.2.2 固相微萃取条件
萃取纤维:50/30 μm DVB;萃取温度50 ℃;振荡15 min、萃取30 min;振荡速率250 r/min;解吸时间5 min;GC循环时间50 min。
1.3.2.3 GC-MS条件
色谱柱:DB-wax(30 m×0.25 mm,0.25 μm);进样温度260 ℃;载气为氦气(99.999%);流量1 mL/min;柱温:40 ℃保持5 min,以5 ℃/min升至220 ℃,20 ℃/min升至250 ℃,保持2.5 min;接口温度260 ℃;离子源温度230 ℃;四极杆温度150 ℃;电离方式为电子电离源,70 eV;扫描方式为全扫描;质量范围20~400 u。
1.3.2.4 气味活性值(odor activity value,OAV)计算
OAV为组分在样品中含量与该组分气味阈值之比。
1.3.3 细菌多样性解析
1.3.3.1 样品总DNA提取
参照E.Z.N.A.®Soil DNA kit试剂盒中的方法对乳清酒样品中宏基因组的总DNA进行检测。
1.3.3.2 PCR扩增及MiSeq高通量测序
细菌16S rRNA基因V3~V4可变区:上游引物:338F(5’-ACTCCTACGGGAGGCAGCAG-3’),下游引物806R(5’-GGACTACHVGGGTWTCTAAT-3’)。扩增程序:95 ℃预变性3 min,27 个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后72 ℃稳定延伸10 min,最后在4 ℃进行保存。使用引物338F和806R对细菌V3~V4区域进行扩增,对纯化后的扩增产物进行高通量测序,由上海美吉生物医药科技有限公司完成。
1.4 数据统计与分析
基因功能预测:使用PICRUSt软件对乳清酒样品中微生物的基因功能进行预测[5]。直系同源集(Clusters of Orthologous Groups,COG)功能注释:参照蛋白质COG数据库进行[6]。京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)注释:运用FMAP软件进行KEGG注释和差异Module分析。采用IBM SPSS Statistics 26和R软件进行统计学分析,使用Origin 2021和美吉云平台进行作图。风味物质与微生物相关性分析通过计算Spearman相关系数绘制相关性网络图。
2 结果与分析
2.1 乳清酒香气成分分析
2.1.1 乳清酒发酵过程中挥发性风味物质的变化
由图1可以看出,在不同发酵时间,乳清酒物质种类较丰富;同时离子相对强度也不同,说明在发酵期间乳清酒各挥发性物质的含量不同。由图2可知,在发酵过程中共检测到酯类、醛酮类、烷烃类、醇类、其他类5大类物质。其中酯类物质在发酵过程中种类最多,发酵开始时共检测到41 种风味物质,到达发酵终点时检测到55 种风味物质,说明乳清酒发酵过程中风味物质的数量整体增加,酒体变得丰富,香气逐渐浓郁。

图1 乳清酒发酵期间总离子流图Fig.1 Total ion current chromatograms of whey wine with different fermentation periods

图2 乳清酒发酵期间各类挥发性风味物质数量变化Fig.2 Variation in the types of volatile flavor substances in whey wine during fermentation
2.1.2 乳清酒香气化合物的定量分析
乳清酒的主要香气来源于原料本身和微生物发酵[7]。这些挥发性化合物通过富集作用使乳清酒香气浓郁[7]。乳清酒发酵期间共检测出102 种挥发性风味物质,其中酯类物质38 种,醛酮类物质24 种,醇类物质10 种,烷烃类物质10 种,酸类物质7 种,其他类物质13 种。图3为含量前30的风味物质的变化图。在发酵期间,各类物质含量变化较明显。总体呈先增加后减少的趋势,这与裴鹏正等[7]研究的软儿梨果酒结果一致。

图3 乳清酒发酵期间挥发性风味物质含量的变化Fig.3 Changes in contents of volatile flavor substances in whey wine during fermentation
酯类物质是乳清酒的主要香气物质,酯类的形成受醪液理化组成及发酵条件的影响,乙醇发酵阶段,在酯酶催化作用下酰基CoA与乙醇合成脂肪酸乙酯,乙酰CoA和高级醇合成乙酸酯[8]。发酵酒酯类物质的种类随发酵的进行明显增多,发酵结束时检测出26 种酯类物质。多数酯类在发酵过程中呈先增加后降低的趋势,是由于发酵前期发酵液中醇类物质与酸类物质发生酯化反应,使得乳清酒中酯类物质增加;发酵后期含量降低可能是微生物将其分解或转化为其他物质[9]。大多数酯类具有怡人的花香味,如苯甲酸乙酯带有浓郁的花香味,癸酸乙酯带有葡萄似水果香味[10]。其中乙酸异戊酯、乙酸乙酯、棕榈酸乙酯在发酵过程中一直存在,主要赋予发酵酒果香味。
醛酮类物质能与醇类物质相互反应,产生怡人、和谐的香气。乳清酒发酵过程中共检测出14 种醛类物质,10 种酮类物质。其中包括构成发酵酒原料之一红枣的主要香气成分己醛[11],主要呈青草气及苹果香气。同时乙醛的形成可能是发酵液中木质素降解产生[12],赋予酒体果香和干果味。
醇类化合物是组成乳清酒香气成分的重要物质,少量高级醇可使酒体的香气更加饱满。发酵过程中苯乙醇含量(2369.61 mg/kg)最多,具有清香的玫瑰花香。异戊醇是高级醇的主要成分,主要呈辛辣味[13],随着发酵的进行,乳清酒中异戊醇逐渐消失,说明酒体柔和,更易被大众接受。
酸类物质是风味形成的主要物质,同时也是酯类物质的前体物质,具有平衡口感的作用。乳清酒发酵过程中乙酸、辛酸和癸酸呈增加趋势,乙酸是发酵制品中重要的风味物质,使得酒体口感酸而不涩。有报道称辛酸和癸酸对奶香味贡献较大[14],是乳清酒的独特风味物质。同时辛酸还能促进胃排空,缓解消化不良[15]。其他酸类物质在发酵后期减少可能与酯化反应有关。2,4-二叔丁基酚、4-乙基苯酚和苯乙烯是发酵酒的主要芳香化合物,主要呈水果香和花香,香味突出,这是酒体优雅、醇厚等风味形成的关键[16]。
2.1.3 乳清酒风味物质的OAV分析
对挥发性化合物定性定量分析后,根据的气味阈值[17]计算各类物质的OAV。通常认为OAV≥1的化合物为香气贡献成分,OAV≥10的化合物为重要香气成分。上述103 种挥发性化合物中有43 种化合物OAV大于1,见表1。在发酵第7天时,香气物质开始显著增加,其中OAV≥10的有苯甲酸乙酯、乙酸苯乙酯、丁酸乙酯、庚酸乙酯、壬酸乙酯、乙酸乙酯、十一酸乙酯、棕榈酸乙酯、苯丙酸乙酯、癸酸异戊酯、壬醛、2-十一酮、辛酸、苯乙醇、4-乙基苯酚构成了乳清发酵酒的重要香气成分。这与任晓宇等[18]在红枣白兰地香气分析中的结果相似,苯甲酸乙酯、丁酸乙酯、庚酸乙酯、苯丙酸乙酯等乙酯类化合物具有较高的OAV,它们共同赋予酒体水果香味。发酵后期增加了癸酸乙酯、己酸乙酯、2-壬酮为主要香气成分,分别赋予乳清酒青苹果和草莓的果香味。

表1 乳清酒发酵过程中挥发性风味物质OAV变化Table 1 Changes in OAV of volatile flavor substances in whey wine during fermentation
2.2 乳清酒细菌群落结构分析
2.2.1 乳清酒细菌α多样性分析
通过细菌16S rRNA序列测序从15 个样本中共获得226550 条有效序列,所有样本细菌序列归属于24 个门,52 个纲,105 个目,151 个科,212 个属,262 个种,293 个可操作分类单元(operational taxonomic unit,OTU)。样本覆盖率均大于0.90,表明所选样本有效序列的测序深度较高,可以反映整个微生物群落的真实情况(表2)。对于群落的物种多样性来说,乳清酒的Shannon指数从第7天时开始降低,到28 d增加,这可能是因为在发酵过程乙醇含量开始增加,具有低氧、低pH值以及高乙醇的不利条件,使得许多不耐乙醇和酸的微生物随之消亡[19],导致多样性降低。发酵酒发酵前7 d的细菌Chao1指数较小,随后大幅度上升,这表明乳清酒在发酵初期微生物群落丰富度最低,经过发酵作用后菌群丰富度上升。

表2 乳清酒酒样细菌α多样性指数测定结果Table 2 α-Diversity indexes of bacteria in whey wine
由图4可知,乳清酒发酵过程共有的OTU为21 个。在发酵前,样品中特有的OTU数为7 个,发酵7 d,OTU数快速下降,发酵后期样品在环境中获得了大量的菌体,发酵21 d,特有OTU数快速增加为68 个。发酵结束时,特有OTU增加为87 个。再将每个OTU与细菌分类学数据库进行比对,得到每个OTU的物种注释,共注释得到3 个门、12 个属的细菌。

图4 乳清酒酒样细菌OTU的统计和比较Fig.4 Venn diagram of unique and shared bacterial OTUs in whey wine with different fermentation periods
2.2.2 基于门水平乳清酒发酵过程中群落结构分析
由图5所示,在门水平,乳清酒细菌群落由厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、蓝细菌门(Cyanobacteria)和其他(others)构成。发酵开始存在Proteobacteria与Cyanobacteria,可能来源于发酵酒的原料和环境。Firmicutes和Proteobacteria在整个发酵过程中占绝对优势地位,但二者呈相反的变化趋势。随着发酵的进行,Firmicutes相对丰度虽然有所浮动,但在整个发酵期间的含量仍为最高。Proteobacteria在发酵开始时达到峰值22.41%,在发酵终点时的平均相对含量为2.43%。这可能因为Proteobacteria的部分好氧菌在低氧、酸性和高醇的环境中难以生存[20]。而Firmicutes的乳酸菌可以适应这种环境,这也说明Firmicutes在乳清酒发酵中发挥了重要作用,与Sun Zhihong等[21]报道结果一致。

图5 基于门水平的乳清酒酒样的细菌群落结构Fig.5 Bacterial community structure in whey wine samples at the phylum level
2.2.3 基于属水平乳清酒发酵过程中群落结构分析
由图6可知,在属水平上,乳清酒发酵过程中共检测到的相对丰度大于1%的细菌属有7 个,分别是乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、链球菌属(Streptococcus)、不动杆菌属(Acinetobacter)、明串珠菌属(Leuconostoc)、克雷伯菌属(Klebsiella)、拉乌尔菌属(Raoultella)。发酵前期Lactobacillus为绝对优势菌群,随着发酵的进行Lactobacillus和Lactococcus成为绝对优势菌群。在发酵过程中,乳酸菌是存在于乳清酒发酵中的优势菌种,乳酸菌能将乳制品中可发酵糖类转化为乳酸、水解酪蛋白、分解脂肪,进行柠檬酸发酵。乳酸菌产生的酶和代谢产物在发酵酒的酸度、口感、香气和质地中发挥着重要作用。研究学者认为可以通过对乳酸菌的基因调控如丙酮酸脱羧酶、NADH氧化酶和α-乙酰乳酸脱羧酶等控制乳中风味代谢物的产生[22]。同时,乳酸菌也是酸肉、香肠发酵中的优势细菌[23]。

图6 基于属水平的乳清酒酒样的细菌群落结构Fig.6 Bacterial community structure in whey wine samples at the genus level
2.2.4 乳清酒细菌β多样性分析
在16S rRNA基因序列分析中,基于Unifrac距离主坐标分析(principal co-ordinates analysis,PCoA)被广泛使用,在图中的距离越近,说明样品间组成相似度越高。
PC1和PC2分别解释了不同发酵时间乳清酒中细菌群落57.27%和28.57%的信息,累计解释了85.84%的信息。由图7可知,发酵0 h,样本主要集中在第3象限。发酵过程中的样本呈较明显的聚类。发酵7~14 h的样本距离较近,聚集于第2象限。发酵21~28 h样本主要集中在第4象限。

图7 基于加权Unifrac距离的样本细菌群落PCoA图Fig.7 PCoA plot of bacterial communities based on weighted Unifrac distance
由图8可知,乳清酒发酵期间样本可聚为3 类,发酵0 d聚集为第1大类,发酵7~14 d聚集为第2大类,发酵21~28 d聚集为第3大类。结合PCoA可得到一致的结论,即乳清酒发酵可分为:0 d(发酵初期)、7~14 d(发酵中期)、21~28 d(发酵后期)。

图8 基于OTU水平样板细菌群落层级聚类分析图Fig.8 Hierarchical cluster analysis of bacterial community based on OTUs
2.2.5 细菌功能预测
2.2.5.1 COG数据库注释分析
由图9可知,通过对乳清酒细菌菌群COG功能预测,发现在乳清酒细菌菌群中共鉴定到20 个主要的功能大类,乳清酒中的微生物一部分丰度较高的基因参与到未知功能和已知功能这两个COG分类中,其中相对含量在前8 位的功能大类为:碳水化合物转运与代谢,均值为1309157 个;常规功能预测,均值为1251161 个;氨基酸转运与代谢,均值为1203998 个;转录,均值为1120427 个;复制、重组与修复,均值为1071133个;翻译、核糖体结构及合成,均值为1023398 个;细胞壁/膜/被膜的生物合成,均值为825269 个;无机离子的转运与代谢,均值为741526 个,除微生物基本生命活动外,代谢活动主要以氨基酸代谢和碳水化合物代谢为主。本研究与夏亚男[24]、Chen Chen[25]等采用宏基因组分析酒药中微生物多样性的结果一致,在酒药所有活性代谢途径中,碳水化合物代谢和氨基酸代谢最为活跃,而碳水化合物代谢和氨基酸代谢这两类代谢通路与风味物质形成密切相关。

图9 细菌基因COG功能分类Fig.9 COG functional classification of bacterial genes
2.2.5.2 KEGG 数据库注释分析
通过与KEGG数据库进行对比可知(表3),共注释到6 类一级代谢通路,在二级代谢通路中共注释到42 个子功能组成,表3为代谢通路丰度值前22 位的结果。

表3 乳清酒酒样细菌α多样性指数测定结果Table 3 α-Diversity indexes of bacteria in whey wine
富集差异表达基因最多的8 个KEGG通路包括膜运输(2171276)、碳水化合物代谢(1856934)、氨基酸代谢(1444883)、复制和修复(1367350)、翻译(924207)、特征差(862876)、能量代谢(742465)、核苷酸代谢(742042)。其中,碳水化合物代谢及氨基酸代谢是最主要的两类代谢活动,与COG功能注释结果一致。具体地,碳水化合物代谢主要包括三羧酸循环、糖酵解和磷酸戊糖途径等,可产生大量的乙酸、柠檬酸等风味中间代谢产物[26]。氨基酸可以在酶的作用下产生风味成分[27],由此推测,乳清酒的主要风味物质来源于碳水化合物代谢和氨基酸代谢途径。
2.3 细菌与风味物质相关性分析
由图10可知,大多数的风味物质与Lactococcus和Raoultella呈正相关,其中Lactococcus和Raoultella与乙酸苯乙酯(A4)、癸酸乙酯(A8)、己酸乙酯(A17)、乙酸乙酯(A20)呈显著正相关,说明Lactococcus和Raoultella与这些物质的合成有关。Lactobacillus与柠檬醛(B11)、辛酸(E5)、癸酸(E7)、4-乙基苯酚(F8)、庚酸乙酯(A6)、癸酸甲酯(A9)、油酸乙酯(A11)、水杨酸甲酯(A13)、壬酸乙酯(A16)、十一酸乙酯(A22)、辛酸异戊酯(A25)和癸酸异戊酯(A29)呈正相关。Meng Yuecheng等[28]研究牛乳发酵过程中挥发性风味物质与核心微生物关联分析时发现,乳酸杆菌与酸类、酯类物质之间呈正相关。
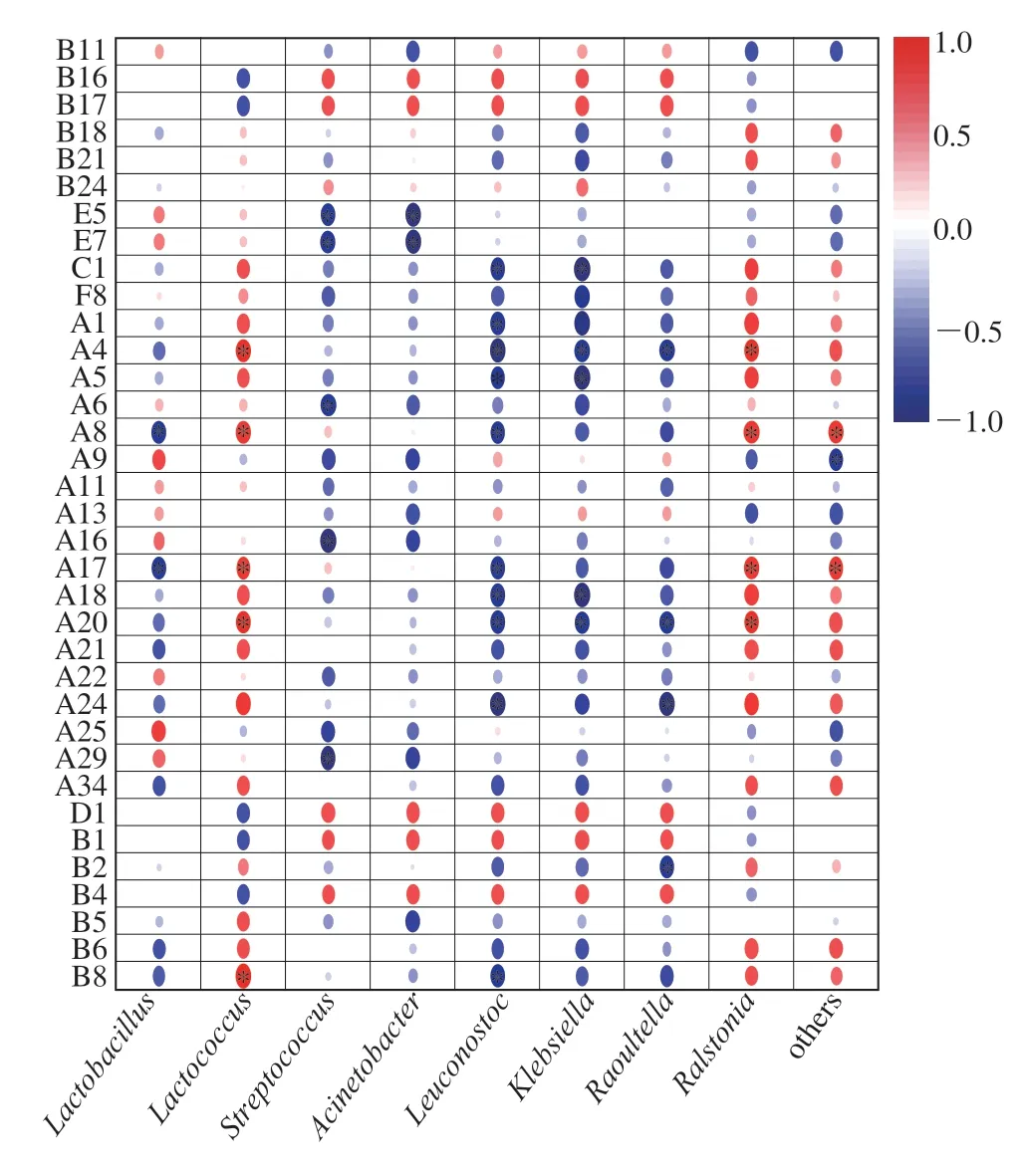
图10 乳清酒细菌与风味物质的相关性Fig.10 Correlation between bacteria and flavor substances in whey wine
Streptococcus与酯类等风味化合物呈负相关可能与糖苷酶水解风味物质引起的变化有关[29]。Acinetobacter在酸马奶的发酵中也与大多数物质呈负相关[10],与物质之间的分解作用有关。Leuconostoc可进行乳酸菌异型发酵产酸,营造酸性环境[30],与酸类和酯类物质呈负相关。Klebsiella可产生脂肪酶,赋予发酵酒饱和柔软的香气[31]。
3 结论
通过采用高通量测序技术和PICRUSt软件分析乳清酒的细菌多样性及对细菌类群的基因功能进行了预测,采用GC-MS分析了乳清发酵酒中重要香气成分的变化规律,并对二者进行相关性分析。研究表明乳清酒发酵过程中风味物质的数量整体增加,共检测出102 种挥发性风味物质,其中苯甲酸乙酯、乙酸苯乙酯、丁酸乙酯、庚酸乙酯、壬酸乙酯、乙酸乙酯、十一酸乙酯、棕榈酸乙酯、苯丙酸乙酯、癸酸异戊酯、壬醛、2-十一酮、辛酸、苯乙醇、4-乙基苯酚构成了乳清酒的重要香气成分。乳清酒发酵初期Lactobacillus为绝对优势菌群,随着发酵的进行Lactobacillus和Lactococcus成为绝对优势菌群。细菌功能预测表明,乳清酒代谢活动主要以氨基酸代谢和碳水化合物代谢为主。通过对二者的关联性分析得出:大多数风味物质与Lactococcus和Raoultella呈正相关,其中Lactococcus和Raoultella与乙酸苯乙酯、癸酸乙酯、己酸乙酯、乙酸乙酯呈显著正相关。Lactobacillus与柠檬醛、辛酸、癸酸、4-乙基苯酚、庚酸乙酯、癸酸甲酯、油酸乙酯等呈正相关。因此,构建良好的细菌群落有利于提升酿造乳清酒的品质。

