胰凝乳蛋白酶SplB在枯草芽孢杆菌中的重组表达及应用
潘丽洁,王 斌,潘 力
(华南理工大学生物科学与工程学院,广东省发酵与酶工程重点实验室,广东 广州 510006)
蛋白酶是目前重要的工业酶,约占全球酶总销量的60%,具有极高的商业价值[1],在食品发酵、脱苦、烘焙等行业有重要的应用[2-5]。其中,胰蛋白酶(EC 3.4.21.4)属于丝氨酸蛋白酶,作为专一性切割的碱性水解酶,应用于食品加工、生物医药、皮革加工等领域[6-7]。胰蛋白酶最早在动物胰脏中发现,作用是降解或活化其他蛋白酶原[8-9]。最初认为胰蛋白酶只存在于脊椎和无脊椎动物中,随着研究的深入,胰蛋白在原核和真核微生物中被发现[10-11]。通过微生物发酵获得的胰蛋白酶浓度相对较高、易提纯,因此通过微生物重组表达各种来源的胰蛋白酶成为当前趋势[12-16]。
来自金黄色葡萄球菌的胰凝乳蛋白酶SplB属于丝氨酸蛋白酶家族,是胰蛋白酶样蛋白酶。该蛋白具有严谨的WELQut特异性切割活性,是一种理想的N端标签切除酶。Reed等[17]首次发现并获得该蛋白的氨基酸序列。Popowicz等[18]通过大肠杆菌异源表达了蛋白酶SplB,并通过不同的表达方式确定该蛋白酶与其他胰蛋白一样,改变N端氨基酸会极大的影响其活性。Dubin等[19]通过枯草芽孢杆菌表达蛋白酶SplB,分离纯化后最终产量为2.5 mg/L。通过构建并水解底物库,发现蛋白酶SplB特异性识别WELQ(色氨酸-谷氨酸-亮氨酸-谷氨酰胺)肽段并切割,同时通过X射线衍射揭示了SplB扭曲的活性中心,虽然折叠方式与胰凝乳蛋白酶相似,但SplB不需要前肽水解重排活性中心[20]且活性中心的空间位置使蛋白酶有与其他胰蛋白酶不同的切割倾向。Pustelny等[21]在WELQ肽段两端连接发光基团GST、YFP,并在WELQ肽段后添加不同氨基酸,确定了蛋白酶SplB不仅对P1位置严格限制,同时对P1’位置也有偏好性。在P1’位置,SplB更喜好极性不带电氨基酸,如谷氨酰胺和天冬酰胺;其次是侧链较小的氨基酸如甘氨酸和丙氨酸;而含有较大侧链的疏水性氨基酸是最不利于反应的。丁晨等[22]在枯草芽孢杆菌中表达了该蛋白,并筛选了最佳的诱导表达条件。取诱导前菌液OD600nm2.0、IPTG浓度0.5 mmol/L、诱导4 h时,获得最高的表达量,纯化后每升发酵液获得16 mg蛋白,对比Dubin等[19]在枯草芽孢杆菌中的表达,其产量提升了6 倍。在蛋白酶的最适反应条件方面,Dubin等[19]以明胶、弹性蛋白、胶原蛋白、白蛋白和酪蛋白的荧光标记衍生物为底物,测定蛋白酶SplB的酶学性质,确定了SplB的最适pH值为8.0~8.5,在pH 7.0和pH 9.0时活性下降到50%。最适反应温度在37~42 ℃之间,当温度超过50 ℃,或低于15 ℃时,酶活力开始下降[19]。
由于蛋白酶SplB应用在蛋白的标签切割时,反应时间较长,商品酶反应时间在1~16 h。因此在设置反应条件时,应贴合被切割蛋白的最佳保存条件,以最大程度保护被切割蛋白的生物活性。目前有关SplB的报道中,鲜见对蛋白酶SplB温度以及pH值耐受性等酶学性质进行完整研究的文献,这严重限制了蛋白酶SplB的实际应用场景。
因此,本研究利用自主研发的枯草芽孢杆菌宿主ATCC 6051Δ10和商业化宿主WB800,通过优化表达元件,进行胰凝乳蛋白酶SplB的重组表达,并进一步研究重组SplB的酶学性质,构建SplB在重组蛋白Prx标签切割中的应用体系,旨在为研究蛋白酶SplB在实际应用中存在的问题提供解决思路。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与质粒
本研究使用的菌株及质粒见表1。

表1 菌株及质粒表 1 List of strains and plasmids used in this study
1.1.2 试剂
2×Premix PrimerSTAR Mix 日本TaKaRa公司;2×NEBuilder HiFi DNA Assembly Cloning Kit 美国纽英伦生物技术公司;pMD-20 T载体/pMD-18 T载体日本TaKaRa公司;琼脂糖 西班牙Biowest公司;聚合酶链式反应(polymerase chain reaction,PCR)产物回收试剂盒 广州美基生物科技公司;质粒小量提取试剂盒美基生物科技公司;WELQ-对硝基苯胺(4-nitroanilide hydrochloride,pNA)、N-苯甲酰基-DL-精氨酰-4-硝基苯胺盐酸盐(N-benzoyl-DL-arginine-4-nitroanilide hydrochloride,BApNA) 南京肽业生物科技有限公司。
1.1.3 培养基
Luria-Bertani(LB)培养基:取1 g氯化钠、1 g胰蛋白胨、0.5 g酵母提取物,加入去离子水定容至100 mL,搅拌溶解后,调pH 7.0,固体培养基则再加入2 g琼脂糖,121 ℃、20 min灭菌;SOC培养基:取3.14 g SOC粉末,加入去离子水定容至100 mL,搅拌充分溶解,116 ℃、30 min灭菌。
1.2 仪器与设备
垂直蛋白电泳系统、DNA凝胶电泳系统 美国Bio-Rad公司;蛋白层析纯化仪 苏州赛谱仪器有限公司;5 mL镍柱 美国Healthcare公司;多功能酶标仪 德国BMG公司;96 孔酶标板 美国康宁公司;电转仪达科为生物技术股份有限公司;高速冷冻离心机 德国Eppendorf公司。
1.3 方法
1.3.1 以pBEs101质粒为基础构建表达载体骨架
实验室保藏质粒pBEs101包括双启动子P43P43、信号肽SamyQ、RBS位点、终止子Ter、枯草芽孢杆菌表达载体通用骨架pBE。通过酶切去除重复启动子,获得单P43通用载体pBEs1011,通过XhoI和XbaI双酶切获得表达载体骨架。
1.3.2SplB表达载体构建及转化
根据UniProt上SplB氨基酸序列,经过枯草密码子优化后送至南京金斯瑞生物科技有限公司合成目的基因,根据序列信息设计引物PCR扩增分别获得N端带Histag、C端带His-tag和不带His-tag的3 种目的基因SplB片段(SplB、SplB-His、His-SplB),通过无缝克隆技术(2×NEBuilder HiFi DNA Assembly Cloning Kit)表达载体骨架获得SplB的表达载体。通过更换表达载体的启动子(PamyX、PamyLPspovG、PxylR),构建不同启动子的SplB表达载体。表达载体转化大肠杆菌,大肠杆菌感受态通过SOC培养基复苏,并进行测序验证,使用LB培养基培养克隆正确的转化子。验证正确的表达载体转化枯草芽孢杆菌ATCC 6015Δ10、WB800,将转化子转接装有LB培养基(含卡那霉素)的24 孔板中,37 ℃、220 r/min培养24 h后收集菌体、提取基因组DNA,进行PCR扩增筛选阳性转化子。
1.3.3 SplB重组菌株发酵培养
从-80 ℃冰箱取出一管保藏的菌液,接入3 mL含有卡那霉素的LB培养基,37 ℃、220 r/min培养16 h,作为一级种子液。取1 mL转接入20 mL含有卡那霉素的LB培养基,37 ℃、220 r/min培养9~10 h,使菌液处于对数生长期,作为二级种子液。取二级种子液测菌液OD600nm值,并按等OD600nm值将二级种子液接入100 mL LB摇瓶培养基中(约5%接种量),37 ℃、220 r/min培养24 h,结束发酵。
1.3.4 胰凝乳蛋白酶活力测定
参照Yang Ning等[23]方法设计底物WELQ-pNA,底物由南京肽业生物科技有限公司合成。为了更好地对比不同条件下酶活力的差异,参考林晓彤[24]的方法,定义每分钟水解底物产生1 μg pNA所需的酶量为1 个酶活力单位。
1.3.4.1 pNA标准曲线的绘制
取1 g左右pNA于烘箱中彻底烘干,烘干后用分析天平精确称量0.1381 mg pNA,溶于30 mL水中,后定容至1 L,得到1 mmol/L pNA母液。后将母液稀释至0、0.02、0.04、0.06、0.08、0.1、0.12 mmol/L。吸取200 μL混合液置于96 孔酶标板,测405 nm波长处的吸光度。以吸光度为横轴、浓度为纵轴,绘制标准曲线。
1.3.4.2 酶活力测定
酶活力测定实验均重复3 次,且采用方差分析其差异显著性,P>0.5表明实验结果可靠。将酶液均分于两个EP管中,每管200 μL分别为实验组和对照组。实验组于40 ℃水浴保温,对照组在沸水浴15 min使之失活。实验组与对照组皆在40 ℃水浴保温5 min,取出加入750 μL Tris-HCl(100 mmol/L,pH 8.0),加入50 μL 10 mmol/L的WELQ-pNA溶液,吹吸混匀。对照组提前加入100 μL 50%乙酸溶液,终止反应。将实验组与对照组皆置于40 ℃水浴反应30 min,取出反应液,在实验组中加入100 μL 50%乙酸溶液,结束反应。吸取200 μL反应液于酶标板,每个反应测3 组。用酶标仪测405 nm波长处的吸光度。酶活力计算公式如下:

式中:A为实验组与对照组平均吸光度差对应标准曲线计算得到的pNA浓度/(mmol/L);138.12为pNA分子质量(g/mol);N为发酵液稀释的倍数;5.5为反应总体系对酶液的稀释倍数;T为反应时间/min。
1.3.5 蛋白纯化与酶学性质检测
1.3.5.1 蛋白纯化
发酵液预处理:将枯草芽孢杆菌发酵液均分于100 mL离心管中,配平,4 ℃、12000 r/min离心10 min,收集上清液。用0.45 μm滤头过滤上清夜,该步骤于冰上操作。
镍柱亲和层析:ddH2O冲洗系统,冲洗至紫外线水平,装镍柱;Buffer A液冲洗柱子至基线平衡。上蛋白粗酶液约30 mL,并收集上样峰;5% Buffer B液洗脱杂蛋白,后按10%梯度递增Buffer B液,洗脱蛋白,并收集各个组分出峰时的流出液。
1.3.5.2 酶学性质
温度对SplB活力的影响:在pH 8.0条件下,4~70 ℃范围内,测定不同温度条件下SplB活力,确定最适反应温度。
pH值对SplB活力的影响:在最适反应温度条件下,pH 2.0~11.0范围内测定SplB活力,确定最适反应pH值。体系中的底物与酶液量不变,反应缓冲液替换为不同pH值的缓冲液。其中pH 2~6、10~11为Btitton-Robinson缓冲液,pH 7~9由Tris-HCl配制。
SplB热稳定性:将纯化后SplB酶液稀释一定倍数,在10~70 ℃范围的水浴锅和金属浴中孵育0~4 h,在最适反应温度和最适pH值下,测定孵育不同时间后SplB活力。SplB pH值稳定性:于4 ℃冰箱中,将纯化后的酶液在pH 2.0~12.0范围的冲液中孵育7 d,每隔一段时间取出一部分酶液,在最适条件下测定孵育不同时间后SplB活力。
金属离子和化学物质对SplB活力的影响:用pH 8.0的Tris-HCl配制K+、Na+、Mg2+、Ca2+、Zn2+、Cu2+等金属离子溶液,获得500 mmol/L母液;后再根据需要稀释成50 mmol/L和5 mmol/L浓度的溶液。用pH 8.0的Tris-HCl配制不同化学物质母液(乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)),使得各种化学物质浓度分别为100、20 mmol/L和20 mmol/L。再根据需要稀释成不同浓度溶液。反应体系为700 μL Tris-HCl(100 mmol/L,pH 8.0),加入50 μL 10 mmol/L的WELQ-pNA、50 μL酶液、50 μL不同稀释度的离子或化学溶液,在最适反应温度与pH值下测定SplB活力。
1.3.6 蛋白酶SplB在标签切割中的应用
1.3.6.1 TrxA标签蛋白的构建
为验证蛋白酶SplB的实际应用价值,构建了一种N端带有TrxA标签的过氧化物酶Prx,且在Prx与TrxA之间加入WELQ肽段,以验证SplB切割TrxA标签的效果。将过氧化物酶Prx构建到pET32a载体,在Prx的C端添加His-tag,转化大肠杆菌构建Prx大肠杆菌工程菌株。通过镍柱亲和层析获得胞内表达的蛋白Prx,并通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)鉴定目的蛋白。
1.3.6.2 SplB蛋白切割Prx的应用
通过BCA试剂盒测定蛋白浓度,按100∶1、50∶1、20∶1、10∶1、5∶1的比例添加Prx与SplB,室温反应20 h。聚丙烯酰胺凝胶电泳,确定最佳反应比例。反应结束后通过SDS-PAGE分析切割效果。
1.4 数据处理
酶活力实验均复3 次,取其平均值,且采用方差分析其差异显著性,P>0.5表明实验结果可靠,并通过Origin绘制图表。
2 结果与分析
2.1 胰凝乳蛋白酶SplB的重组表达及表达元件、宿主优化
2.1.1 胰凝乳蛋白酶SplB的生物信息学分析
金黄色葡萄球菌丝氨酸蛋白酶SplB,在MEROPS蛋白酶数据库分类为胰凝乳蛋白酶家族S1(Family S1)中S1B亚家族的特征性肽酶S01.282,搜寻了Uniprot数据库中注释为丝氨酸蛋白酶SplB的基因,并同时在Swiss-Prot注释过的14 个SplB基因进行同源比对(图1)。丝氨酸蛋白酶SplB包含240 个氨基酸,其中前36 个氨基酸为信号肽(图中粉红色标注),其催化活性中心为催化三联体组氨酸、天冬氨酸和丝氨酸(75H、113D、193S,图中红色标注),活性中心保守。其中,Uniprot Q2FXC3的丝氨酸蛋白酶SplB已完成了晶体结构解析[20]。SplB属于胰凝乳蛋白酶家族,一般而言,胰凝乳蛋白酶酶原通过水解N端前肽,重排活性中心的结构激活,只有精确的N末端加工才能释放野生型蛋白酶的全部水解活性,但激活蛋白酶SplB的分子机制存在显著差异,其酶原和成熟体的晶体结构比较未发现活性位点重排,但是天然信号肽或任何N端延伸对SplB具有抑制作用[18]。

图1 Uniprot数据库中注释为SplB基因的同源比对Fig.1 Homologous alignment of the SplB gene annotated as a serine protease in the Uniprot database
2.1.2 His-tag位置对SplB活力的影响
为了重组SplB的纯化,需要在重组蛋白上添加Histag。分别构建了N端、C端添加His-tag的重组SplB菌株。重组菌株发酵上清液酶活力测定结果显示(图2),N端带His-tag的酶活力最低,而C端带His-tag的菌株与不带His-tag的菌株酶活力差别不大,这与文献[19,25]的结论一致,即SplB的N端是其重要结构域,而C端相对不重要。
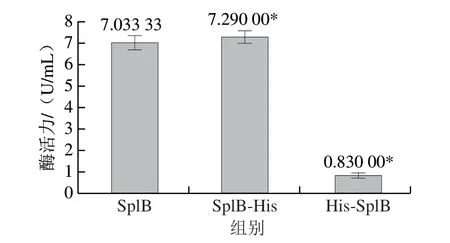
图2 3 种表达方式的SplB活力测定Fig.2 Enzyme activities of SplB gene transformants with His-tag at different terminals
2.1.3 重组SplB的表达元件及宿主优化
为提高SplB的表达水平,对重组表达宿主和启动子进行了筛选。分别构建了以P43、PamyX、PamyLPspovG、PxylR作为启动子的SplB表达载体,分别转化枯草芽孢杆菌宿主菌WB800、ATCC6051Δ10。对所得重组SplB菌株进行发酵并测定发酵液的酶活力,图3、4结果显示,相同启动子的重组菌株在发酵相同时间条件下,以ATCC6051Δ10作为宿主的重组菌株酶活力均高于以WB800为宿主的菌株,说明ATCC6051Δ10宿主更适合蛋白酶SplB的表达。同时,启动子P43介导的SplB重组表达活力最高,达到10.24 U/mL。

图3 不同宿主发酵液SplB活力测定Fig.3 Enzyme activities of SplB expressed in different hosts

图4 不同宿主发酵液SDS-PAGE图Fig.4 SDS-PAGE patterns of SplB expressed in different hosts
2.2 重组SplB的纯化与酶学性质
2.2.1 重组SplB的纯化及最适反应条件分析
通过His-tag亲和纯化重组SplB菌株的发酵上清液,纯化过程见图5,SDS-PAGE结果显示发酵上清液纯化过程中的峰2、峰3洗脱液为杂蛋白,峰4为目标蛋白SplBHis,蛋白酶SplB在40% Buffer B处出峰,对应的咪唑洗脱浓度为200 mmol/L。
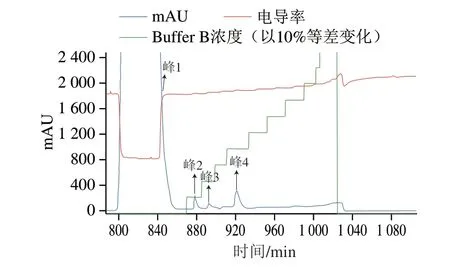

图5 SplB-His蛋白酶洗脱峰与SDS-PAGE图Fig.5 Chromatographic separation and SDS-PAGE pattern of SplB
图6结果显示,重组SplB的最适反应温度为40 ℃,且在10~60 ℃范围内可维持80%以上酶活力,酶活力变化不明显。重组SplB的最适反应pH值为8.5,在pH 7~9.5范围内酶活力维持在80%以上。当pH值大于10或低于5时,酶活力急剧下降。从该结果看,SplB的适用温度与pH值范围宽广,应用潜力高,具有较大的商业应用价值。

图6 SplB蛋白酶最适温度及pH值Fig.6 Optimal temperature and pH of SplB protease
2.2.2 重组SplB的稳定性
图7结果显示,在不同温度下温育相同时间,其酶活力变化趋势一致。并且短时间内,60 ℃孵育可小幅提高酶活力。继续孵育后酶活力开始下降,但下降幅度较小,同条件下10 ℃、5 h孵育酶活力下降最大,降至74%。说明温度对SplB活力影响不大,SplB可在不同温度条件下保留较长时间而极少损失酶活力,具有非常好的温度稳定性。pH值稳定性结果显示,除在pH 8.0条件下,SplB在其他pH值条件下温育4 h时,酶活力反而升高,其中中性条件下酶活力涨幅最大,达到初始酶活力的124%。之后酶活力慢慢下降。并且下降幅度较小,其中酶活力下降最多的条件为pH 8.0温育100 h,酶活力下降为初始酶活力的86%。以上结果说明重组蛋白酶SplB具有非常好的pH值稳定性,特殊pH值条件孵育较短时间甚至可以提高相对酶活力,此性能赋予SplB较广的应用场景,提高了SplB的商业应用潜力。

图7 SplB蛋白酶pH值与温度耐受性Fig.7 pH and temperature tolerance of SplB protease
2.2.3 金属离子与化学试剂对重组蛋白酶SplB活力的影响
为研究金属离子与化学试剂对重组SplB活力的影响,用溶解了离子和化学试剂的Tris-HCl(pH 8.0)缓冲液稀释蛋白酶液作为实验组,以未溶解离子和化学试剂的Tris-HCl(pH 8.0)缓冲液稀释蛋白酶液作为对照组,对照组酶活力设为100%。在离子浓度比较高(5 mmol/L)的情况下(表2),金属离子对其活力都有抑制作用。在离子浓度较低情况下,Co2+对SplB活力有促进作用,Mg2+、K+不影响酶活力。而Cu2+、Zn2+、Ni+离子抑制SplB活力,其中,Ni+在低浓度下(1 mmol/L)下抑制作用不明显,浓度升高后,抑制作用同时提高。另外,SDS可以极大地抑制重组SplB的酶活力,而传统的丝氨酸蛋白酶抑制剂PMSF却对重组SplB活力有促进作用。

表2 不同浓度离子和化学物质对重组SplB相对酶活力的影响Table 2 Effects of metal ions and chemical reagents on the activity of recombinant SplB%
2.3 重组蛋白酶SplB在重组蛋白Prx标签切割中的应用
2.3.1 带标签的Prx重组蛋白的纯化
为了获得纯化的带标签蛋白Prx,进行蛋白标签的切割。通过超声破碎Prx大肠杆菌工程菌,获得胞内表达的Prx蛋白溶液。重组Prx蛋白的N端带有His-tag,大小为39.7 kDa,通过镍柱亲和层析纯化该蛋白。SDS-PAGE结果显示(图5),当Buffer B达到70%时,蛋白被洗脱,且在80%、90%均有洗脱峰,70%洗脱浓度最大。
2.3.2 重组蛋白酶SplB应用于切割Prx蛋白标签
将SplB与带有WELQ肽段的Prx蛋白按不同质量浓度混合,室温反应20 h,通过SDS-PAGE检测切割效果,以确定蛋白酶SplB的作用。Prx与SplB添加量见表3。WELQ肽段添加在Prx与TrxA基因之间(图8A),使得酶切蛋白大小分别为18.15、21.12 kDa。切割结果显示(图8B),蛋白酶SplB具有标签切割作用,并且蛋白酶SplB浓度越高,酶切效果越好。

表3 重组Prx蛋白与SplB蛋白的添加量Table 3 Dosages of recombinant Prx and SplB μL

图8 重组蛋白酶SplB在重组蛋白Prx标签切割中的应用Fig.8 Application of recombinant SplB in the tag digestion of recombinant protein Prx
2.4 重组蛋白酶SplB与商品酶在重组蛋白Prx标签切割中的对比
为了对比商品酶和重组蛋白酶SplB的切割效率,将商品酶稀释至与SplB相同的浓度,分别和带有WELQ肽段的Prx蛋白按1∶5混合,并延长反应时间至48 h,通过SDS-PAGE检测切割效果,图9显示,两组Prx蛋白都被切割为短肽,且蛋白酶SplB的标签切割效果与商品酶相近。说明本研究获得的蛋白酶SplB与在售商品酶性质相当。
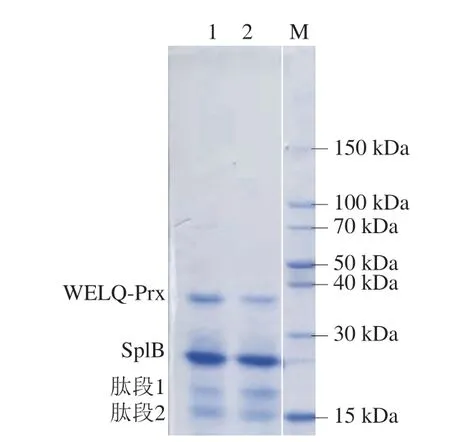
图9 重组蛋白酶SplB与商品酶在重组蛋白Prx标签切割中的对比Fig.9 Comparison of SplB and commercial enzyme in tag cleavage of recombinant protein Prx
3 讨论
胰蛋白酶从被发现开始,在食品、药品等领域就获得广泛应用。因自然界中发现的大多数胰蛋白酶来源于哺乳动物,产量低,纯化复杂,使得重组蛋白酶的研究成为一大热点。哺乳动物来源的胰蛋白酶,因自身蛋白修饰系统复杂,难以在细胞结构相对简单的微生物中大量表达,同时哺乳动物来源蛋白酶在药品领域,始终存在容易引发免疫应答的风险。Yee等[26]通过大肠杆菌重组表达了鼠来源的胰蛋白酶;Viader-Salvadó等[27]在毕赤酵母中重组表达了对虾来源的胰蛋白酶。微生物异源表达胰蛋白酶解决了其纯化困难与免疫原性的问题,但动物来源胰蛋白在微生物中产量相对于其他的蛋白酶仍旧低下。因此,寻找微生物来源的类胰蛋白酶,大量表达代替动物来源的胰蛋白酶,具有非常重要的研究价值。蛋白酶SplB来源于金黄色葡萄球菌,是一种致病菌,本研究利用实验室自主研发的枯草芽孢杆菌宿主,表达重组胰蛋白酶。根据Guan Chengran等[28]的研究,枯草芽孢杆菌为食品安全菌,且在表达碱性蛋白上具有优势以枯草芽孢杆菌为宿主,在解决安全性的同时,确保了重组蛋白酶的表达水平(粗酶液活力10.24 U/mL)。本研究通过枯草芽孢杆菌表达纯化获得蛋白酶SplB,以研究其酶学性质。
重组SplB的最适反应温度为40 ℃,最适反应pH值为8.5,与Popowicz等[29]研究结果一致。本研究获得的蛋白酶SplB在温度10~60 ℃、pH 7~9.5范围内可维持80%以上酶活力,酶活力变化不明显。而Popowicz等[29]研究结果表明蛋白酶在pH 7.0和pH 9.0时活性下降到50%;在温度超过50 ℃,或低于15 ℃时,酶活力开始下降,相比之下本研究获得的蛋白酶SplB温度和pH值适用范围更广。造成该现象的原因尚未可知,在Pustelny等[21]研究中,蛋白酶SplB对底物的空间位阻有所要求,以及P1’位置的氨基酸有偏好性,因此笔者推测两者使用的底物不同造成了数据差异。除Co2+、Cu2+、Zn2+外,多数阳离子以及金属螯合剂EDTA-Na2对蛋白酶SplB活力无显著影响。值得注意的是,常见的胰蛋白酶抑制剂PMSF对蛋白酶SplB无抑制作用,该结果与已有研究[29-30]结论一致。
为模拟蛋白酶SplB的真实应用场景,本研究设计了带有WELQ标签的重组Prx蛋白。通过酶切实验发现,该蛋白在实际应用中的标签切割效率较低,实际反应时间较长,且单次蛋白酶用量高。因此在反应过程中,应尽量将反应条件保持在适合被切割蛋白保存的范围内。根据本研究获得的酶学性质数据,重组蛋白酶SplB广泛的温度和pH值适应性以及高度温度和pH值耐受稳定性、对盐离子的耐受性等性质,为蛋白酶SplB在实际场景中的灵活选择提供参考。同时,蛋白酶SplB的高度稳定性,表明该蛋白重复利用的可行性。继续研究蛋白的回收再利用以减少单次使用成本,同时减少对被切割蛋白的污染,可以进一步提高该蛋白在商业应用中的潜力。
胰凝乳蛋白酶类蛋白酶属于丝氨酸家族,是一种具有专一性水解活性的碱性内肽酶。SplB为非典型胰凝乳蛋白酶,无前肽,胞外表达的蛋白酶即为活性酶,且具有WELQ肽段专一性识别与切割活性。本研究通过启动子优化、宿主筛选,成功重组表达了丝氨酸蛋白酶SplB,对纯化的重组蛋白酶SplB酶学性质进行了研究,并实现了重组蛋白酶SplB在重组蛋白Prx标签切割中的应用。

