1 株耐热蜡样芽孢杆菌的鉴定及其缓解炎症性肠病的功效评价
许一凡,盛康亮,王永中
(安徽大学生命科学学院,安徽省人体微生态与精准医药重点实验室,安徽 合肥 230601)
蜡样芽孢杆菌(Bacillus cereus)是一种兼性厌氧的革兰氏阳性菌,在土壤、空气及动物肠道中普遍存在[1]。因其具有高度黏附性的内生孢子,常作为实验室培养或食品生产过程中的一种污染菌株被发现[2]。其一部分具有一定的毒性,会导致轻微的腹泻和呕吐症状[3],另一些则具有益生作用[4]。蜡样芽孢杆菌作为肠道益生菌易于加工便于贮存,具有调节肠道微生物组成、强耐酸性和热稳定性等特点,在肠道疾病的治疗领域具有广阔的开发前景[5]。
蜡样芽孢杆菌是“蜡样芽孢杆菌群”的成员之一,因该菌群成员之间有密切的进化关系,往往很难使用常规鉴定方法加以区分[6]。目前鉴定未知菌株的标准方法是16S rRNA测序辅以生理生化检测,但16S rRNA序列的分子质量小、保守性高,很多时候只能在属水平上鉴定细菌,生理生化检测过程繁琐,结果评价主观性强,只能作为分子鉴定的补充。因此,通过其他保守蛋白编码基因可进一步鉴定菌株。蛋白编码基因由于密码子兼并性的特点,其进化速度比16S rRNA更快,因此保守蛋白编码基因在系统发育分析时具有更高的分辨率[7]。对于亲缘关系十分接近的物种,采用多种保守蛋白编码基因联合鉴定可以进一步提高其分辨率[8]。其中gyrA和gyrB基因是常用于芽孢杆菌鉴定的保守蛋白编码基因[9-10]。蜡样芽孢杆菌因其特异性毒力基因的存在,在验证未知菌株是否为蜡样芽孢杆菌时,可以用其特异性的毒力基因进行分子水平验证[11]。
炎症性肠病(inflammatory bowel disease,IBD)是一种多发于结肠部位的慢性肠道疾病,临床症状以腹泻、血便及黏液脓血便为主。全球有数百万人受其影响,并且发病率还在迅速上升[12]。现在主流的化学药物疗法不能完全治愈的同时还伴随着极大副作用[13-14],因此安全无副作用的益生菌药物作为一种新的治疗方案开始被应用到IBD治疗。据报道在饲料中添加蜡样芽孢杆菌可以通过增强肠道屏障功能和降低炎症因子水平预防肠道炎症[15]。但蜡样芽孢杆菌对实验性小鼠结肠炎模型的积极作用尚未被评估。
本研究采用16S rRNA、保守蛋白编码基因(gyrA、gyrB)、蜡样芽孢杆菌特异性毒力基因(nheA、nheB、nheC、hblA、hblC、hblD、becT、cytK、entFM)及生理生化的方法对实验室未知菌株进行鉴定,并评价其生长特性及其对实验性小鼠结肠炎模型的干预改善作用,旨在探究该株蜡样芽孢杆菌在炎症性肠病中的潜在作用。
1 材料与方法
1.1 材料与试剂
实验菌株 安徽省人体微生态与精准医疗重点实验室;葡萄糖、胰蛋白胨、蛋白胨、酵母提取物、琼脂糖、琼脂粉、甘油、Tris、Taqmix 生工生物工程(上海)股份有限公司;NaCl、Na2EDTA-2H2O、冰乙酸、无水乙醇、二甲苯 国药集团化学试剂有限公司;KOD-Plus聚合酶 东洋纺(上海)生物科技有限公司;苏木素染色液、伊红染色液 上海碧云天生物技术有限公司。
1.2 仪器与设备
SPT-P290C智能生化培养箱 上海三发科学仪器有限公司;-80 ℃超低温保存箱 青岛海尔生物医疗股份有限公司;JS-680D凝胶成像系统 上海培清科技有限公司;DYY-2C水平电泳槽 北京六一仪器厂;ZQLY-180S振荡培养箱 上海知楚仪器有限公司。
1.3 方法
1.3.1 未知菌株的分离培养和纯化
用无菌接种环挑取未知菌株的单菌落,LB(Luria-Bertani)液体培养基于37 ℃恒温摇床中培养12 h。所得菌液稀释105倍后,将100 μL稀释菌液平板涂布于LB固体培养基上,在37 ℃恒温培养箱中倒置培养16 h,分析并记录污染菌株的菌落形态。再次挑取单菌落在同样条件下培养24 h,所得菌液与60%甘油-磷酸盐缓冲液以1∶1的比例混合,保存于-80 ℃冰箱。
1.3.2 分离菌的16S rRNA鉴定
使用革兰氏阳性菌基因组DNA提取试剂盒提取分离菌的基因组DNA,在生工生物工程(上海)股份有限公司合成16S rRNA扩增引物。上游引物序列:5’-AGAGT-TTGATCCTGGCTCAG-3’,下游引物序列:5’-AAGGAGGATCCAGCCGCA-3’[16]。聚合酶链式反应(polymerase chain reaction,PCR)条件与文献[17]一致,并将PCR产物通过凝胶电泳验证。验证无误后,将PCR产物送往生工生物工程(上海)股份有限公司测序。测序得到的分离菌序列在NCBI官网上使用BLAST工具进行同源性分析。
1.3.3 分离菌的保守蛋白编码基因鉴定
SnapGene软件设计保守蛋白编码基因gyrA和gyrB的上下游引物(表1)。以分离菌的基因组DNA为模板进行PCR,条件同1.3.2节。PCR产物通过凝胶电泳验证无误后,检测PCR产物序列并在NCBI官网上使用BLAST工具进行同源性分析。选取常见芽孢杆菌作为外群,通过MEGA7软件构建系统进化树,进行核酸同源性比对。

表1 蜡样芽孢杆菌保守蛋白编码基因和毒力基因的检测引物Table 1 Primers used for the amplification of conserved protein-coding genes and virulence genes in B.cereus
1.3.4 分离菌的毒力基因鉴定
合成蜡样芽孢毒力基因的上下游引物[18]见表1。使用1.3.2节的PCR条件以分离菌基因组DNA为模板进行PCR,扩增目的基因。PCR产物用10 g/L的琼脂糖凝胶进行凝胶电泳验证。
1.3.5 分离菌的生理生化鉴定
根据《常见细菌系统鉴定手册》的实验方法对分离菌形态学特征、生理生化指标及生长特性进行测定[19]。
1.3.6 动物实验分组及模型的建立
取体质量(20±2)g的健康雄性C57BL/6J小鼠30 只,自由进食和饮水的情况下,保持12 h的光周期在室温(25±0.5)℃、相对湿度(50±5)%环境下适应1 周,并随机分为3 组:空白对照组、结肠炎模型组(葡聚糖硫酸钠(dextran sulfate sodium,DSS)、蜡样芽孢杆菌干预组。每组含10 只小鼠,蜡样芽孢杆菌干预组小鼠灌胃菌悬液的剂量为2×108CFU,重悬于200 μL生理盐水中,灌胃时间为21 d,对照组与结肠炎模型组灌胃等量的生理盐水。第14~21天,给予结肠炎模型组和蜡样芽孢杆菌干预组2.5% DSS溶液自由饮用,用于实验性溃疡结肠炎小鼠模型造模,每天记录小鼠的粪便形状、便血状况和体质量的变化,对其进行疾病活动指数(disease activity index,DAI)打分[15]。本研究涉及动物的所有程序均按照实验动物护理和使用指南进行,并经安徽大学实验动物伦理委员会批准。
1.3.7 苏木精-伊红(hematoxylin-eosin,HE)染色
10%福尔马林溶液固定小鼠结肠组织样本,经石蜡包埋、切片、脱蜡、复水、苏木精染色、盐酸乙醇分化、伊红染色、脱水和封片后,倒置显微镜下观察并拍照记录。使用结肠组织的病理组织分级评分定量评估小鼠结肠组织的病理学改变[15]。
1.3.8 real-time PCR
按照TaKaRa公司的总RNA提取试剂盒说明书,提取小鼠结肠组织样本的总RNA。使用Synergy H1酶标仪测定RNA浓度,按反转录试剂盒的说明设计反转录体系,获得cDNA样品。根据TB Green®Premix ExTaqTMGC试剂盒的方法进行real-time PCR,基因引物见表S3[20-21]。所有基因均以GAPDH为对照基因,采用比较阈值法(2-ΔΔCt)进行相对定量。
1.4 数据处理与分析
2 结果与分析
2.1 分离菌16S rRNA鉴定结果
16S rRNA测序结果显示,分离菌16S rRNA片段长度为1487 bp,对序列进行BLAST比对,得到多株不同的芽孢杆菌与分离菌亲缘性超过99%(表2)。说明16S rRNA鉴定显示分离菌是芽孢杆菌属的成员之一,进一步鉴定出分离菌的种系需要采用分辨率更高的鉴定方法。

表2 16S rRNA序列同源性比对结果Table 2 Results of homology alignment of 16S rRNA sequences
2.2 分离菌保守蛋白编码基因鉴定结果
将测序得到的分离菌gyrA和gyrB基因序列与NCBI官网上常见芽孢杆菌的gyrA和gyrB基因序列通过MAGA7软件生成系统进化树,gyrA和gyrB的系统进化树结果都显示,分离菌与蜡样芽孢杆菌和苏云金芽孢杆菌种系的亲缘关系较近,和其他芽孢杆菌种系的亲缘关系较远(图1)。根据保守蛋白编码基因鉴定可以得出分离菌属于蜡样芽孢杆菌或苏云金芽孢杆菌。

图1 分离菌的保守蛋白编码基因gyrA(A)和gyrB(B)的系统发育树Fig.1 Phylogenetic trees for the strain based on conserved protein-coding genes gyrA (A) and gyrB (B)
2.3 分离菌的毒力基因鉴定结果
分离菌的蜡样芽孢杆菌特异性毒力基因PCR产物进行琼脂糖凝胶电泳验证,每个重复2 次,结果显示,扩增产物条带与NCBI官网上对应蜡样芽孢杆菌特异性毒力基因的大小相符(图2),可以证明分离菌基因组中含有蜡样芽孢杆菌特异性的毒力基因。蜡样芽孢杆菌特异性毒力基因鉴定的结果得出分离菌属于蜡样芽孢杆菌。

图2 分离菌株蜡样芽孢杆菌毒力基因PCR扩增产物的电泳结果Fig.2 Electrophoretic results of PCR amplification products of virulence genes in B.cereus
2.4 分离菌的生理生化鉴定结果
在LB固体培养基培养16 h后可以观察到分离菌株菌落较大,淡黄色、不透明,菌落近似圆形表面呈融蜡状,边缘呈扩展状(图3A)。倒置显微镜下分离菌革兰氏染色结果为阳性,芽孢呈杆状,不规则排列(图3B)。生理生化的鉴定结果如表3所示,经对照分离菌生理生化特性与《常见细菌系统鉴定手册》中蜡样芽孢杆菌的生理生化性质一致[19],佐证了分子鉴定的结果。故将分离菌命名为蜡样芽孢杆菌HMPM18123,并保藏于广东省微生物菌种保藏中心(GDMCC)。

图3 分离菌的菌落(A)及芽孢形态(B)Fig.3 Colony (A) and spore morphology (B) of B.cereus HMPM18123

表3 分离菌株生理生化实验结果Table 3 Physiological and biochemical characteristics of B.cereus HMPM18123
对蜡样芽孢杆菌HMPM18123别进行耐酸、耐高温和胃液肠液耐受测试,发现其在pH 5和pH 6的环境中生长旺盛,在pH 4以下的环境不能繁殖(图4A)。该菌株在30 ℃和40 ℃时繁殖旺盛;50 ℃和60 ℃时繁殖缓慢;70 ℃时则不能生长(图4B)。另外,在50 ℃和60 ℃环境下培养72 h后转入37 ℃正常培养24 h繁殖速度可以立即恢复,70 ℃培养72 h的菌株再转入37 ℃正常培养也无法继续生长(图4C)。蜡样芽孢杆菌HMPM18123在人工胃液中前2 h存活率接近100%,3 h后依然有半数存活(图5A);分离菌接种到人工肠液中3 h后活菌数不变(图5B)。以上结果表明蜡样芽孢杆菌HMPM18123具有良好的耐热和胃液肠液耐受特性。

图4 蜡样芽孢杆菌HMPM18123的耐酸耐高温生长特性Fig.4 Acid resistance and high temperature resistance of B.cereus HMPM18123

图5 蜡样芽孢杆菌HMPM18123在人工胃液和人工肠液中的存活率Fig.5 Survival rate of B.cereus HMPM18123 in simulated gastric fluid and simulated intestinal fluid
2.5 蜡样芽孢杆菌HMPM18123对实验性结肠炎小鼠的干预作用
结肠炎模型组小鼠相比对照组小鼠体质量持续降低(图6A),DAI评分持续增高(图6B),结肠长度明显缩短(图7)。蜡样芽孢杆菌HMPM18123干预后可以显著缓解小鼠结肠炎导致的体质量下降、DAI评分上升和结肠长度缩短的情况。

图6 各实验组小鼠的体质量(A)及DAI评分(B)变化Fig.6 Changes in body mass (A) and DAI score (B) of mice in normal control,DSS-induced colitis and B.cereus HMPM18123 intervention groups

图7 各实验组小鼠的结肠照片(A)及结肠长度对比(B)Fig.7 Colonic photos (A) and colonic length (B) of mice in normal control,DSS-induced colitis and B.cereus HMPM18123 intervention groups
如图8A所示,对照组小鼠结肠黏膜层及隐窝结构正常,且无炎症细胞浸润发生。模型组结肠组织出现隐窝缺失、炎症细胞浸润、黏膜损伤和黏膜下层薄壁水肿。相比之下,蜡样芽孢杆菌HMPM18123干预组一定程度上恢复了结肠炎小鼠的结肠组织完整性。此外,结肠组织病理评分结果表明(图8B),干预组小鼠结肠组织损伤显著减轻。以上证据表明,蜡样芽孢杆菌HMPM18123可以缓解DSS诱导的小鼠结肠炎。
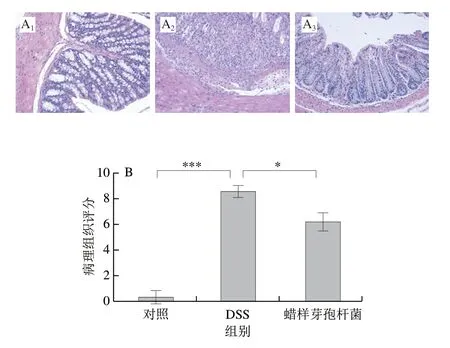
图8 各实验组小鼠的结肠HE染色照片及病理分析结果Fig.8 HE staining photos and pathological analysis of colon tissues of mice in normal control,DSS-induced colitis and B.cereus HMPM18123 intervention groups
2.6 蜡样芽孢杆菌HMPM18123对结肠炎小鼠炎症及抑炎因子基因表达的影响
检测各实验组小鼠结肠组织中炎症及抑炎因子的基因表达水平,定量评价小鼠结肠炎症的程度。如图9所示,模型组小鼠结肠组织相比对照组炎症因子IL-6、TNF-α和IL-1β基因表达水平显著上调。蜡样芽孢杆菌HMPM18123干预后显著下调了小鼠结肠组织中炎症因子mRNA的表达水平,并且显著提高了抑炎因子IL-10的表达水平。以上结果表明蜡样芽孢杆菌HMPM18123可以下调炎症因子表达并上调抑炎因子表达减轻肠道炎症反应。


图9 各实验组小鼠结肠炎症及抗炎因子基因的表达量Fig.9 Expression levels of pro-inflammatory and anti-inflammatory factor genes in colon tissues of mice in each experimental group
3 讨论
16S rRNA基因序列对比是细菌鉴别和构建细菌的系统发育进化树最有效的方法。然而由于16S rRNA序列过高的相似度,此方法在鉴定亲缘关系较近的芽孢杆菌属物种时往往难以奏效[22]。本研究在16S rRNA鉴定的基础上,结合了保守的蛋白编码基因和蜡样芽孢杆菌特异性毒力基因鉴定方法将实验室未知菌种鉴定为蜡样芽孢杆菌,并且该菌株的形态学特性和生理生化指标也与蜡样芽孢杆菌一致。本研究从分子和生理生化两个方面成功将分离菌鉴定为蜡样芽孢杆菌,并命名为蜡样芽孢杆菌HMPM18123。现保存于广东省微生物菌种保藏中心,保藏编码为GDMCC 61838。在进一步的生长特性测定实验中发现,该菌株可以在4 ℃条件下快速繁殖,并且在60 ℃高温下也能缓慢生长,恢复适宜温度后还能恢复原有的繁殖速度,相较绝大多数蜡样芽孢杆菌菌株具有更好的耐高温特性[23]。另外,蜡样芽孢杆菌HMPM18123还具有在胃液肠液中长时间存活的特性,这些特性为其在肠道稳定定植发挥益生作用提供了前提条件。
近年来,IBD的治疗策略逐渐舍弃了价格昂贵、副作用大、停药后容易复发的传统化学药物。因此,安全廉价的益生菌制剂开始作为治疗和预防IBD的药物应用于临床。例如益生菌制剂VSL #3和大肠杆菌Nissle 1917在治疗IBD方面已被证明具有不弱于美沙拉嗪的疗效[24-25],并已经作为药物投入市场。蜡样芽孢杆菌被报道具有调节肠道微生物组成、改善肠道屏障功能、抗炎抗氧化的益生特性,并已广泛应用于改善动物健康[26],但目前还缺少在IBD方向的报道。值得注意的是,部分蜡样芽孢杆菌具有一定毒性,可能导致轻微的呕吐和腹泻。本研究鉴定的蜡样芽孢杆菌也具有一些毒力基因,主要是以nhe和hbl为主的肠毒素基因,不存在呕吐基因ces。现已证明其安全性的蜡样芽孢杆菌制剂拥有与蜡样芽孢杆菌HMPM18123相似的毒力基因组成[27],同时在动物实验期间给予小鼠灌胃蜡样芽孢杆菌,小鼠也未出现不良反应。本研究使用DSS诱导的结肠炎模型模拟人类的溃疡性结肠炎,模型组小鼠临床表现为体质量衰减、DAI评分升高和结肠缩短,蜡样芽孢杆菌干预后则可以明显缓解小鼠结肠炎症状。蜡样芽孢杆菌组的组织学病理评分也明显低于模型组小鼠,具体表现为减轻DSS导致的隐窝缺失、炎症细胞浸润、黏膜损伤和黏膜下层薄壁水肿。
在IBD的发生和发展过程中,最主要的特征就是肠道炎症导致的细胞炎症因子表达量升高[28]。本研究采用real-time PCR方法检测小鼠结肠组织中炎症因子的表达水平,结果显示模型组小鼠结肠组织的炎症因子IL-6、TNF-α和IL-1β基因表达水平显著上调,并且IL-1β相对表达量的上升幅度最大。已有研究报道炎症因子IL-1β是IBD发病机制中最重要的炎症因子,通过TLR4-NFκBNLRP3炎症小体信号通路激活的IL-1β通过调节巨噬细胞极化加剧肠道炎症[29-31]。近期研究也证明芽孢杆菌及其代谢产物可以通过阻断NF-κB信号通路和NLRP3炎症小体的激活,抑制IL-1β的活化,有效缓解肠道炎症[32-33],这与本实验结果一致。而经蜡样芽孢杆菌HMPM18123干预后,炎症因子的表达被显著抑制,同时抑炎因子IL-10表达水平显著上调。与炎症因子对应的抑炎因子IL-10由M2型巨噬细胞释放,已被证明可以减轻肠道炎症[34]。以上结果表明,蜡样芽孢杆菌可以调控小鼠结肠组织炎症因子和抑炎因子的表达,减轻肠道炎症反应,缓解DSS诱导的小鼠结肠炎。
本研究使用多种分子鉴定方法及生理生化鉴定方法成功鉴定出了1 株具有耐热及胃液肠液耐受性质的蜡样芽孢杆菌,并通过DSS诱导的小鼠结肠炎模型评价该菌株具有缓解小鼠结肠炎的功效,为今后开发蜡样芽孢杆菌作为IBD的治疗药物提供了研究基础。

