丰富环境对慢性睡眠剥夺小鼠大脑皮层和海马Aβ1-42及相关代谢分子BACE1的影响*
任 缘, 王 修, 谭丽阳, 王 威, 唐 伟
(1大连大学附属新华医院,2大连大学,3大连大学附属中山医院,辽宁 大连 116621)
睡眠在我们的生活中占有很大比例,人一生中大约有三分之一的时间是在睡觉[1]。睡眠主要用于机体维持新陈代谢平衡、神经元激活和学习相关的突触形成[2]。此外,睡眠对于记忆的形成来说也是必不可少的。最近的研究结果表明,睡眠在学习过程和记忆巩固中扮演了重要的角色[3-4]。睡眠剥夺(sleep deprivation, SD)会导致记忆巩固不足[5-6],并在人脑的几个发育阶段中对大脑的发育和可塑性发挥重要作用[7-8]。因此,睡眠剥夺会导致认知功能的损害,特别是记忆和空间学习方面[9]。慢性睡眠剥夺在损害认知功能的同时也增加了β淀粉样蛋白(amyloid β-protein, Aβ)和β位点淀粉样前体蛋白裂解酶 1(β-site amyloid precursor protein cleaving enzyme 1, BACE1)的水平[10]。Aβ主要存在于大脑细胞间质之间,被认为是一种代谢“废物”[11]。其中Aβ 1-40和Aβ1-42是淀粉样斑块的主要存在形式,但后者Aβ1-42显示出更大的聚集倾向,并且由于多了两个疏水氨基酸而具有更大的神经毒性[12]。因此,延缓Aβ的异常沉积可能作为延缓睡眠剥夺导致相关认知损害的一种手段。随着认知功能的逐渐减退,昼夜节律的失调也在阿尔茨海默病(Alzheimer disease, AD)的发展中起着关键作用。AD是一种破坏性的、不可逆转的认知障碍,是最常见的痴呆类型。昼夜节律系统紊乱和AD的发病机制之间存在一些共同的特点,这也开启了将它们作为一个相互依赖的途径来观察的前景[13]。
丰富环境(enriched environment, EE)是一种具有多种认知性、社会性以及物理性刺激并且丰富的环境,它作为一种非药物干预手段,通过增强突触可塑性、增加脑源性神经营养因子和减少海马氧化应激,从而有效改善认知障碍[14-16]。一些实验已经证明,环境因素的调节显著减弱了Aβ的稳态水平[16-18]。同时,丰富环境也可以改善小鼠的学习和记忆能力[19-21]。然而,EE对增强学习和记忆能力的机制以及EE对Aβ相关代谢分子的影响在很大程度上仍是未知的。开发EE作为睡眠剥夺引起的学习和记忆功能改变的治疗方式具有重要的潜力。因此,我们通过改良多平台水环境法,成功构建睡眠剥夺的小鼠模型,首先研究了EE对慢性睡眠剥夺小鼠认知功能的影响,其次,探讨了EE对慢性睡眠剥夺小鼠学习记忆认知功能及其相关代谢分子BACE1表达水平的影响。
材料和方法
1 动物
由辽宁长生生物技术股份有限公司购得SPF级昆明种雄性小鼠40只,15周龄,体重(23±3) g,许可证号为SCXK(辽)2020-0001。所有实验动物均给予24 h昼夜灯光照射控制,并维持在温度24 ℃左右的条件下饲养,湿度控制在45%~55%之间。
2 主要试剂
兔抗小鼠Aβ1-42和BACE1 Ⅰ抗购于Abcam;山羊抗兔Ⅱ抗(Alexa Fluor Plus 594)购于Thermo;抗荧光淬灭封片剂及QuickBlockTM Western封闭液购于碧云天生物技术有限公司;裂解缓冲液Lysis Buffer购于凯基生物科技发展有限公司;Bradford蛋白测定试剂盒购于Solarbio;GAPDH抗体购于Bioworld;超敏ECL化学发光试剂盒购于四正柏生物科技有限公司。
3 方法
3.1 实验分组 采用随机数字表法将40只小鼠分为4组,每组10只:标准环境对照(control, Ctrl)组、SD组、EE组和SD+EE组。提供充足的食物和饮用水,小鼠于动物实验室内同笼饲养1周,12 h(6:00至18:00)光照和12 h(18:00至次日6:00)黑暗条件轮替进行,温度21~25 ℃,相对湿度45%~55%,并保持环境安静。
3.2 模型制作 采用改良多平台水环境法(modified multiple platform method, MMPM)制备慢性睡眠剥夺模型[22]。睡眠剥夺前将Ctrl组小鼠放在标准环境住房饲养至10月龄,标准环境使用标准实验室笼子(33 cm×18 cm×14 cm)。EE组和SD+EE组小鼠放在丰富环境住房饲养直到10月龄;丰富环境使用大型鼠笼(55 cm×34 cm×20 cm),共有4种不同类型的丰富环境笼子,每个笼子2~3层,配备1~2个跑轮、迷宫、管道、秋千和玩具等,增加小鼠的运动空间;每周更换和重新排列丰富环境笼子以增加小鼠新奇感[23]。SD组和SD+EE组:睡眠剥夺箱尺寸大小为(39 cm×27 cm×20 cm),中央放置一直径为3 cm,高10 cm,间隔5 cm的平台。水面距平台2 cm,水温保持在(24±1) ℃。清醒时小鼠可在平台上停留,进入睡眠时由于骨骼肌松弛使小鼠触碰到水面或落入水中而惊醒,以此达到睡眠剥夺的目的,每天于14:00至次日9:00将小鼠置于平台中进行19 h的睡眠剥夺,其余时间将小鼠放回相应的标准笼子或丰富环境笼子饲养,水槽内水每天更换,保证每组小鼠可自由摄取鼠粮和饮用水,共60 d,直至小鼠12月龄进行下一步实验。Ctrl组和EE组:为排除环境应激等影响将平台直径增大为10 cm,间隔2 cm,其余因素与SD组和SD+EE组一致,小鼠可在平台上随意活动并进入睡眠,不会落入水中。避免应激差异对小鼠神经病理特征和认知行为表现产生影响[24]。
3.3 神经行为学测试
3.3.1 Y迷宫实验 Y迷宫利用了小鼠对新异环境天然探究的习性,Y迷宫由3个臂组成,每一个臂尺寸为长30 cm,宽8 cm,高15 cm,各个臂夹角120度。正常小鼠会依次进入3个臂,不会返回前一个臂内[25]。小鼠由Y迷宫中心放入,让小鼠在迷宫中自由探索5 min。小鼠身体和尾巴完全进入其中一个臂内记为一次有效探索。通过Smart 3.0软件实时观察和记录各个小鼠进入3个臂的总交替数和序列,连续进入3个臂(如ACB、CAB等)记为正确。交替率的计算使用以下公式:交替正确率=正确交替数/(交替总数-2)×100%。同时,记录小鼠进入三个臂的总臂数来检测小鼠的活动能力。每只小鼠完成一次实验后用酒精喷洒于3个臂内以消除嗅觉干扰刺激。
3.3.2 新物体识别实验 新物体识别实验利用了啮齿动物的自发行为,自然地接近和探索新物体的天然习性[26]。实验开始前2 d,每天将小鼠放入不透明空箱(50 cm×50 cm×60 cm)中10 min适应环境。第3天进入训练阶段,将无气味,足够重,小鼠在测试中不能随意推动的A和B两相同物体分别置于空箱两端,将小鼠背朝两物体放入箱内,且确保小鼠鼻尖与A和B距离相等,使用录像机记录5 min内小鼠鼻尖距两物体1 cm以内的探究时间,小鼠将前爪放在物体上,嗅或舔物体视为有效探索;摆姿势或攀爬视为无效探索。每只小鼠训练结束休息1 h后继续进行下一次测试。将空箱中的B物体换为不同的C物体,其余条件不变,观察小鼠5 min内探索情况。采用Smart 3.0软件分析相机收集的图像,并记录小鼠与两物体的接触。分别计算训练、测试阶段的总探索时间及测试阶段的识别指数(recognition index,RI)=探索C物体时间/总探索时间,以此判断小鼠的认知功能。
3.4 小鼠前额叶皮层与海马淀粉样斑块沉积测定 用4%水合氯醛腹腔注射麻醉小鼠,开胸,充分暴露心脏,用4%多聚甲醛进行心脏灌流,断头取脑并置于4%多聚甲醛中固定24 h,取固定后的脑组织进行石蜡包埋,切片(4 μm)。每只小鼠脑切片隔三取一,挑选3张截面。脑组织切片用1×PBS于摇床上漂洗3 min脱蜡后滴加封闭液放置室温孵育1 h。随后滴加兔抗小鼠Aβ1-42 Ⅰ抗(1:200),4 ℃孵育过夜。次日1×PBS冲洗3 min×3次后滴加山羊抗兔IgG(H+L)高度交叉吸附Ⅱ抗 Alexa Fluor Plus 594(1∶100),室温孵育2 h,1×PBS冲洗3 min×3次,最后滴加带Hoechst的防淬灭封片剂,刷指甲油封片。每个鼠脑选取3张切片用Olympus显微镜观察、采集图片并拍照。Image J软件分析小鼠前额叶皮层与海马中Aβ1-42阳性区域百分比率。
3.5 小鼠前额叶皮层和海马组织BACE1蛋白测定 取-80 ℃液氮保存的前额叶皮层和海马组织,加入裂解液研磨,用玻璃匀浆器匀浆,离心后取上清液,Bradford法测定各组蛋白浓度。取30 μg蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)和转膜反应。1×TBST 溶液漂洗 5 min×3次后,加入5%脱脂牛奶置于摇床上室温封闭2 h,1×TBST 溶液漂洗 5 min×5 次后滴加兔抗鼠BACE1(1∶1 000),GAPDH抗体(1∶5 000)被用作内参照蛋白,4 ℃下孵育过夜。次日用1×TBST溶液漂洗10 min×3次后滴加相应的Ⅱ抗(1∶10 000),室温下孵育2 h,1×TBST溶液漂洗10 min×3次后滴加ECL发光进行曝光显影,以凝胶成像仪观察条带并拍照。用Image J软件分析各组蛋白相对表达水平。
4 统计学处理
采用SPSS 26.0软件统计分析。计量资料用均数±标准差(mean±SD)表示,多组之间比较采用单因素方差分析(one-way ANOVA)结合LSD事后多重检验进行,以P<0.05为差异有统计学意义。
结 果
1 神经行为学检测结果
1.1 Y迷宫实验结果 Y迷宫实验结果如图1所示,4组小鼠进臂总数相近,活动能力相似,差异无统计学意义(P>0.05)。与Ctrl组小鼠相比, SD组小鼠的交替率降低(P<0.01),EE组小鼠的交替率增高(P<0.01)。与SD组相比,EE+SD组小鼠的交替率增高(P<0.01)。
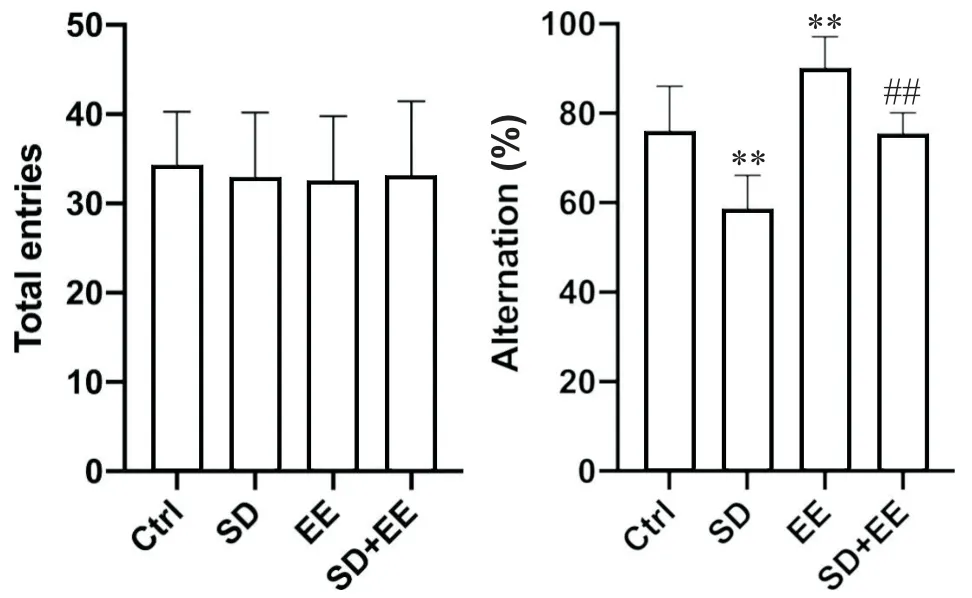
Figure 1. Comparison of Y maze arm accuracy and total number of arms in each group of mice. Mean±SD. n=10. **P<0.01 vs Ctrl group; ##P<0.01 vs SD group.图1 各组小鼠的Y迷宫入臂正确率和进臂总数比较
1.2 新物体识别实验结果 新物体识别实验结果如图2所示,与Ctrl组小鼠相比,SD组小鼠辨别指数降低(P<0.01),EE组小鼠辨别指数增高(P<0.05);与SD组相比,EE+SD组小鼠辨别指数增高(P<0.01)。
2 前额叶皮层和海马Aβ1-42免疫荧光染色结果
通过对小鼠海马与皮层组织分别进行免疫荧光染色,评估正常和慢性睡眠剥夺小鼠在EE干预和不干预后Aβ1-42表达水平的变化。免疫荧光结果如图3所示,与Ctrl组小鼠相比,SD组小鼠前额叶皮层和海马中的Aβ1-42表达水平均有不同程度的升高(P<0.01),而EE组小鼠前额叶皮层和海马中的Aβ1-42表达减少(P<0.05);与SD组小鼠相比,SD+EE组小鼠前额叶皮层和海马中的Aβ1-42表达显著减少(P<0.01)。
3 前额叶皮层和海马组织中BACE1蛋白表达结果
Western blot实验结果如图4所示,与Ctrl组相比,SD组小鼠前额叶皮层和海马BACE1蛋白表达升高(P<0.01);EE组前额叶皮层BACE1蛋白与Ctrl组差异无统计学意义(P>0.05),但海马组织中BACE1蛋白表达减少(P<0.01)。与SD组相比,SD+EE组小鼠前额叶皮层和海马中BACE1蛋白的表达均显著降低(P<0.01)。
讨 论
随着智能手机的应用[27]以及工作压力、生活压力不断增加[28],睡眠不足现象在现代社会越来越常见,有研究表明,73%的成年人每天睡眠不足7 h[29]。长时间的睡眠剥夺会影响人的认知、记忆和执行能力[30],诱发突触和神经元水平的大脑结构变化[31]。当前睡眠剥夺的治疗方式主要是基于药物治疗和使用兴奋剂,如褪黑素[32],咖啡因,右旋苯丙胺和莫达非尼[33-34]。近年来,有一些研究通过老年动物或动物模型提出并强调了非药物治疗的EE对记忆获取和认知缺陷恢复的有益影响[20-21,35-37]。为了评估 EE能否作为延缓慢性睡眠剥夺相关损害的一种新方式,本实验通过将小鼠饲养在装有不同互动物体(隧道、巢穴、玩具和跑步轮)的笼子里营造丰富环境,从而模拟人类的一些生活方式行为等,增强感觉、认知、运动和社会刺激。本实验结果表明,EE干预后的小鼠Y迷宫实验中交替率和新物体识别实验中物体辨别指数显著提高,说明丰富环境可改善慢性睡眠剥夺小鼠学习、记忆能力和认知功能。然而,在许多关于丰富环境化的研究中,研究者集中在EE和隔离环境(isolation environment, IE)动物的比较上[33-34,38-39]。值得注意的是,社会隔离本身可能导致一系列神经元和行为的改变,已经证明这种类型的环境条件是一种应激因素[40]。本实验在开始前将各组小鼠置于相应环境中饲养七个月,有效减小了这种因素带来的实验误差。
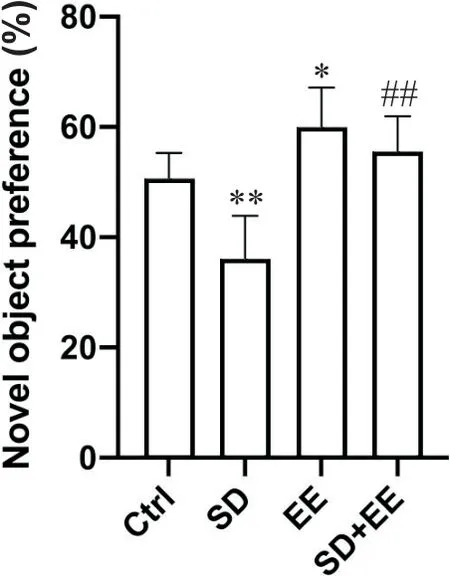
Figure 2. Comparison of discrimination indexes for new object recognition experiments in various groups of mice.Mean±SD. n=10. *P<0.05, **P<0.01 vs Ctrl group;##P<0.01 vs SD group.图2 各组小鼠的新物体识别实验的辨别指数比较
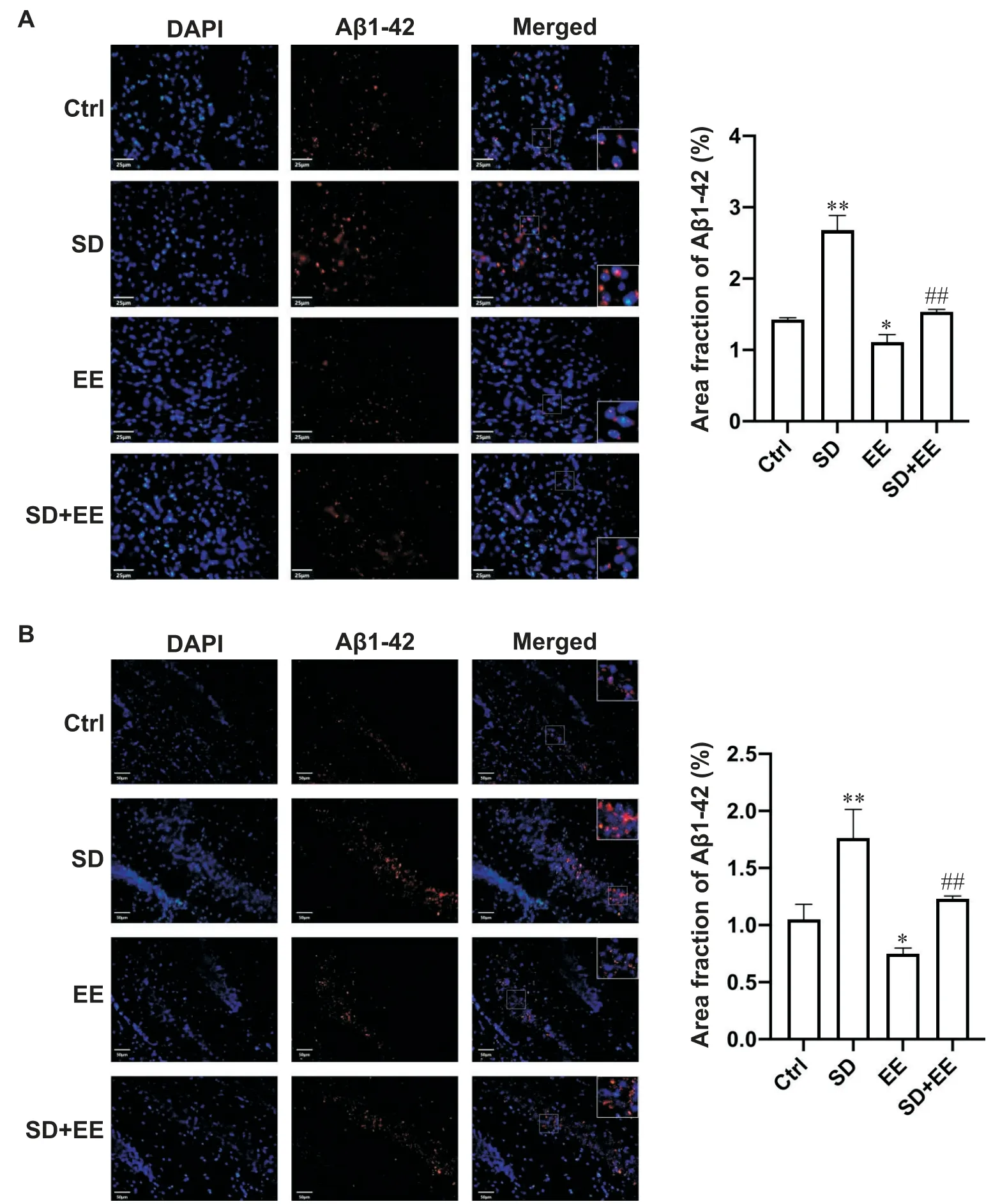
Figure 3. Effects of enrichment on Aβ1-42 expression in chronic sleep deprivation mice. Immunofluorescence staining of Aβ1-42(red) and DAPI (blue) of the prefrontal cortex(A) and hippocampal (B) in each group. Scale bar=50 μm. Mean±SD. n=6. *P<0.05,**P<0.01 vs Ctrl group; ##P<0.01 vs SD group.图3 丰富环境对慢性睡眠剥夺小鼠Aβ1-42表达的影响
睡眠剥夺会引起过度磷酸化的tau聚集体和Aβ斑块的积累[41]。脑脊液中的Aβ水平也随着Aβ水平在脑中的沉积而降低[42-43],重要的是,血浆中的Aβ水平平行地降低[42]。其中血浆 Aβ 水平为 AD 的发病前生物标志物,升高的 Aβ1-42 水平与转化为 AD 的风险增加有关[44]。有研究表明,AB1-42 的沉积可能先于和促进血浆中可检测到的 Aβ 水平升高[45-46],并且Aβ1-42在Aβ1-40之前沉积[46]。近年来,人们对EE影响的研究逐渐增加[47-49],但EE如何治疗睡眠剥夺引起大脑变化的分子基础仍不清楚。本实验通过对小鼠海马与皮层组织分别进行免疫荧光染色评估正常和慢性睡眠剥夺小鼠在EE干预和不干预后Aβ1-42表达水平的变化。实验结果表明, EE干预后,SD小鼠前额叶皮层和海马中Aβ1-42表达显著降低;相反,未接受EE干预的SD小鼠前额叶皮层和海马中Aβ1-42表达均有不同程度的升高,提示慢性睡眠剥夺可能会引起海马中Aβ1-42的沉积,而EE干预可有效改善慢性睡眠剥夺小鼠前额叶皮质和海马Aβ1-42的沉积。

Figure 4. Effect of enrichment on expression levels with BACE1 was detected by Western blot. Mean±SD. n=6. *P<0.01 vs Ctrl group; ##P<0.01 vs SD group.图4 丰富环境对与BACE1表达水平的影响
但近年来的实验多侧重于探究EE对Aβ以及突触可塑性的影响[50-53],而EE对Aβ相关代谢分子的影响仍需进一步探索。本实验首次探讨EE对Aβ相关代谢分子BACE1表达水平的影响,从而进一步研究丰富环境减少慢性睡眠剥夺小鼠Aβ产生的机制。BACE1切割代表Aβ生成的第一步,并启动导致AD神经变性的淀粉样蛋白级联反应[54],BACE1表达的增加促进了β淀粉样前体蛋白被β分泌酶途径加工,导致更多的有神经毒性的Aβ1-42产生[55]。有研究表明睡眠剥夺小鼠模型的脑组织中,特别是颞叶皮质和海马中 BACE1活性显著升高[54,56-57]。本实验通过Western blot法检测BACE1的表达水平来研究丰富环境减少慢性睡眠剥夺小鼠Aβ产生的机制,从而评估丰富环境对慢性睡眠剥夺小鼠Aβ生成的影响。本实验结果表明,EE干预后,SD小鼠前额叶皮层和海马中BACE1蛋白表达被抑制;未接受EE干预的SD小鼠前额叶皮层和海马中BACE1表达水平升高,提示丰富环境可改善慢性睡眠剥夺后BACE1蛋白的表达升高。
综上所述,EE可以降低慢性睡眠剥夺小鼠前额叶皮层和海马中Aβ1-42的沉积及BACE1蛋白的表达,同时改善慢性睡眠剥夺后小鼠学习、记忆以及认知功能。我们研究的Aβ代谢相关分子仅涉及BACE1方面,而对Aβ其他相关代谢途径的具体机制仍需进一步研究。

