中药调控小胶质细胞改善阿尔茨海默病的研究进展
潘予璠,信琪琪,袁 蓉,缪 宇,丛伟红
(1.天津中医药大学研究生院,天津 301617;2.中国中医科学院西苑医院心血管病实验室,国家中医心血管病临床医学研究中心,北京 100091)
小胶质细胞(microglia,MG)是中枢神经系统(central nervous system,CNS)的主要免疫细胞,约占CNS细胞的0.10~0.15。作为神经炎症调控机制的主要参与者,MG以3种不同表型存在并发挥作用,即静息状态M0型和活化状态M1、M2型。静息状态下,MG动态监测脑内微环境,清除细胞碎片和感染物质,形态上表现为“分枝形”,胞体较小,突起变长;当脑组织受到感染或损伤时,MG被激活为M1和M2两种表型:M1型为促炎症表型,在疾病过程中诱发多种炎症因子的释放,如肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白介素-1β(interleukin-1 β,IL-1β)、白介素-6(interleukin-6,IL-6)和一氧化氮(nitric oxide,NO)等,诱导神经元损伤和氧化应激,进而引发突触丢失,加速疾病进程;M2型为抗炎症表型,通过产生抗炎因子和神经保护因子,如白介素-10(interleukin-10,IL-10)、白介素-4(interleukin-4,IL-4)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)等,增强MG对淀粉样蛋白(amyloid β-protein,Aβ)的吞噬作用,抑制炎症,改善疾病状态[1]。综合已有研究发现,MG过度激活可能促进神经炎症、加速神经元损伤。中药可改善AD脑内Aβ沉积,减轻神经炎症,并通过调节MG表面受体表达促进其发挥M2型保护作用,从而改善大脑认知功能,起到预防和延缓AD的作用。本文对相关内容及中药通过MG发挥改善AD的可能作用和机制进行总结和分析,以期为中药治疗神经退行性疾病提供理论依据。
1 MG在AD病变中的可能作用和机制
在AD病变中,MG以两种激活状态同时存在并发挥作用。伴随衰老和受遗传等因素的影响,M1型的比例不断上升,可诱发释放神经炎症因子、加速微管相关蛋白(microtubule-associated protein,TAU)蛋白过磷酸化并增加突触的丢失和胆碱系统功能障碍。MG在AD病变中的可能作用和机制,见Fig 1。
1.1 双向调节Aβ沉积淀粉样蛋白学说目前仍是AD发病机制的主流学说。该学说认为,Aβ聚集、沉积产生的神经毒性是最终导致认知功能障碍的主要形式。有研究提示在疾病不同阶段,MG对Aβ沉积表现出双向调节作用[2]。一方面,MG大量聚集在Aβ斑块周围形成屏障,抑制斑块体积增加并保护神经元。另一方面,在Aβ的长期刺激下,激活的MG表现出有害作用,其释放的炎症介质(如炎性因子、补体成分和自由基等)参与AD发病,反过来加速Aβ的产生和积累,诱导神经炎症和氧化应激等病理现象。研究表明,髓系细胞触发受体2 (triggering receptor expressed on myeloid cells 2,TREM2)可能参与MG活化,进而发挥双向调节Aβ沉积的机制。TREM2是MG表面的跨膜受体蛋白。TREM2释放可溶性sTREM2,通过激活蛋白激酶B(protein kinase B,AKT)通路促进MG增殖发生的同时,增强免疫应答反应和吞噬Aβ斑块的作用[3]。
1.2 促进慢性神经炎症神经炎症被认为是AD三大发病机制(Aβ沉积、TAU蛋白过度磷酸化和神经炎症)之一。大脑中的炎症是由激活的MG和星形胶质细胞诱发的,其中MG被认为是介导炎性反应的关键因素。研究表明,MG能够被多种物质活化并激活其下游信号通路核因子κB(nuclear factor kappa-B,NF-κB)、Toll样受体(Toll-like receptors,TLR)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等,进而产生神经毒性细胞因子(包括TNF-α、IL-1β、IL-6和活性氧自由基等),导致Aβ清除受阻、TAU病理加重以及突触丢失等病理现象[4]。
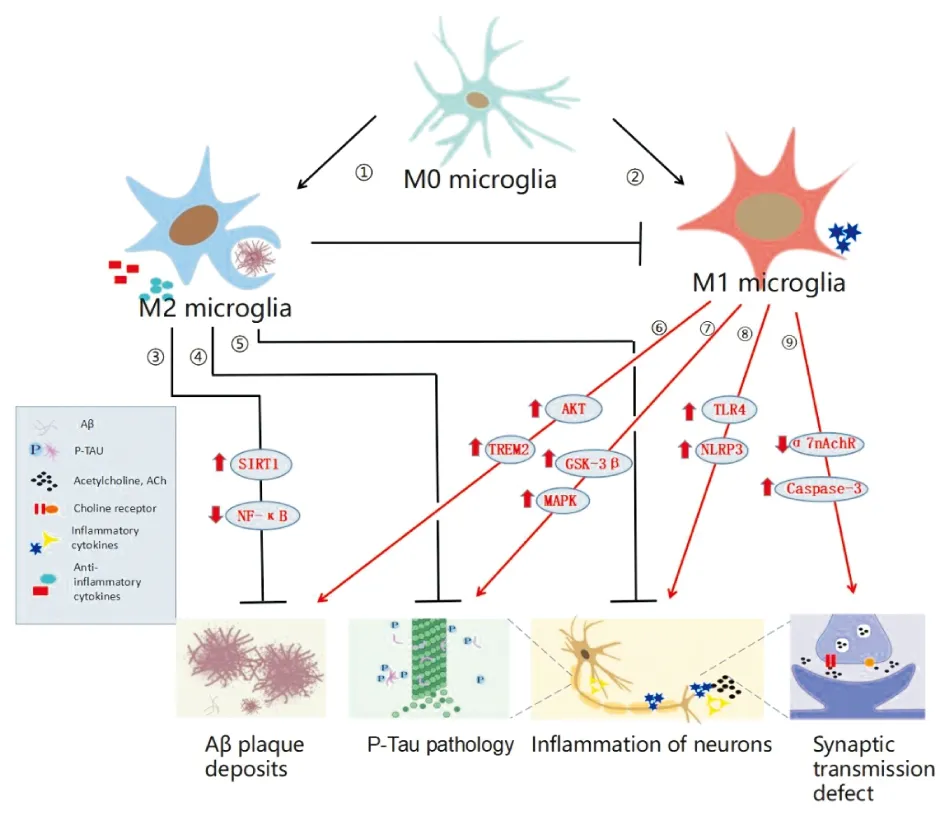
Fig 1 Role and possible mechanisms of microglia in pathological changes of AD
补体是一组存在于人和动物细胞表面的蛋白,经活化后具有生物活性,可介导免疫和炎症反应,也称为补体系统。研究表明,MG是大脑补体C1q(complement C1q)蛋白的主要来源,而后者的上调将作为经典补体系统的启动信号,靶向神经炎症因子的产生和神经元丢失,抑制C1q活动可以挽救神经炎症诱导的认知功能障碍[2]。经典补体系统释放炎症信号诱导M1型细胞活化,释放IL-1β、IL-6等炎症因子引发慢性神经炎症反应[5]。因此,抑制MG激活或使用抗炎药物成为治疗AD神经炎症的一种潜在方式,但其疗效和长期服用可能导致的副作用尚无统一结论。具有抗炎作用的传统中药种类繁多,相较长期服用西药治疗,中药具有疗效显著、副作用小的特点,有潜在开发价值。
1.3 加速TAU蛋白过磷酸化TAU蛋白是CNS中含量最高的微管相关蛋白。Fuyuki等[6]于2018年提出TAU诱导的突触功能障碍早于Aβ病理的产生,且突触丢失与认知能力下降具有极强的相关性,故推测TAU蛋白而非Aβ可能是影响AD进展的主要因素。
MG在TAU病理的启动和传播中发挥重要作用。研究表明,TREM2和APOE过表达调节MG释放多种炎性因子(如IL-6、TNF-α和IL-1β等)以及补体C1q蛋白,诱发神经炎症和经典的补体级联反应,加速病理性TAU蛋白聚集和突触丢失。另外,MG可通过吞噬细胞和体外分泌囊泡的方式参与介导病理性TAU蛋白的传播,减少MG数量可以显著抑制病理性TAU蛋白的产生和传播过程[7]。但是,MG如何启动和介导TAU的病理过程,目前尚不明确。
1.4 诱导胆碱能系统功能障碍在AD病变过程中,乙酰胆碱酯酶与Aβ相互作用,促进淀粉样斑块的形成和MG活化,Yulia等[8]采用脑室注射免疫毒素192IgG-saporin诱导胆碱能细胞死亡,构建胆碱能神经元变性模型,研究发现注射1.5月后大鼠海马CA3区和DG区离子钙结合适配器分子 1(ionized calcium binding adapter molecule 1,Iba1)阳性细胞数量显著增加,更多MG呈现“胞体增大、突起回缩”的活化状态,并伴随神经元的丢失。毒蕈碱型受体、烟碱型受体是存在于MG表面的两类胆碱能受体。APP/PS1小鼠终生补充5.0 g·kg-1氯化胆碱饮食后,其水迷宫实验结果获得改善、MG诱导的炎症得到缓解,相关机制可能与抑制MG活化以及烟碱样乙酰胆碱受体α7亚型(α7 nicotinic acetylcholine receptor,α7nACh)等烟碱型受体的表达下调有关[9]。
2 中药提取物及有效成分对AD小胶质细胞的调节作用
中药有多成分、多靶点、多途径的治疗特点,对于发病机制复杂的疾病表现出较好的疗效和较低的毒副作用。西医对AD一直缺乏有效治疗手段,而近年来中医药防治AD的研究引起广泛关注,为患者带来新的希望。有学者指出,MG作为神经炎症的主要参与者,其不同表型变化伴随疾病的发展表现出对AD的双向调节作用,Aβ激活的MG通常表现为神经毒性细胞因子产生、早期突触丢失和记忆功能损伤。另外,随着年龄的增长,慢性炎症也会损害MG的防御功能并引发促炎症型MG活化,而MG的激活与其稳态基因的下调和AD风险基因的上调有关,包括APOE、TREM2和TYRO蛋白酪氨酸激酶结合蛋白(transmembrane immune signaling adaptor,TYROBP),其中TREM2被证明参与MG的激活过程,该蛋白功能的改变可能对AD中MG的活化和不同表型之间的转化发挥重要作用[10]。因此,依据MG的作用机制可将中药的干预途径总结为以下3种:通过抑制MG促炎症表型增强对Aβ的吞噬作用,限制MG激活的有害影响;通过增加M2型抗炎特性减少脑内神经炎症,增强MG神经保护作用;通过调节多种受体蛋白表达干预MG的免疫反应。
2.1 抑制MG激活,增强神经保护作用有研究指出,Aβ毒性蛋白沉积与MG不同表型的激活关系密切。随着Aβ沉积增多,MG吞噬和清除作用增强。但在衰老和遗传等因素影响下,过量的Aβ沉积将激活MG进入炎症状态,即M1表型,在这种状态下,MG吞噬突触神经、分泌炎性细胞因子并促进TAU病理变化的扩散,大大加速疾病的发展过程[2]。
苦参碱是一种喹诺里西啶类生物碱,是中药苦参的主要活性成分之一,Li等[11]通过侧脑室注射低聚Aβ蛋白(2.5 g·L-1,4 μL)建立认知障碍和神经炎症模型小鼠,腹腔注射不同浓度苦参碱溶液(10、20和40 mg·kg-1)21 d后发现,MG活化程度显著较低,海马组织中ROS、TNF-α、IL-1β和IL-6等炎症因子的表达水平均下降,且两种还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶亚型的表达下调。化疗引起的认知障碍是化疗期间常见的副反应,患病率高达0.69~0.78。有研究表明,10 mg·kg-1人参皂苷RG1给药3周,可以显著提高腹腔注射DAC(多西他赛、阿霉素、环磷酰胺)引起的化疗脑模型小鼠水迷宫游泳成绩,降低海马神经元活性,减少促炎因子表达,提示人参皂苷RG1可以通过调节MG活化介导的细胞因子发挥神经保护和改善认知的作用[12]。此外,大豆中的异黄酮类成分可通过抑制MG激活及其激活后产生和释放的可溶性促炎因子而发挥神经保护作用[13]。白藜芦醇是广泛存在于多种植物中的一种非黄酮类多酚化合物,由于其具有显著的神经保护、免疫调节等作用,成为近年来AD研究的热点。李晓光[14]用FAM荧光标记Aβ蛋白,通过检测含有FAM-Aβ荧光的BV-2细胞数量来显示细胞的吞噬作用,结果表明,20 μmol·L-1白藜芦醇可显著提高BV-2细胞对Aβ的吞噬作用,给药组TREM2蛋白表达量是对照组的1.7倍,血清中sTREM2含量相比对照组降低0.7,且吞噬作用随外源性sTREM2的增加而增强,推测白藜芦醇通过促进TREM2蛋白表达及抑制sTREM2,进一步影响BV-2细胞对Aβ的吞噬功能。
另有研究表明,姜黄素可以有效抑制脂多糖(lipopolysaccharide,LPS)诱导的BV-2细胞炎症因子释放,降低M1型细胞比例,并增强细胞吞噬作用,推测姜黄素可能通过靶向TREM2-TLR4介导的NF-κB信号通路抑制MG活化、发挥吞噬和抗炎作用[5]。Gao等[15]利用TLR4-/-基因敲除小鼠探究中药姜黄素调控TLR4/NF-κB信号通路调节MG的作用机制,结果表明腹腔注射50、100和200 mg·kg-1姜黄素24 h可显著抑制TLR4、NF-κB和髓样分化因子88(myeloid differentiation factor 88,MyD88)等蛋白表达。其中,姜黄素100 mg·kg-1可显著抑制促炎因子释放和MG激活。
2.2 促进M2型活化,减少脑内炎症神经炎症是CNS在感染、毒性代谢物、创伤或自身免疫的刺激下发生的一种免疫失调。为了应对CNS损伤、保护脑功能,小胶质细胞、巨噬细胞和星形胶质细胞等免疫细胞会调控突触平衡并促进凋亡细胞的清除。在神经退行性疾病中,上述过程可能会受到影响。代替激活型MG(M2极化)是MG的一种具有神经保护和神经炎症抑制作用的活化表型,通常存在于疾病的急性损伤期,具有促进组织修复和再生、保护神经元并释放IL-4和IL-10等抗炎细胞因子、抑制炎症反应的作用。可见,在不同病理时期,MG激活后将发挥不同的作用,因此,如何促进MG向M2表型活化并发挥神经保护作用被认为是治疗和改善AD的关键。
补虚药是治疗AD时使用频率最高的一类中药,其中淫羊藿的有效成分淫羊藿苷已被证明是一种有效的抗炎剂。以炎性细胞因子(IL-1β、IL-6和TNF-α)标记M1型细胞、以抗炎因子(IL-4、IL-10和TGF-1)标记M2型细胞,探究淫羊藿苷调节MG极化的作用机制发现,淫羊藿苷可显著提高APP/PS1双转基因小鼠水迷宫游泳成绩、抑制M1型标记物的表达,其机制可能是通过激活PPARγ受体蛋白通路从而诱导M1向M2极化[16]。另外,转录调节因子NF-κB也是中药调控MG激活、表型转化和神经炎症的重要信号分子。研究表明,西红花的主要成分西红花苷可显著抑制LPS诱导的BV-2细胞炎性因子和活性氧物质的产生,其机制可能是通过抑制NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)和NF-κB信号通路、促进MG向M2型极化进而发挥抗炎作用[17]。以脂多糖诱导的BV-2细胞模型研究丹参酮I干预神经炎症细胞因子表达发现,丹参酮I可显著降低NO、TNF-α和IL-6的生成、抑制NF-κB信号通路,发挥神经保护作用,并显示出剂量依赖性。随后采用C57BL/6小鼠腹腔注射1-甲基-4-苯基-1,2,3,6 -四氢吡啶的方法建立帕金森病模型,再次证实了这一结论[18]。黄柏的甲醇提取物在干预AD引发的炎症时也表现出相同的作用机制,MG中炎性因子TNF-α和IL-1β的表达被高度抑制,同时NO诱导的神经元死亡减少[19]。银杏叶提取物EGb 761被证明具有抗炎作用,其机制可能是通过降低前列腺素E2的释放而抑制MG活化和细胞因子的释放[20]。此外,β-细辛酮[21]、川芎嗪[22]和延胡索[23]等成分也被证明具有调节MG极化、降低炎性因子表达,从而改善神经炎症的作用。
2.3 调节MG受体蛋白表达人类基因组测序结果提示,MG中多种免疫相关受体的基因在AD中呈高表达(如TREM2、CR1和CD33等),且其蛋白产物通常作为膜受体参与呈递抗原、吞噬有害物质以及调节炎症反应等免疫功能。地黄所含成分梓醇可抑制LPS诱导的TLR4和MyD88的蛋白表达,减少细胞表面TLR4和LPS的结合,进而抑制NF-κB信号通路的活化发挥抗炎和神经保护作用[24]。黄芪甲苷是中草药黄芪的主要活性成分,给药14 d后可显著改善大鼠脑损伤所致的中枢神经炎症,增加PPARγ受体蛋白表达和神经保护因子的释放[25]。
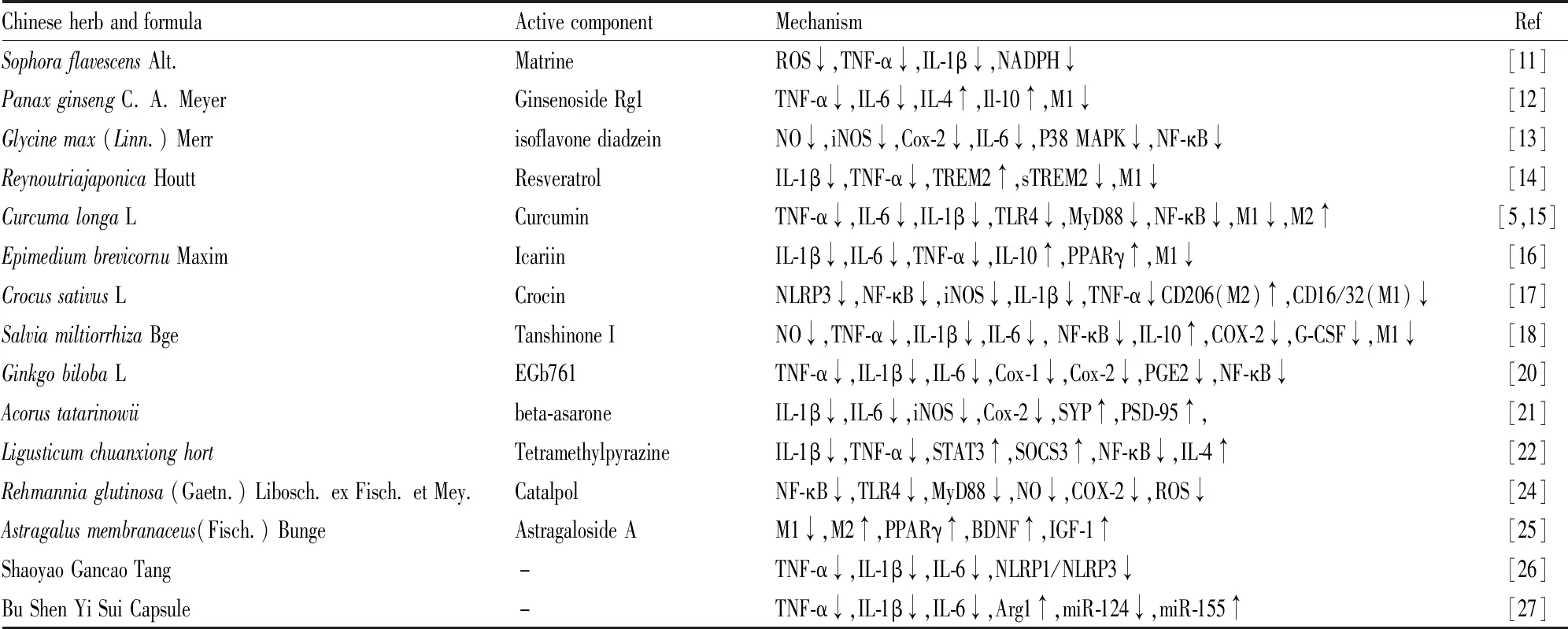
除中药有效成分外,中药复方调控MG研究也有进展。新近结果提示,灌胃给予3×Tg-AD转基因小鼠芍药甘草汤36 d,可显著提高其水迷宫成绩,降低小鼠海马区和大脑皮层内炎症因子TNF-α、IL-1β和IL-6的表达,抑制脑内Aβ聚集和TAU蛋白过磷酸化,通过下调NLRP1/NLRP3蛋白表达发挥抗Aβ聚集和神经保护作用[26]。王蕾等采用腹腔注射百日咳毒素和皮下注射隧桥少突胶质细胞糖蛋白建立C57BL/6J小鼠炎症模型,灌胃给予补肾益髓胶囊(3.02 g·kg-1),结果显示小鼠体质量增加、炎症减轻,其中M1型小胶质细胞数量(iNOS+/Iba1+)降低,M2型小胶质细胞数量(Arg1+/Iba1+)升高,炎症因子IL-6、IL-1β和TNF-α的表达水平均显著降低,其机制可能与下调miR-124表达、上调miR-155表达、促进M2型细胞极化有关[27]。目前已知的中药调控小胶质细胞的作用机制参见Tab 1。
3 展望
据国际阿尔茨海默病协会2018年报告,全球每3 s就会有1例痴呆患者产生,预计到2050年,全球将会有1.51亿人患有痴呆,其中2/3为AD患者[28]。现有的AD治疗药物均无法抑制AD的发生或发展进程,包括适用于任何阶段的胆碱酯酶抑制剂和用于中度或重度患者的盐酸美金刚片。因此,有学者提出,以多种药物联合疗法作为治疗阿尔茨海默病的未来方案。可见,针对发病机制复杂、病理现象相互影响的多因素疾病,其治疗必须从单一靶点药物转向多靶点的药物,中药因其自身特性可作为神经退行性疾病的潜在药物。另外,药物能够被吸收并通过血脑屏障进入中枢神经系统也是AD药物开发时需要考虑的关键因素,对此中药提供了丰富的备选资源[23]。
“双刃剑”效应使得以MG为靶点的治疗复杂化。在疾病早期,激活MG有助于Aβ吞噬作用和神经保护;而在疾病后期,抑制M1型活化对于减缓疾病进程至关重要。Aβ吞噬作用是MG作为中枢神经免疫细胞具有的特殊功能,在AD疾病进程中发挥重要作用。但目前关于MG对Aβ的吞噬作用研究较少。已知通过FAM、methoxy-X04免疫荧光染色可有效检测吞噬性MG数量,酶联免疫吸附法可检测血清中Aβ积累[29],或可为中药调控MG吞噬作用研究提供有效检测方法。尽管大量研究已证实,中药有效成分或复方对调控MG、改善AD表现出较好的潜在治疗作用,但存在体内研究较少、检测手段单一、作用机制不明确等问题。因此,未来的研究一方面应充分关注中药在疾病不同阶段的多靶点作用以及对MG表型转化的影响;另一方面应深入探究MG在神经炎症、氧化应激、能量代谢等方面的作用机制以及中药的相关调控途径,从而为中药或复方靶向调控MG、改善AD提供新的思路。
Tab 1 Regulative mechanisms of traditional Chinese medicine on microglia

