红景天苷对脂多糖所致痴呆小鼠Tau蛋白过度磷酸化的作用
王 翔,杜明奥,徐国友,李 菲,李明刚
(1.遵义市播州区人民医院 药剂科,贵州 遵义 563100;2.遵义医科大学 药学院药理学教研室,贵州 遵义 563099)
阿尔茨海默病(Alzheimer’s disease,AD)是最常见的与年龄密切相关的神经退行性疾病,占全球痴呆总数的60%~70%。主要临床表现为记忆和认识功能的逐渐下降,包括语言、视觉和空间感觉、执行能力等受损[1-2]。AD脑内的主要病理特征包括两种异常结构:细胞外β淀粉样蛋白(Amyloid beta,Aβ)沉积形成的老年斑和细胞内Tau蛋白过度磷酸化形成的神经纤维缠结(Neurofibrillary tangles,NFTs)。Aβ是由跨膜淀粉样前体蛋白(Amyloid precursor protein,APP)经系列酶切而成;Tau蛋白是参与微管稳定的微管相关蛋白,发生过度磷酸化后与微管解离并聚集形成成对的螺旋丝结构和NFTs[1-2]。Aβ沉淀而成的斑块和Tau蛋白形成的纤维缠结是导致神经元损伤和记忆、认知等功能下降的直接原因,与AD的行为异常密切相关。但因AD病因复杂,发病机制尚未完全确定。其中炎症反应在AD发病中的作用备受关注,神经炎症促进Tau蛋白缠结形成具有神经毒性的NFTs,而聚集的Tau蛋白又加剧了神经炎症反应,形成了相互加剧的恶性环路[3]。干扰该环路的环节对于减轻AD病理损伤具有良好的研究前景。
藏药红景天(Rhodiola rosea L.)性平、味寒、甘、涩,具有益智养心等功效,在心血管系统、神经系统、肝脏、皮肤等方面具有广泛的应用[4]。红景天苷是其主要活性成分,现代药理学研究发现红景天苷可减缓Aβ所致的神经毒性作用[5],通过抑制细胞焦亡用于缓解帕金森病[6],通过抑制炎症反应用于AD和血管性痴呆的防治[7-8],但关于红景天苷对AD病理特征Tau蛋白过度磷酸化的影响研究较少。考虑到神经炎症在AD发展过程中的重要作用,本实验采用脂多糖(Lipopolysaccharide,LPS)腹腔注射以诱导小鼠出现记忆和认知功能下降,神经元损伤等,模拟AD主要的临床及病理表现,以此探索红景天苷的神经保护作用。
1 材料与方法
1.1 动物分组和模型制备 8周龄SPF级雄性C57BL/6J小鼠购自湖南省莱克景达实验动物有限公司,合格证号:SCXK(湘)2019-0004。所用动物实验均符合遵义医科大学动物实验伦理委员会的相应规定([2021]2-444)。所用小鼠饲养于SPF级动物房,昼夜交替12 h、(23±1)℃、相对湿度60%。随机分为7组(n=7):空白组,空白+Sal高剂量组,LPS,LPS+Sal低剂量组,LPS+Sal中剂量组,LPS+Sal高剂量组,LPS+多奈哌齐组(Donepezil,DP)。分别灌胃给予小鼠Sal 25、50、100 mg/kg,或DP 1 mg/kg,每天1次,连续30 d;空白和LPS组小鼠给予同体积双蒸水。给药第15天开始腹腔注射,LPS小鼠腹腔注射LPS 250 μg/kg,空白组和空白+Sal高剂量组注射同体积生理盐水,每天1次,连续注射7 d。
1.2 主要试剂 红景天苷(纯度:99.79%,CAS:10338-51-9)购自MedChemExpress(MCE)公司。LPS来源Escherichia coli(O111:B4)购自sigma公司。Elisa试剂盒购自索莱宝科技有限公司。IL-1β、IL-6、NF-κB、总Tau、S202、S404、S396和T231位点磷酸化的抗体购自Cell Signaling Technology;β-actin和GAPDH购自Absin。Western blot实验所用二抗购自武汉三鹰生物技术有限公司。
1.3 实验方法 灌胃结束前7 d行Morris水迷宫实验检测小鼠行为学变化。小鼠水迷宫为直径120 cm的圆形迷宫,人为划分为4个象限,平台直径10 cm,固定放置与其中一个象限,并处于水面之下1 cm,为隐匿平台。水迷宫训练共6 d,除隐匿平台所在象限外,每天从其余3个象限将小鼠面朝池壁轻轻放置入水,每天训练3次。若小鼠在60 s内未找到隐匿平台,则将小鼠引导至平台上并停留10 s。通过计算机视频跟踪系统和mt-200图像分析软件记录每只小鼠从入水点到找到平台所需时间即为逃避潜伏期(s),每天3次训练结果取平均值作为当天的成绩。
行为学检测结束后24 h,腹腔注射3%戊巴比妥钠麻醉小鼠,采用0.01 M PBS透心灌注,直至流出液清晰,继而断头取脑,收集脑组织用于Elisa和Western blot法检测。取一侧脑组织加0.9%生理盐水,机械研磨成组织匀浆,以12 000 rpm 4 ℃离心10 min,取上清用于Elisa法检测炎症因子的含量。另一侧脑组织采用含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液在冰上操作裂解脑组织,4 ℃高速离心15 min后取上清采用BCA法进行蛋白定量;蛋白通过高热变性后,经SDS-PAGE胶分离;转至PVDF膜;5%脱脂牛奶(磷酸化抗体采用5 % BSA)室温封闭2 h;4 ℃孵育一抗过夜;室温孵育二抗1 h,ECL化学发光剂显影;全自动凝胶成像分析仪显影成像及Image J图像分析系统定量分析。
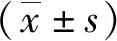
2 结果
2.1 红景天苷对LPS诱导的小鼠行为学的影响 Morris水迷宫定位航行实验结果显示随着训练次数的增加,各组小鼠找到隐匿平台(逃避潜伏期)所需的时间逐渐下降并趋于稳定,经重复测量方差分析的Mauchly球形度检验得近似卡方值为66.39,P<0.001;故主体内效应检验结果参考Greenhouse-Geisser(F=52.577,P<0.001);主体内效应检验F=4.41,P=0.002,提示小鼠逃避潜伏期存在分组因素的影响(见表1)。后续成对比较结果显示:训练至第5、6天,LPS组小鼠逃避潜伏期明显长于空白对照组(P<0.01);LPS+Sal和DP组小鼠与LPS组相比逃避潜伏期显著减少(P<0.01,见表1和图1);Sal正常给药组小鼠的逃避潜伏期与空白组接近,无统计学差异。
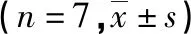
表1 各组小鼠Morris水迷宫实验逃避潜伏期(s)比较
2.2 红景天苷对LPS诱导的小鼠脑组织炎症因子的影响 本实验通过ELISA和Western blot法检测Sal对小鼠脑组织中炎症因子IL-1β、IL-6、TNF-α和NF-κB含量的影响。Western blot法检测小鼠脑组织中炎症因子IL-1β、IL-6和NF-κB蛋白的含量,结果如图2A所示:LPS刺激后小鼠脑组织中IL-1β、IL-6和NF-κB(P<0.01)的蛋白表达水平较空白组明显增加。给予Sal低剂量后并没有明显改变IL-6和NF-κB的蛋白表达水平。Sal中剂量有降低IL-6蛋白表达的趋势,但没有统计学差异。Sal高剂量和阳性药DP均明显的降低了IL-1β、IL-6和NF-κB(P<0.01)的蛋白表达水平。采用Elisa法对具有代表性的组包括空白组、LPS组、LPS+Sal高剂量和DP组炎症因子水平进行了验证,结果如图2B所示:LPS刺激后小鼠脑组织中IL-1β(P<0.01)、IL-6和TNF-α(P<0.05)水平均较空白组明显增加。给予Sal高剂量和DP干扰之后IL-1β、IL-6、TNF-α的含量均显著下降(P<0.05)。
2.3 红景天苷对LPS诱导的小鼠脑组织Tau蛋白磷酸化的影响 通过Western blot检测小鼠脑组织中总Tau蛋白的表达水平,及Tau蛋白在S202、T231、S396和S404位点磷酸化的水平,结果如图3所示,LPS腹腔注射后小鼠脑组织中Tau蛋白在上述位点磷酸化的水平显著高于空白组(P<0.01);给予Sal和DP治疗后小鼠脑组织中Tau蛋白在上述位点的磷酸化水平均明显低于LPS组(P<0.01);而总Tau蛋白的表达水平在各组间无统计学差异。
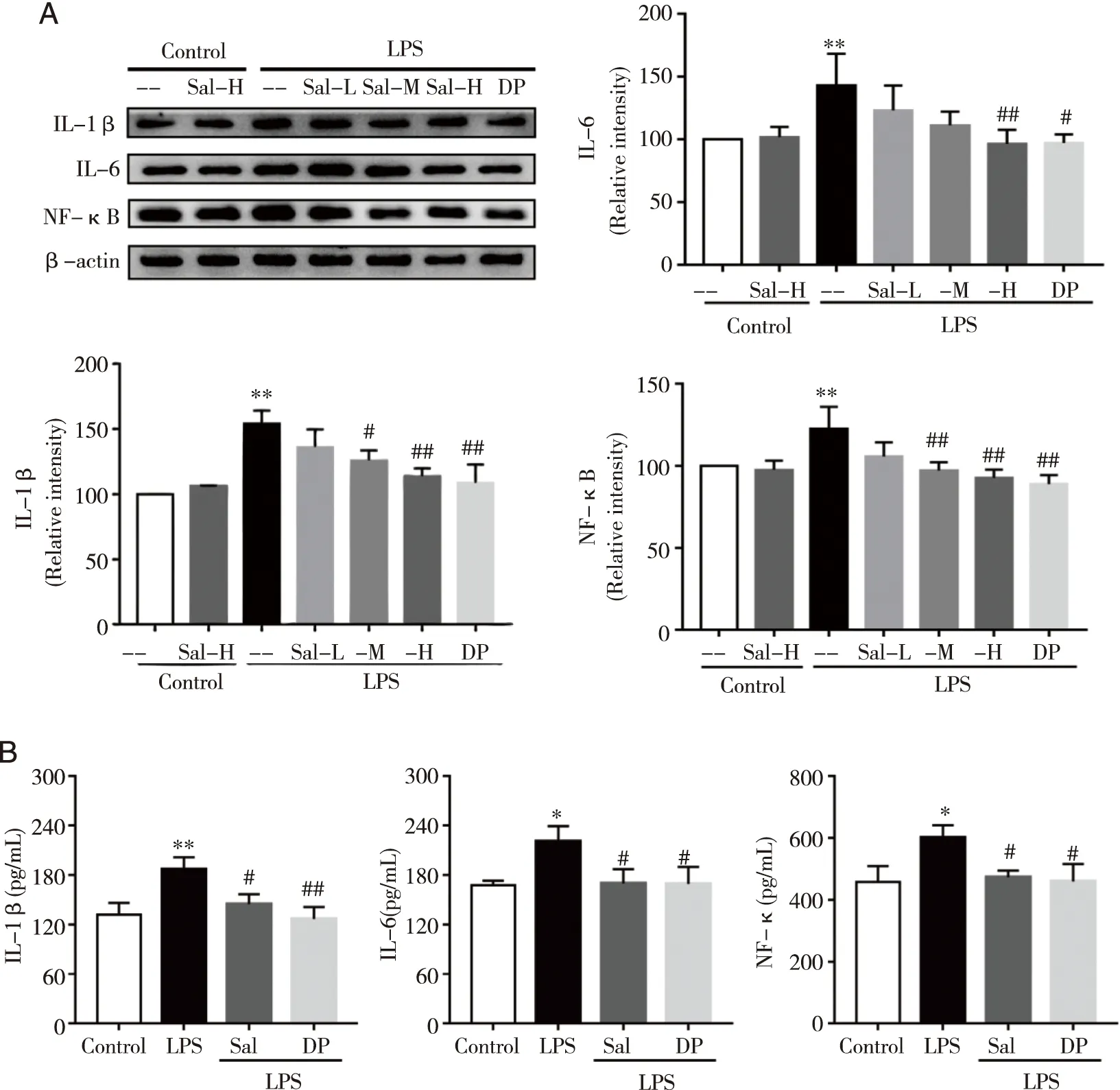
A:Western blot法检测小鼠脑组织中炎症因子IL-1β、IL-6和NF-κB的蛋白表达;B:ELISA法检测小鼠脑组织中炎症因子IL-1β、IL-6和TNF-α的水平;*、**:与Control组比较, P<0.05、P<0.01;#、##:与单纯LPS组比较,图2 红景天苷对LPS诱导的小鼠脑组织炎症因子的影响
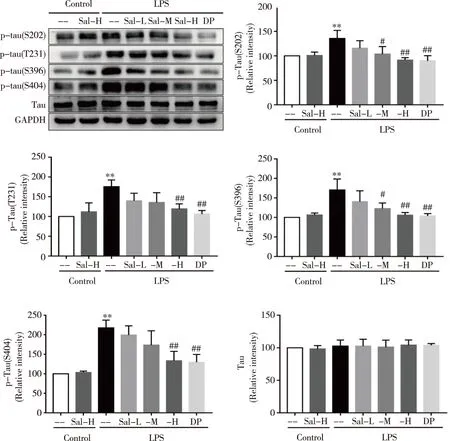
**:与Control组比较,P<0.01;#、##:与单纯LPS组比较,图3 红景天苷对LPS诱导的小鼠脑组织Tau蛋白磷酸化水平的影响
3 讨论
早有报道显示全身性炎症反应通过多途径比如室周器官、迷走神经、血脑屏障等引起中枢神经系统的神经炎症反应[9],而腹腔注射LPS制备的动物痴呆模型常被用于观察和分析AD疾病的发病机制和药物的干扰作用[10]。本实验采用小鼠腹腔注射LPS连续7 d后停止注射7 d,再采用水迷宫检测,结果显示小鼠空间学习记忆能力下降,与文献报道一致[11-13],说明小鼠痴呆模型制备成功,可用于后续观察药物的干扰作用。经预先灌胃给予红景天苷低、中、高(25、50、100 mg/kg)3个剂量梯度和阳性药多奈哌齐后,在水迷宫训练的最后2 d,即第5、6天,红景天苷中、高剂量和多奈哌齐均能明显减轻LPS造成的小鼠学习记忆功能的缺损,显示出红景天苷抗外周注射LPS所致AD模型的良好前景。
据研究报道,迟发性AD的病理改变中,慢性神经炎症的反应往往早于AD的特征性病理表现Aβ和Tau蛋白的过度磷酸化[14]。过度磷酸化的Tau形成的神经纤维缠结与神经元突触的丢失、胶质细胞增生、神经炎症及AD的临床症状密切相关,但导致Tau过度磷酸化的因素很多,其中神经炎症是关键因素[3],当然过度磷酸化的Tau又进一步加重了神经炎症反应。本实验采用外周给予LPS引发小鼠脑内炎症因子水平增加以及Tau蛋白过度磷酸化,红景天苷和多奈哌齐均能降低炎症因子IL-1β、IL-6、NF-κB和TNF-α的水平,并且还抑制Tau蛋白在S202、T231、S396和S404位点过度磷酸化的水平,提示红景天苷对AD特征性病理改变过度磷酸化Tau的影响可能与减轻神经炎症有关,但因该实验设计未考察到过度磷酸化Tau与神经炎症的先后关系,因此也无法肯定红景天苷对过度磷酸化Tau与神经炎症的影响的因果关系。本实验结果显示小鼠大脑总Tau蛋白的表达水平未发生变化,也提示红景天苷对Tau的影响是通过调节Tau蛋白翻译后修饰实现的,而不是改变蛋白质的表达水平。但对于红景天苷是如何调节Tau蛋白翻译后修饰,以及对神经炎症和Tau蛋白过度磷酸化先后关系的影响方面,仍需进一步研究。
综上所述,红景天苷明显的改善了腹腔注射LPS引起的小鼠学习记忆功能障碍,其机制可能与降低神经炎症水平及抑制Tau蛋白的过度磷酸化有关。
(致谢:感谢遵义医科大学基础药理教育部重点实验室提供的实验平台。)

