p73基因rs6695978位点基因型与卵巢癌病理特征和预后的相关性分析
袁 淼,苏 琦,刘竹君
西北妇女儿童医院:1.妇三科;2.药剂科,陕西西安 710061
卵巢癌临床病理分型多样,且不同临床病理分型患者在治疗、遗传变异、分子机制方面均存在明显差异[1],使卵巢癌的治疗难度加大,也是其病死率居妇科恶性肿瘤首位的重要原因。卵巢癌位于盆腔深部,解剖结构复杂,与内分泌和胚胎发育功能密切相关,且恶性程度较高,预后较差[2]。另外,卵巢癌早期症状缺乏特异性,被确诊时多数已处于中晚期,并且复发率超过50%[3]。长期以来,卵巢癌的诊断和治疗备受临床关注。目前,临床对卵巢癌发病机制的认识已深入基因分子领域,靶向治疗也逐渐在临床推广。易感基因在卵巢癌的发生和发展过程中发挥重要作用。p73基因定位于1p36.33,与p53基因具有高度同源性。安锦丹等[4]研究结果显示,p73基因在卵巢癌组织中呈明显高表达,提示p73基因可能与卵巢癌的病理进展相关。但目前有关p73基因多态性与卵巢癌病理特征相关性的研究较少。有研究显示,p73基因rs6695978位点存在富集化现象,可能成为卵巢癌的诱发因素,参与疾病的进展[5]。为进一步证实上述观点,为今后临床治疗新药的开发提供依据,本研究观察了76例卵巢癌患者p73基因型分布情况,并分析其临床价值,现报道如下。
1 资料与方法
1.1一般资料 选取2017年10月至2021年5月本院收治的76例卵巢癌患者作为研究对象,年龄(51.68±14.47)岁;体质量指数(20.72±2.42)kg/m2;肿瘤最大径(4.18±0.94)cm;病理分期:Ⅰ期16例,Ⅱ期15例,Ⅲ期19例,Ⅳ期26例;分化程度:高分化21例,中分化31例,低分化24例。本研究经本院伦理委员会审批通过,所有研究对象均知情同意并签署知情同意书。
1.2纳入和排除标准
1.2.1纳入标准 (1)均经组织病理活检证实为卵巢癌[6];(2)均为首次确诊,既往未行任何抗肿瘤治疗;(3)患者临床病例资料完整。
1.2.2排除标准 (1)复发性肿瘤患者或合并有其他原发性恶性肿瘤的患者;(2)合并有严重心、肺基础疾病或肝、肾功能不全的患者。
1.3研究方法 所有研究对象均在清晨空腹抽取肘静脉血3.0 mL,采用氯化钠盐析法提取DNA,以聚合酶链反应(PCR)-限制性片段长度多态性对p73基因rs6695978位点进行基因分型。引物设计上游:5′-TTCCCACGGGCAAGCAGATG-3′,下游:5′-CAAAGGCACACTGGCTGCTG-3′,扩增片段长度116 bp。PCR反应体系:Taq PCR Master Mix 12.5 μL,模板DNA 7.5 μL,上、下游引物各1.0 μL,加水至25.0 μL。反应条件:95 ℃预变性5 min、95 ℃变性30 s、退火60 ℃ 30 s、延迟72 ℃ 30 s。
1.4观察指标 患者出院后进行随访,记录76例患者总生存率,以失访或死亡为随访终点。比较不同基因型患者临床特征指标水平和总生存率,分析影响患者p73基因rs6695978位点基因型分布的相关因素。
2 结 果
2.1不同基因型患者临床特征比较 76例卵巢癌患者中p73基因rs6695978位点GG基因型32例,GA基因型36例,AA基因型8例。经Hardy-Weinberg遗传平衡检验,76例入组卵巢癌患者p73基因rs6695978位点基因型分布符合遗传平衡定律(χ2=1.278,P=0.612),提示入组患者具有群体代表性。不同基因型患者肿瘤最大径、肿瘤分期、分化程度比较,差异均有统计学意义(P<0.05)。见表1。
表1 不同基因型患者临床特征指标比较或n)
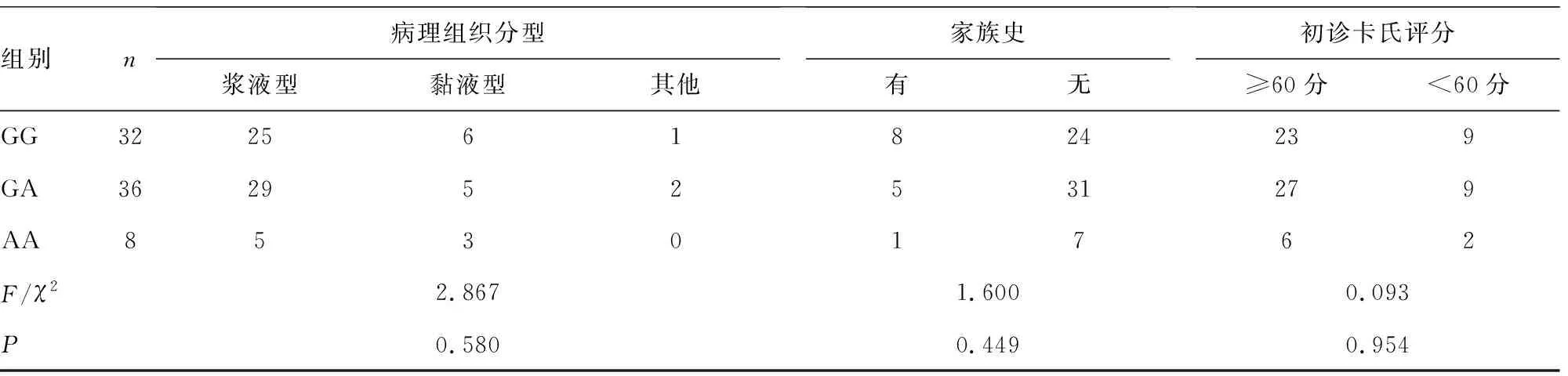
组别n病理组织分型浆液型黏液型其他家族史有无初诊卡氏评分≥60分<60分GG322561824239GA362952531279AA85301762F/χ22.8671.6000.093P0.5800.4490.954
2.2影响肿瘤基因型分布的相关因素分析 以卵巢癌患者p73基因rs6695978位点基因型作为因变量,以肿瘤最大径、肿瘤分期及分化程度作为自变量进行多元逐步回归分析,结果显示,卵巢癌患者p73基因rs6695978位点基因型分布与肿瘤分期和分化程度均有关(P<0.05)。见表2。
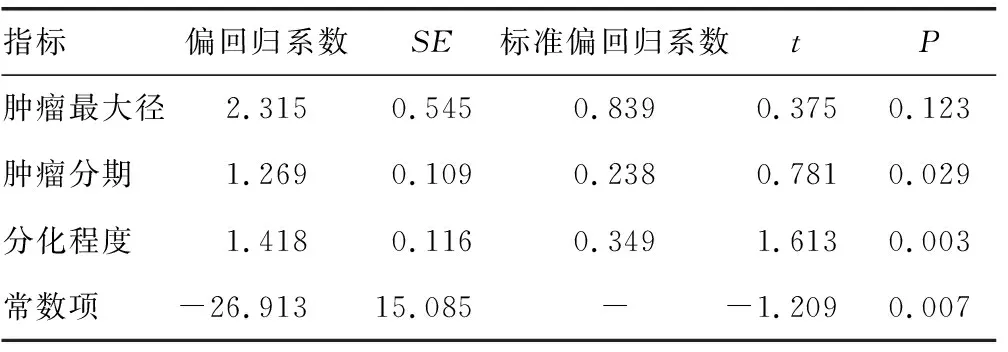
表2 卵巢癌患者p73基因rs6695978位点基因型分布的影响因素分析
2.3不同p73基因rs6695978位点基因型卵巢癌患者总生存率比较 根据p73基因rs6695978位点基因型是否携带A等位基因将患者分为GG组(GG基因型,n=32)和GA+AA组(GA基因型+AA基因型,n=44),GG组中位随访时间27.56个月,死亡10例,存活22例,生存率为68.75%,GA+AA组中位随访时间28.01个月,死亡24例,存活20例,生存率为45.45%,两组患者生存率比较,差异有统计学意义(Log-Rankχ2=4.007,P=0.045)。见图1。
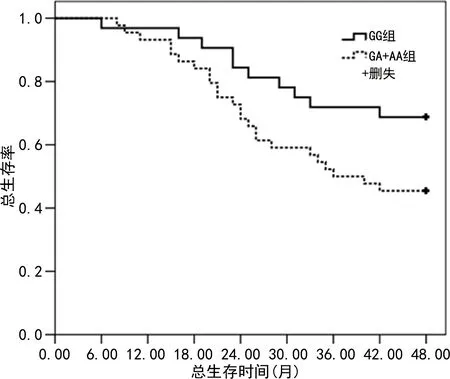
图1 不同p73基因rs6695978位点基因型卵巢癌患者总生存率比较
3 讨 论
卵巢癌早期检出率较低,化疗是卵巢癌重要的治疗方法,近年来随着研究的深入,分子靶向治疗备受关注。探讨卵巢癌的分子基因机制有助于临床新药的开发,提高治疗效果。p73基因由13个内含子和14个外显子构成,与p53具有高度同源性。有研究显示,在C末端的SAM区域,p73基因可发挥调节细胞生长的作用[7]。ZHANG等[8]研究显示,p73基因可通过激活Fas/Apol和Bax途径,阻断肿瘤细胞生长,诱导肿瘤细胞凋亡,进而达到抗肿瘤的目的;陈燕等[9]研究认为,p73基因阳性表达可增强卵巢上皮细胞癌细胞的侵袭增殖能力。p73基因单核苷酸多态性具有广泛而稳定的遗传特征,有研究显示,p73基因rs6695978位点存在富集现象,这可能成为癌变的诱发因素[10]。但目前有关卵巢癌p73基因rs6695978位点基因型分布与肿瘤病理特征和预后关系的报道较为少见。
microRNA基因芯片将生物信息学、生物遗传学及分子生物学融为一体,能实现对基因序列和功能的高通量研究[11],这将为肿瘤分子基因机制的研究提供新思路。单核苷酸多态性可改变microRNAs,进而影响肿瘤的发生。人类基因组关联分析发现,与卵巢癌发生转移相关的基因包括MTA1、Ras、CD44、E-Cadherin、KAI1、MHC、KISS-1、BRMS1、HER-2、p16、p53、p73、MSH1及Bax等[12-13],其中p73基因rs6695978位点在卵巢癌病理进展中均有表达,影响肿瘤生长[14]。本研究Hardy-Weinberg遗传平衡检验显示,入组患者具有群体代表性。多元逐步回归分析结果显示,p73基因rs6695978位点基因型分布与肿瘤分期和分化程度均密切相关,提示p73基因rs6695978位点T→A突变可能增加肿瘤的恶性程度,促进肿瘤生长。因而,本研究进一步比较不同基因型患者的预后,结果显示,携带A等位基因的卵巢癌患者预后更差,说明p73基因rs6695978位点基因型分布与卵巢癌恶性程度相关,进而影响患者预后。
卵巢癌具有遗传异质性的特点,且卵巢癌的发生和发展受多基因、多因素交互作用的影响[15]。本研究仅分析了p73基因rs6695978一个多态性位点在卵巢癌中的作用,具有一定的局限性,今后应采用表观遗传学、生物信息学方法进一步分析不同基因单核苷酸多态性位点基因型分布的特点及其相互作用,以探讨其在卵巢癌发病中的作用机制。
综上所述,p73基因rs6695978位点基因型分布与卵巢癌病理分期和分化程度均相关,并且可影响卵巢癌患者的预后,为今后卵巢癌发病机制的研究提供了新方向。

