基于“流域分析”的解剖性部分肺切除术在早期周围型肺癌中的应用
张 楠 陈树兴 林铿强 陈新富 许添辉 陈 星
(福建省福州肺科医院胸外科,福州 350000)
对于术前影像学诊断考虑为早期周围型肺癌的磨玻璃样结节(ground-glass nodule,GGN),若根据CT值判断病理为浸润前病变[1]或微浸润腺癌可能性大,手术方式多采用胸腔镜下楔形切除或肺段切除,两种术式各有优缺点。“流域分析”为广东省人民医院提出的一种肺小结节术中定位方法[2],即术前行三维重建,规划结节所属的流域动脉及切除范围,术中使用阻断带暂时阻断靶动脉,然后通过荧光反染确定切除范围,再行楔形切除。根据临床工作经验,我们对此做出改进,提出基于“流域分析”的解剖性部分肺切除术,即术中需切断靶动脉,酌情处理靶肺区静脉,不切断段支气管,在确保安全切缘的情况下行解剖性部分肺切除。该方法既弥补了楔形切除主观性强的不足,又简化了肺段切除的流程,是“简化的”肺段切除术,可以作为部分肺叶切除的补充手段。2021年9月~2022年3月,我们行23例基于“流域分析”的解剖性部分肺切除术,现报道如下。
1 临床资料与方法
1.1 一般资料
本组23例,男5例,女18例。年龄31~69岁,(48.7±12.1)岁。均为体检CT发现肺部结节,无不适症状。术前常规行胸部高分辨率CT或增强CT检查(图A),结节均为周围型(位于肺外野1/3),纯磨玻璃结节16例,混杂密度磨玻璃样结节7例;结节单发16例,多发7例(2枚4例,3枚3例,均为同侧);位于左上叶11例,左下叶3例,右上叶6例,右下叶3例;直径0.7~1.7 cm,(1.2±0.3)cm(多发结节按最大结节计算)。术前均未确诊,临床诊断怀疑早期肺癌。合并高血压2例,糖尿病1例,慢性阻塞性肺疾病1例。ASA分级Ⅰ级19例,Ⅱ级4例。术前均行血常规、生化常规、凝血常规、肿瘤标志物、D-二聚体、心电图、心脏彩超、肺功能、全腹彩超、头部MRI检查,排除心、肺、肝、肾功能不全及远处转移。
基于“流域分析”的解剖性部分肺切除术的指征:位于肺外周1/3肺野的直径≤2 cm的结节,符合以下条件之一:①术前穿刺病理表现为浸润前病变;②磨玻璃成分≥50%;③结节倍增时间≥400 d。
排除标准:①高龄伴有多种内科疾病、心肺功能差不能耐受肺段切除术;②尘肺、结核病病史估计支气管、血管周围粘连严重;③肺裂未发育而又需处理肺裂间血管。
1.2 术前规划
术前应用高分辨率CT或增强CT及三维重建技术明确结节的位置、大小、CT值,并完成手术方案规划(图B、C),包括:了解肺段支气管、动脉和静脉有无变异、畸形;显示结节与肺段支气管、动脉和静脉的关系,并判断结节的肺段归属;对结节所在位置进行流域分析,确定结节所在靶区的靶动脉,或可能需要处理的靶区静脉,在保证安全切缘的前提下,模拟解剖性部分肺切除。
1.3 手术方法
静脉吸入复合麻醉,双腔气管插管单肺通气,健侧卧位,胸部予乳胶垫抬高。胸腔镜显示器置于患者头侧,术者位于患者腹侧,扶镜手位于患者背侧。采用单操作孔胸腔镜手术,操作孔选取腋前线第4肋间,长约3 cm,观察孔选取腋中线第7肋间,长约1.5 cm,使用10 mm 30°近红外荧光胸腔镜(欧谱曼迪,OPTO-CAM2100)。进入胸腔后先行探查,对结节所在位置进行初步判断,缝线标记(图D)。根据术前规划,先游离出靶段血管,使用美国强生ECR45W血管钉(PSE45A电动腔镜关节头直线型切割吻合器)离断靶段肺动脉(图E),动脉及支气管旁的肺内、段间淋巴结采样,视肺静脉是否干扰肺动脉的暴露酌情给予处理,靶段支气管则予保留。将吲哚菁绿(indocyanine green,ICG)25 mg溶解在配套的10 ml灭菌注射用水中。将镜头标准白光模式转换成近红外荧光模式。外周静脉注射配好的ICG溶液约3 ml,约10 s后可见其余保留肺段呈荧光绿色(靶区未显影)(图F),一般荧光显像持续10~15 s(必要时可多次重复给药)。显影后立刻用氩气刀(或电钩)标记流域界限,再次确认结节位置与靶区关系,在确保切缘的情况下,用美国强生ECR45D钉仓(PSE45A电动腔镜关节头直线型切割吻合器)切除靶肺(图G)。
靶肺切除后,肉眼或直尺测量判断切缘是否安全(图H),切缘距离大于肿瘤直径,或切缘>2 cm[3]。病肺、切缘以及采样的动脉或支气管旁淋巴结常规送检冰冻病理。若冰冻确认病灶为浸润前病变、微浸润腺癌则手术结束,适当采样纵隔及肺门淋巴结;若为浸润性腺癌或其他类型肺癌,则行肺叶切除+系统性淋巴结清扫术。妥善止血,冲洗胸腔,鼓肺试漏,必要时予修补,留置引流管2根。术后肺复张良好、无漏气且每天引流量<200 ml,则拔除引流管。
2 结果
23例均顺利完成手术,术中肉眼判断切缘均安全,无扩大切除,无中转肺叶切除,无中转开胸。肺切除部位及例数见表1。5例多发结节中,3例为其他肺叶胸膜下病灶,同期行楔形切除;2例为肺外周结节,1例行LS1+2b+c+LS6切除,1例行RS2+RS8切除。手术时间91~183(138.4±35.0)min,术中出血量5~100(30.0±19.7)ml,术后引流时间1~4(2.3±0.9)d,术后住院时间3~7(4.6±1.3)d。
术后病理:不典型腺瘤样增生1例,原位腺癌2例,微浸润腺癌17例(图I),浸润性腺癌(贴壁型为主)3例。肿瘤最大直径0.5~1.6(1.0±0.3)cm。切除淋巴结1~9(3.2±1.4)枚,均为阴性。
术后并发症:2例老年患者术后肺部感染,经抗感染治疗治愈;1例术后漏气>4天,经对症治疗,术后第6天拔管。无住院期间死亡。
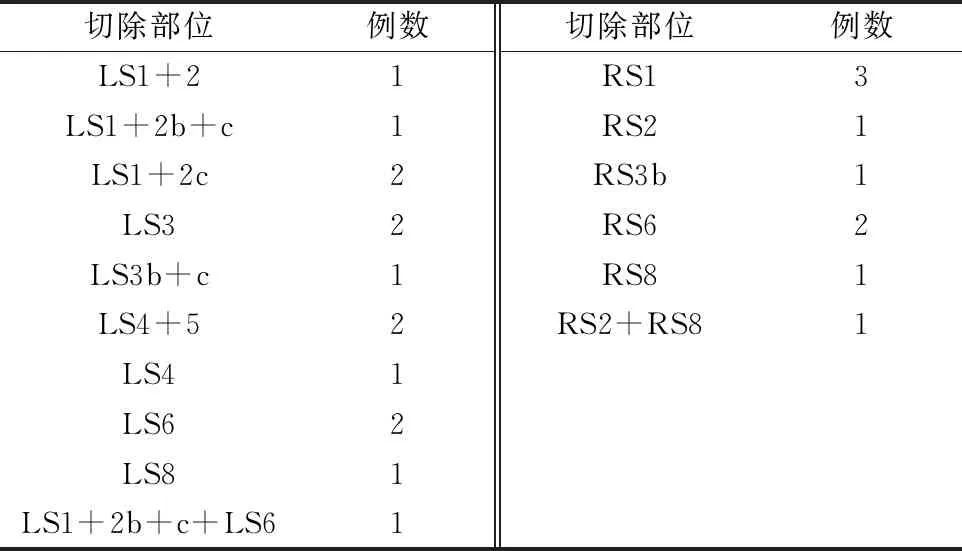
表1 23例肺切除部位及例数
术后1个月复查胸片,术后3年内每半年门诊复诊一次,包括胸部CT及血清CEA。截至2022年4月,随访1~7(4.2±1.9)月,均生活良好,无咯血、顽固性咳嗽症状。CT提示术区余肺复张良好,无扭转、淤血表现,无肿瘤复发、转移征象。CEA均在正常范围。
3 讨论
以GGN为主的早期周围型肺癌越来越多被检出,对诊断和治疗带来诸多挑战。研究认为,对于早期周围型肺癌,亚肺叶切除的远期疗效与肺叶切除相似,还可以保留更多的肺组织,减少肺功能损失,减轻手术创伤[4,5]。JCOG0804[6]研究、JCOG0802[7]研究为直径≤2 cm早期周围型肺癌行亚肺叶切除提供了有力证据。
亚肺叶切除术式主要包括肺楔形切除术和肺段切除术。楔形切除主观性较强,切除范围不够精准,与术者经验直接相关,大范围的楔形切除常伴有术后咯血、肺膨胀不全等并发症,且无法保证区域淋巴结采样,具有一定的局限性。肺段切除一定程度上弥补了楔形切除的不足,其中又以解剖性部分肺叶切除术(anatomic partial lobectomy,APL)[8]为代表,该理念不仅仅包括标准的肺段/亚段切除,而且包括联合肺段/肺亚段切除,对术者要求较高,有较长的学习曲线,尤其是复杂的联合亚段/多亚段切除,需精准离断组织深部的血管及支气管,较难掌握,且增加术中出血、术后咯血、漏气的发生率。
在我们尝试的所有病例中,涉及了大部分常规肺段及亚段切除,其中左上叶尖后段及其亚段病例较多,分析可能与其解剖特点有关,对于斜裂发育良好的病例,后入路离断亚段动脉后即可荧光显影,操作简单;对于无变异的舌段及其亚段、背段、右上叶后段、中叶亚段、下叶前基底段肺切除,该思路同样适用;对于右上叶尖段及其亚段、右上叶前段及其亚段、左上叶尖后段尖亚段、左上叶前段切除,因静脉遮挡的原因,需视情况处理静脉后,方可暴露后方动脉再行离断;对于下叶后、外基底段结节,动脉需充分游离方可暴露,亦可使用单项式手术方法先从静脉入手;对于叶裂完全未发育者,则需视情况使用该方法。另外,对于多发病灶拟同期行多肺段切除者,该方法同样适用,但对于某些距胸膜较近的小结节,我们还是建议采用楔形切除,以达到最小的肺损失。
对于淋巴结的处理,我们常规采样纵隔(N2)、肺门(第10组)、叶间(第11组)、肺内(第12组)、段间(第13组)淋巴结,尤其是结节所属肺内、段间的淋巴结予常规送检冰冻[9],一旦提示阳性,除拟意向性肺段切除者,应考虑改为肺叶切除。第12、13组淋巴结的采样方法:因动脉与支气管伴行,在解剖靶段动脉时即可采样动脉旁第12组淋巴结;因靶肺切除范围基本等同于常规肺段,故亚段淋巴结得以完整保留,在靶肺离体后可解剖第13组淋巴结送冰冻检查,或部分结节视情况予石蜡固定后检查。
本组手术过程均顺利,安全切缘均能保证,无二次扩大切除及中转肺叶切除,无严重术中及术后并发症。正因为基于“流域分析”,术前无需有创定位,且靶肺切除的范围基本等同于解剖性肺段切除,较楔形切除更精准,切缘合理,术后并发症少;且能区域淋巴结采样,使术后分期科学、合理;由于简化手术流程,与常规解剖性肺段切除相比,手术时间、术中出血量、术后引流时间均有一定优势;另外,能够独立开展常规肺段切除的医师可迅速掌握该方法,对于初学者,难点主要在于靶段动脉的准确辨认,但较常规肺段手术更容易。
本方法也存在一定局限性,荧光胸腔镜尚未在基层医院广泛使用,使该技术的应用受到一定限制,但是在靶动脉精准离断后,同样可以通过“膨胀-萎陷”方法获得段间平面。根据段支气管流域划分的靶肺段区域容积小于靶段动脉划分肺段区域[10],故具体操作时还需根据重建结果适当调整切割范围。另外,本文是回顾性研究,因技术开展时间短,病例数少,随访时间有限,该术式的优点仍有待与传统解剖性肺段切除进行随机对照研究进一步证实。
总之,基于“流域分析”的解剖性部分肺切除术,步骤简单,无需术前定位,术后并发症少,可适用于大部分拟行亚肺叶切除的早期周围型肺癌,初步研究结果认为该方法安全、可行。

