Neuroform Atlas支架在颅内动脉分叉处宽颈动脉瘤栓塞中的应用体会
申 猛 陈清亮 梁 昊 李照军 刘瑞芳 马 骥 李腾飞
(河南省直第三人民医院影像介入科,郑州 450006)
颅内动脉分叉处的动脉瘤血流动力学及解剖结构复杂,破裂出血发生率更高,血管腔内治疗难度大,并发症发生率高,部分专家更倾向于外科开颅夹闭术[1]。随着神经介入器材的研发及技术的革新,如“Y”形或“T”形组合支架技术、“冰激凌”技术以及瘤内血流导向装置(Web)等的应用,该区域动脉瘤血管腔内治疗成功率逐步提高[2~4]。Neuroform Atlas(美国Stryker公司)是一款针对复杂部位动脉瘤设计的新型激光雕刻支架,2018年1月获得美国FDA批准,2020年7月进入我国市场。相对于普通的Neuroform EZ支架,其输送和释放可通过管径更细的微导管(0.0165英寸)输送释放,更有利于在细小载瘤动脉或瘤颈区迂曲程度较大,预计常规支架导管通过困难的动脉瘤患者中应用。本研究回顾性分析2021年1~9月由同一手术团队于河南省直第三人民医院(12例)和郑州大学第一附属医院(4例)采用Neuroform Atlas支架辅助弹簧圈栓塞的16例颅内动脉分叉处宽颈动脉瘤的临床和影像学资料,探讨该支架在颅内动脉分叉处动脉瘤治疗中的临床疗效和安全性。
1 临床资料与方法
1.1 一般资料
本组16例,男10例,女6例。年龄32~71岁,(55.3±18.5)岁。10例因突发蛛网膜下腔出血急诊入院,入院至手术间隔时间1.5~8.3 h,(3.5±1.9)h,术前Hunt-Hess分级[5]Ⅰ级6例(无症状或轻微头痛及轻度颈强直),Ⅱ级2例(中~重度头痛,颈强直,除有脑神经麻痹外,无其他神经功能缺失),Ⅲ级2例(倦睡,意识模糊,或轻微的灶性神经功能缺失);6例无症状体检行头颅磁共振脑血管成像(magnetic resonance angiography,MRA)检查发现。16例均经头颅CT平扫及血管成像(computed tomography angiography,CTA)或全脑数字减影血管造影(digital subtraction angiography,DSA)明确诊断。均为宽颈小动脉瘤,位于大脑中动脉分叉处8例,大脑前动脉与前交通分叉处4例,大脑前、中动脉分叉处2例,大脑前动脉A2远端分叉处1例,大脑后动脉P2分叉处1例;瘤体直径1.5~4.0 mm,(2.50±0.72)mm;瘤颈长度1.5~4.0 mm,(2.16±1.02)mm;颈体比0.5~1.0,0.84±0.03;近心端载瘤动脉直径1.80~3.92 mm,(2.47±0.41)mm;远心端载瘤动脉直径1.2~2.8 mm,(1.78±0.19)mm。
纳入标准:①DSA检查确诊为颅内动脉分叉部宽颈动脉瘤(宽颈动脉瘤定义为动脉瘤瘤颈>4 mm或者动脉瘤的瘤颈∶瘤体>1∶2);②动脉瘤与两支血管均有关系,支架辅助栓塞治疗时可能会影响另外一支动脉血管的血流。
排除标准:①同时使用其他品牌支架或瘤内扰流装置(Web);②存在支架置入相关禁忌证,如合并消化道出血、血液系统疾病等无法使用抗血小板药物。
1.2 围手术期管理
未破裂动脉瘤常规术前3~5天开始口服阿司匹林100 mg/d+氯吡格雷75 mg/d抗血小板凝聚治疗,术中在股动脉鞘管置入后常规经静脉给予肝素2000 U,手术时间超过1 h追加肝素1000 U,术后继续口服双联抗血小板凝聚药物3~6个月。破裂出血动脉瘤术中释放支架时经静脉团注替罗非班0.005 mg/kg体重,最大剂量不超过0.3 mg,然后微量泵持续0.5~0.6 mg/h泵入30 h,停止泵药前2 h皮下注射低分子肝素钙5000 U/d连续2 d,双联抗血小板药物于术后6 h左右口服进行抗血小板药物重叠并于微量泵停用后继续口服3~6个月。调整抗凝药物,控制国际标准化比值(INR)1.5~2.0。为防止脑血管痉挛,破裂动脉瘤患者血管腔内治疗术中、术后1周内微量泵持续经静脉泵入尼莫地平。
1.3 介入治疗方法
气管插管全身麻醉,全脑血管造影并三维血管图像重建,明确动脉瘤位置、形态及与载瘤动脉毗邻关系。测量动脉瘤瘤体高度、直径、瘤颈宽度、载瘤动脉近心端、远心端血管直径,选择动脉瘤栓塞治疗工作位以及支架释放最佳工作位角度。
Neuroform Atlas支架辅助下动脉瘤栓塞治疗方法:路图模式导引下,使用8F导引导管(Envoy,美国强生公司)配合6F中间导管(Navien 115 cm,美国ev3公司,或Tethys 115 cm,中国上海加奇公司)尽可能送至颅内动脉近动脉瘤水平。经中间导管将Neuroform Atlas支架输送导管(SL-10,美国Stryker公司)在微导丝配合下小心越过动脉瘤瘤颈送至预释放分叉动脉分支远端。支架预置入侧血管分支的判断标准:在脑血管3D图像上与瘤颈关系密切、瘤体栓塞后可能压迫或者堵塞的血管。根据支架置入侧血管的直径和迂曲程度选择Neuroform Atlas型号。输送弹簧圈微导管(Echelon-10,美国ev3公司)依据动脉瘤形态选择头端角度为90°、45°或直头,根据动脉瘤瘤颈具体情况对导管头端进行手工塑形,以便顺利进入瘤腔并保持栓塞过程中导管头端稳定。第一枚动脉瘤呈篮弹簧圈根据动脉瘤形态以及是否为破裂动脉瘤选择(Axium机械解脱弹簧圈,美国ev3公司;Target电解脱弹簧圈,美国Stryker公司;或Visee电解脱弹簧圈,中国山东维心公司)。弹簧圈投递过程中支架采用“半释放技术”,Neuroform Atlas支架释放至瘤颈部位后轻轻推送支架采用“成笼”技术或者“穹隆”技术(bulging technique),封堵瘤口的同时保护分叉另一侧的动脉不被脱出的弹簧圈堵塞。栓塞过程中对于破裂动脉瘤尽可能做到致密填塞,尤其是注意致密填塞动脉瘤破裂的部位,必要时适当配合填塞纤毛圈,以增加动脉瘤的即刻闭塞率。栓塞最终完成后进行造影证实分叉处血管均通畅后再完全释放支架。术后即刻C臂CT行头颅扫描,判断有无出血或出血量增加以及支架释放后的形态。
1.4 疗效评价
术后即刻和术后3~6个月DSA使用Raymond-Roy分级[6]评估动脉瘤闭塞情况:Ⅰ级,完全闭塞;Ⅱ级,近全闭塞(瘤颈残留或犬耳征);Ⅲ级,部分闭塞(瘤体残留)。
使用Hunt-Hess分级[5]和改良Rankin量表(mRS)[7]对治疗前后和随访中的神经精神状况进行评估。
并发症:围手术期如支架内急性血栓形成或栓子脱落等引发的缺血性脑卒中,动脉瘤破裂出血等;随访期间新发卒中或动脉瘤破裂出血等。
2 结果
16例手术均在Neuroform Atlas单一支架辅助下顺利完成,技术成功率100%。术后即刻造影显示血管分叉处上下分支血管血流均未受到影响,Raymond-Roy分级Ⅰ级13例,Ⅱ级2例,Ⅲ级1例。6例因出血量大,脑血管痉挛,血管腔内治疗术后24 h行腰大池引流,至脑脊液颜色接近正常时拔出引流管。围手术期未发生脑出血或支架内血栓形成等血管腔内治疗相关并发症。术后住院4~21 d,(9.4±5.6)d。出院前mRS评分0~1分11例,2分3例,3分2例。10例动脉瘤破裂出血者出院前Hunt-Hess分级Ⅰ级8例,Ⅱ级2例。
16例均获得临床随访,随访时间3~14个月,(7.8±3.2)月,mRS评分0~1分14例,2分1例,3分1例。9例术后3~6个月复查DSA,Raymond-Roy分级Ⅰ级8例,Ⅱ级1例,均未见载瘤动脉狭窄或支架内闭塞。典型病例图像见图1、2。
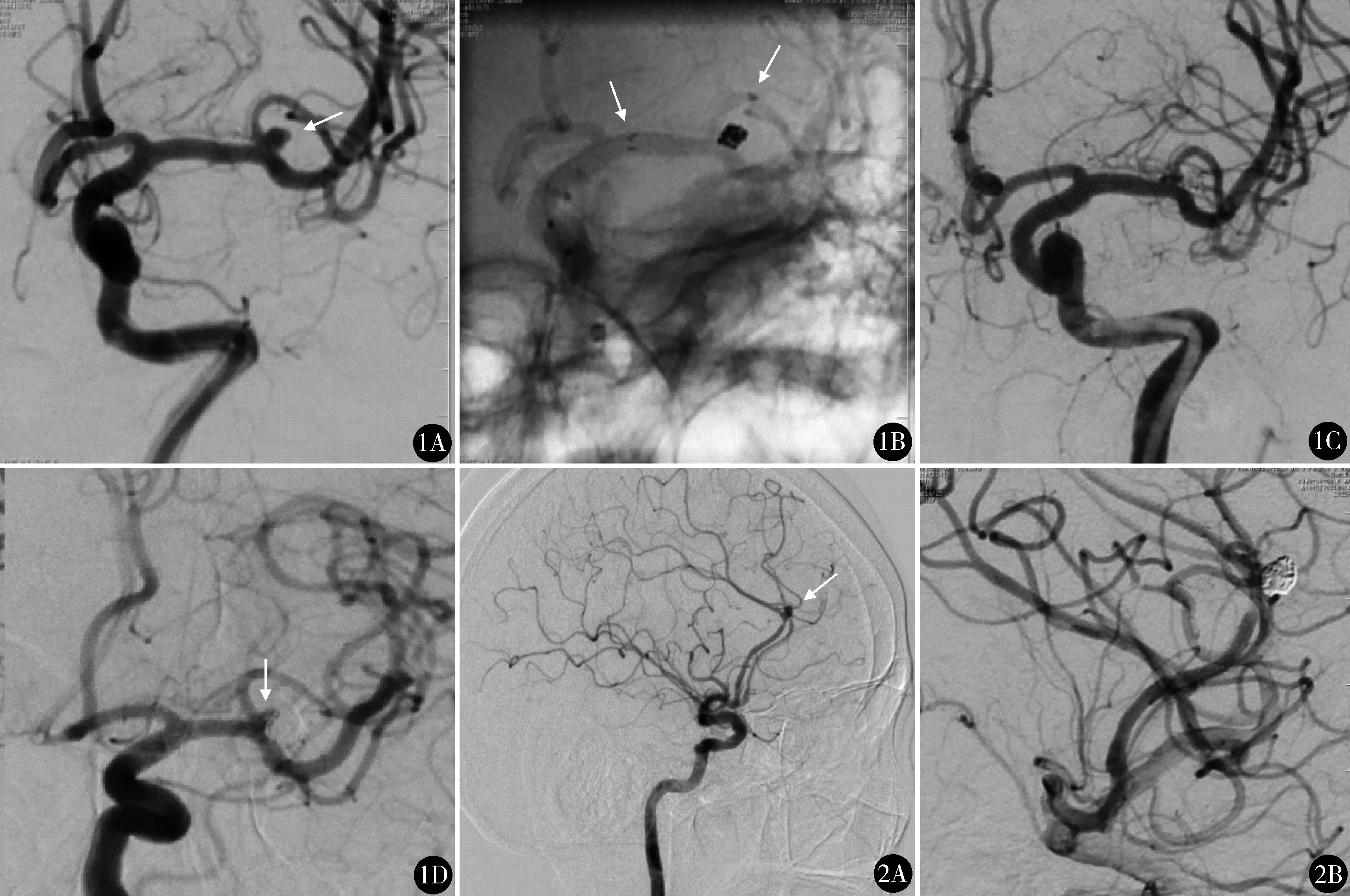
图1 Neuroform Atlas支架辅助栓塞左侧大脑中动脉分叉处动脉瘤(男,45岁,体检发现左侧大脑中动脉分叉处动脉瘤):A.工作位DSA显示左侧大脑中动脉分叉处动脉瘤,直径2.6 mm×2.2 mm,宽颈,动脉瘤瘤颈与M2上分支关系密切(箭头指示动脉瘤);B.Neuroform Atlas 3.0 mm×21 mm支架辅助下瘤颈区采用“穹隆”技术完成栓塞(箭头指示支架两端标记);C.复查造影显示动脉瘤闭塞完全(Raymond-Roy分级Ⅰ级),同时分叉处M2两分支血管血流通畅;D.6个月复查造影显示左侧大脑中动脉主干和M2两分支血管血流通畅,动脉瘤瘤颈区少许造影剂残留(Raymond-Roy分级Ⅱ级) 图2 Neuroform Atlas支架辅助栓塞右侧大脑前动脉A2远端分叉处动脉瘤(男,65岁,突发头痛1天入院);A.工作位DSA显示右侧大脑前动脉A2远端分叉处破裂动脉瘤,直径2.1 mm×1.9 mm,宽颈,形态不规则(箭头指示动脉瘤);B.Neuroform Atlas 3.0 mm×15 mm支架先跨动脉瘤瘤颈释放,后栓塞微导管采用“穿支架网眼”技术完成栓塞,即刻造影显示动脉瘤闭塞完全(Raymond-Roy分级Ⅰ级),载瘤动脉血流通畅
3 讨论
颅内动脉血管分叉处宽颈动脉瘤好发于大脑中动脉和大脑前动脉分叉部位。该部位动脉瘤与分叉的两支血管都有关联,血流动力学复杂,破裂风险相对较高,一经确诊,多建议采取积极的处理措施[8]。血管腔内治疗分叉处动脉瘤具有微创、恢复快、总体获益率高的特点,治疗的难点和风险在于血管分叉走向变化较大,载瘤动脉管径相对小,分叉动脉粗细不均衡,部分分叉动脉与分叉前动脉管径差距较大,且大部分病例位于Willis环远端,导管走行路径远,导管进入分叉动脉释放支架以及导管选择性进入瘤腔内难度较大,加上动脉分叉处特殊的解剖关系,在瘤腔内填塞或者支架释放后造成血管位移和变形,会影响另外一支血管的血流,对支架的适形性和支撑力都有较高的要求。所以早期的颅内动脉分叉处动脉瘤血管腔内治疗效果难尽人意。加上该区域动脉瘤位置多表浅,开颅后比较容易发现,夹闭技术较其他部位的动脉瘤更直观、简单。基于上述原因,对于该区域的动脉瘤,部分神经外科专业医师更倾向于外科开颅直视下夹闭手术。因此,目前颅内血管分叉处特别是大脑前动脉和大脑中动脉及以远的动脉瘤的治疗方法仍有争议。
随着宽颈动脉瘤支架辅助栓塞技术的普及,血流导向装置的应用,以及神经介入学领域新技术和新材料的出现,分叉部位宽颈动脉瘤的血管腔内治疗逐渐增加。其中关于大脑中动脉分叉处宽颈动脉瘤的报道较多,腔内治疗效果满意[9~11]。我们将大脑中动脉分叉、大脑后动脉P2分叉、前交通以及A2远端血管分叉处的宽颈动脉瘤一同纳入,是因为其血管腔内治疗操作模式、手术难度和并发症都相似。
颅内动脉瘤血管腔内治疗经常使用的辅助支架目前有Neuroform EZ支架(美国Stryker公司)、LVIS Jr支架(美国MicroVention公司)、Enterprise支架(美国强生公司)、Leo baby支架(法国Balt公司)、Solitaire支架(美国Medtronic公司)以及国产的血流导向装置(上海微创神通公司Tubridge血管重建装置)等,支架输送导管从XT 27(3.0F)到Heady 17(2.3F)不等,对于大脑中动脉和大脑前动脉分叉甚至以远的病例而言,仍然存在输送导管管径宽、硬度大、不能顺利到达释放区域的弊端;特别是累及2个分叉血管的宽颈动脉瘤,可能需要2个支架叠加的“Y”形释放技术,不但增加技术操作难度,延长手术时间,也增加并发症发生率,而且2个支架叠放后,血栓形成和血管狭窄发生率也会相应增加[12]。以上不足是限制颅内动脉分叉处动脉瘤血管腔内治疗广泛应用的重要因素。
Neuroform Atlas支架是Neuroform系列的新产品,为半开环激光雕刻自动膨胀式支架,具有良好的可通过性、适形性和贴壁性,可通过更细、更柔软的导管输送(输送导管SL-10内径0.0165英寸),同时支架释放后径向支撑力及贴壁性较Neuroform EZ支架并不降低,在纤细或者狭窄的分叉血管内释放后亦可保持管腔有效血流和良好贴壁。本组5例动脉瘤位于分叉正中,预计可能要采取双支架叠加“Y”形释放技术,经过支架“成笼”或者“穹隆”技术后,均单支架完成封堵瘤颈的同时又有效保全分叉动脉的血流。因该支架输送导管通过能力与Echelon 10相当,可顺利通过迂曲、延长、纤细的动脉血管,在颅内远端动脉分叉部位动脉瘤优势更加明显。本组2例大脑前、中动脉分叉处动脉瘤,均顺利完成支架辅助下瘤腔填塞。此外,本支架为开环设计,微导管穿过性好,可以采用先释放支架再将栓塞导管采用穿网眼技术进入动脉瘤内的模式,适用于支架释放后栓塞导管脱出瘤腔,或载瘤动脉狭窄或纤细不足以同时2根微导管操作的病例。本组1例采用该操作模式顺利完成动脉瘤栓塞。
本组16例未观察到围手术期并发症。分析原因,一方面可能与样本量较少有关,另一方面得益于Neuroform Atlas支架自身的优越性,支架本身缩短率低,打开顺利,便于精准释放,而且纵向变形力弱,顺应性和适形性良好,支架释放后血管纵向变形小,对分叉血管或者载瘤动脉主干扰动小,理论上能减少相关小血管出血和梗塞的发生,此外,金属覆盖率低,支架内血栓形成发生率低。本组围手术期内及3~6个月随访结果显示释放支架的动脉均通畅,与王红平等[13]的结果相似。Neuroform Atlas支架拓宽了颅内动脉分叉部位动脉瘤血管腔内治疗的适应证范围,近期疗效肯定。
综上所述,初步研究认为采用Neuroform Atlas支架辅助弹簧圈栓塞颅内动脉分叉处宽颈动脉瘤,操作技术相对简单,临床效果好,并发症发生率低。但本组样本量少,随访时间短,尚需要多中心、大样本研究验证其安全性和中、远期疗效。

