沙库巴曲缬沙坦对持续性房颤患者心脏结构及功能的影响*
张 骏,高玉英,李 巧,代 容,郭 盛,陈 杰
(重庆市荣昌区人民医院心血管内科 402460)
心房颤动(简称房颤)是一种常见的心律失常,是导致患者发生缺血性卒中和心力衰竭的重要原因[1],药物及手术治疗均存在较高的复发率,难以达到满意的治疗效果。就其原因与心房结构和电重构及自主神经系统功能障碍有关,其中心房结构重塑可能是所有房颤发生及治疗后复发的关键环节[2]。有研究显示,肾素-血管紧张素-醛固酮系统(RAAS)激活后的心房重构是导致房颤复发的主要原因之一[3]。血管紧张素Ⅱ(AngⅡ)是RAAS的主要介质,外周血AngⅡ水平越高,心房纤维化程度越严重,房颤发生率越高[4]。同时相关动物实验研究也证实,使用血管紧张素受体阻滞剂可阻断RAAS激活,逆转心房纤维化,降低房颤的发生率[5]。沙库巴曲缬沙坦是血管紧张素受体和脑啡肽酶受体的联合抑制剂,目前常用于心力衰竭患者的临床治疗,可以明显逆转心室重构,降低患者再住院率和死亡率[6],但对房颤患者心脏结构及功能的影响,尚缺乏前瞻性研究。有鉴于此,本研究以持续性房颤经复律后的患者作为研究对象,在使用胺碘酮维持窦性节律的基础上,加用沙库巴曲缬沙坦,观察心脏结构及功能的改变、房颤复发率等指标,以期为持续性房颤的临床治疗提供新的策略。
1 资料与方法
1.1 一般资料
选取2020年9月至2021年1在本院接受治疗的持续性房颤患者120例为研究对象。纳入标准:(1)根据病史、体格检查及辅助检查(心电图、24 h动态心电图及超声心动图)确诊为持续性房颤;(2)超声心动图测量左心房前后径20~50 mm;(3)年龄18~75岁。排除标准:(1)瓣膜性房颤及先天性心脏病;(2)合并严重感染性疾病;(3)严重肝肾功能不全、肿瘤、血液或免疫系统疾病;(4)甲状腺、慢性阻塞性肺疾病;(5)低血压、电解质紊乱;(6)沙库巴曲缬沙坦和胺碘酮治疗药物禁忌;(7)超声心电图检测左心房血栓。本研究通过医院伦理委员会审核,患者及家属知情同意。
1.2 方法
1.2.1分组治疗
入组患者口服胺碘酮(杭州赛诺菲,批号:H19993254)0.2 g,每天3次,10~14 d复律治疗(此时尚未恢复为窦性心律的则予以电复律),对于能够维持稳定窦性心律的患者,分为两组,每组60例。对照组继续单独服用胺碘酮 0.2 g,每天3次;观察组在对照组基础上加用沙库巴曲缬沙坦(北京诺华,批号:J20190001)50 mg,每天2次,血压稳定者可将沙库巴曲缬沙坦逐渐加至 100 mg,沙库巴曲缬沙坦治疗时间为12个月。两组服用胺碘酮 0.2 g,每天3次至1个月,第2个月减量为 0.2 g,每天2次,第3个月减量至 0.2 g,每天1次,之后维持该剂量至第12个月。
1.2.2随访
在试验开始后的1、6及12个月进行电话或门诊随访,内容包括有无心悸、胸闷、憋喘、乏力等症状的发作、服用药物的依从性及对药物有无不良反应发生。在整个随访过程中患者若有不适可以及时电话咨询随访医生或于门诊行心电图检查后咨询随访医生。
1.2.3观察指标
(1)血流动力学指标:两组治疗前和治疗后1、6及12个月心率、平均动脉压、血氧饱和度;(2)左心房结构:两组治疗前和治疗后1、6及12个月采用心脏超声(Philips,EPIQ7C)检测左心房内径(LAD)、左心房容积(LAV)、左心房容积指数(LAVI)和左心房存储应变(LASr);(3)左心室结构及功能:两组治疗前和治疗后1、6及12个月采用心脏超声检测左心室射血分数(LVEF)、舒张末期内径(LVEDD)、收缩末期内径(LVESD)及氨基末端脑钠肽前体(NT-pro BNP)水平;(4)心脏 MRI:两组治疗前和治疗后12个月采用心脏MRI(Siemens,Prisma 3.0T MR仪)检测左心房结构,包括LAD、左心房最大容积(LAVmax)、左心房射血分数(LAEF);(5)记录治疗后1、6及12个月房颤复发率。上述检查采用随机双盲,且检查者为独立工作人员,未参与该研究。
1.3 统计学处理
2 结 果
2.1 两组患者基线资料比较
两组患者性别、年龄、BMI、吸烟史、饮酒史、房颤持续时间、卒中评分、CHA2DS2-VASC 评分及基础疾病等方面比较,差异无统计学意义(P>0.05),见表1。

表1 两组一般临床指标比较(n=60)

组别卒中评分(x±s,分)CHA2DS2-VASC评分(x±s,分)基础疾病[n(%)]高血压糖尿病冠心病对照组3.7±0.33.1±0.428(46.7)22(36.7)19(31.7)观察组3.8±0.23.2±0.327(45.0)23(38.3)20(33.3)
2.2 两组患者治疗前后血流动力学指标和房颤复发率比较
两组患者治疗前心率、平均动脉压及血氧饱和度比较,差异无统计学意义(P>0.05);与治疗前比较,两组患者治疗后1、6、12个月心率明显降低,观察组降低更明显(P<0.05),而平均动脉压和血氧饱和度比较差异无统计学意义(P>0.05)。与对照组比较,观察组治疗后12个月房颤复发率明显降低(P<0.05),见表2。
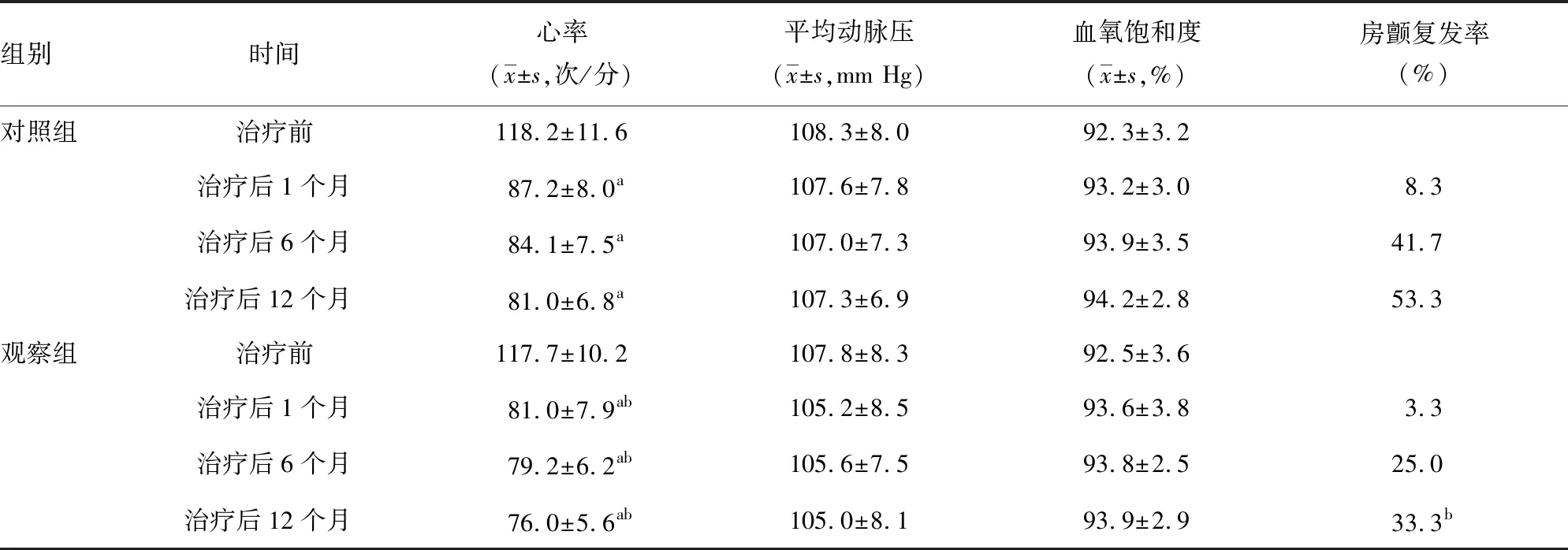
表2 两组患者治疗前后血流动力学指标和房颤复发率比较(n=60)
2.3 两组患者治疗前后左心房结构相关指标比较
两组患者治疗前左心房结构相关指标比较,差异无统计学意义(P>0.05);与对照组比较,观察组治疗后1、6、12个月 LAD、LAV、LAVI明显降低,而LASr明显升高,差异有统计学意义(P<0.05),见表3。

表3 两组患者治疗前后左心房结构相关指标比较
2.4 两组患者治疗前后左心室结构及功能指标比较
两组患者治疗前左心室结构及功能比较,差异无统计学意义(P>0.05);与对照组比较,观察组治疗后1、6、12个月 LVEDD、LVESD、NT-pro BNP明显降低,LVEF明显升高,差异有统计学意义(P<0.05),见表4。

表4 两组患者治疗前后左心室结构及功能指标比较
2.5 两组患者治疗前后心脏MRI相关指标比较
两组患者治疗前心脏MRI结构及功能比较,差异无统计学意义(P>0.05);与对照组比较,观察组治疗后12个月LAD、LAVmax明显降低,LAEF明显升高,差异有统计学意义(P<0.05),见表5。

表5 两组患者治疗前后心脏MRI相关指标比较
3 讨 论
房颤是危害人类健康的重要心血管疾病之一。2018 年中国心血管报告中指出房颤患病率约0.77%,预计总患病人数高达800万~1 000万[7]。房颤的主要危害是增加体循环血栓栓塞的风险,无论是阵发性房颤,还是持续性房颤,其导致的最为严重的并发症是缺血性卒中[8]。房颤患者的卒中发生率比无房颤者增加近5倍,占卒中患者的15%~20%,且发生率随着年龄增长而增加[9]。因此,针对房颤的防治,已成为临床研究工作的热点与难点。
目前,房颤发生的确切机制尚未有定论,心房的电重构、结构重构和自主神经重构均可诱发房颤的发生[10]。RAAS是体内重要的神经内分泌系统,是心脏电、结构及自主神经重构的重要环节。房颤患者存在不同程度的 RAAS激活,其机制可能与AngⅡ引起心房肌细胞内钙超载、导致瞬时外向钾电流、起搏离子电流通道蛋白表达和电流密度异常等有关[11]。动物实验研究表明,血管紧张素受体抑制剂可以抑制心房有效不应期的缩短,心肌细胞传导速度减慢、传导异质性增加,提示AngⅡ在房颤的电重构中起着重要作用[4]。同时临床研究表明,血管紧张素受体拮抗剂缬沙坦可降低房颤新发风险,特别是对于射血分数降低的患者,加入缬沙坦,房颤的发生率可降低37%[12]。沙库巴曲缬沙坦是治疗心力衰竭的创新药物,但对于房颤患者心脏结构及功能的影响,相关研究较少。
近年来,房颤的治疗策略包括:抗栓治疗、控制过快的心室率(心率控制)、转复和维持窦性心律(节律控制)、改善心房基质的上游治疗等。胺碘酮作为预防房颤复发的经典药物,对于维持窦性节律显示出了较好的临床治疗效果,本研究通过在胺碘酮维持窦性节律的基础上加用沙库巴曲缬沙坦,观察房颤患者心脏结构及功能的变化。结果显示,加用沙库巴曲缬沙坦后,可明显降低患者房颤复发率,其可能通过多种机制影响房颤的发生及发展。左心房扩大与房颤的发生密切相关,与SOLOMON等[13]研究结果一致。一项荟萃分析表明,在射血分数降低的心力衰竭患者中,与服用血管紧张素受体拮抗剂相比,沙库巴曲缬沙坦可降低心肌肥大和心肌纤维化[14]。除此之外,沙库巴曲缬沙坦还可减轻心肌梗死后心脏重塑和功能障碍[15]。本研究通过心脏MRI检查发现,房颤患者在服用沙库巴曲缬沙坦1年后,可有效降低LAD,提高LAEF。由于房颤是心力衰竭的重要危险因素,其临床预后较差,因此上游的有效控制与管理,对于预防或减缓房颤的进展至关重要。
综上所述,沙库巴曲缬沙坦可明显改善持续性房颤患者心脏结构及功能。但本研究也存在一定局限性,样本量偏小,同时纳入的患者为单中心,相关不良心脑血管事件较少,无法就改善心脏重构后与减少不良心脑血管事件的相关性进行分析。

