皮肤性病门诊患者HPV基因型分布特征研究*
李春花,王有为,罗才会,李雪茹,田咏梅
电子科技大学附属医院/四川省人民医院临床医学检验中心,四川成都 610072
人乳头瘤病毒(HPV)是尖锐湿疣的病原体,尖锐湿疣是以生殖器部位皮肤黏膜的良性增生性损伤为主的一种性传播疾病,其复发率及传染性强,居国内性传播疾病的第二位[1]。高危型HPV感染与阴茎癌[2-3]、宫颈癌[4-6]、口咽鱗状细胞癌[7-8]等发病密切相关。因此HPV的检测,特别是HPV-DNA分型检测对疾病的预防、早期发现与治疗有重要意义[9-11]。据文献报道,HPV亚型的分布因地区不同而有所区别,感染与致病力因亚型的不同而有所差异[12-15]。为了解成都地区HPV的流行特征,比较四价与九价HPV疫苗对其覆盖率的差异,本研究对2018年1月至2019年6月于本院皮肤性病门诊就诊患者的HPV感染情况进行分析,并进一步研究了HPV21型基因分型特征,为HPV相关疾病的防治提供临床依据。
1 资料与方法
1.1一般资料 选择2018年1月至2019年6月于本院皮肤性病门诊进行HPV检测且未接种过HPV疫苗,近3个月内未接受系统或局部免疫治疗,未局部使用抗病毒药物治疗的16~80岁初诊患者3 303例,平均年龄33.7岁。所有患者均自愿进行HPV基因型别检测,并签署知情同意书。
1.2仪器与试剂 HPV分型检测试剂盒(广东凯普生物科技有限公司)、实时荧光定量PCR扩增仪(广州达安基因科技有限公司)、核酸分子快速杂交仪(广东凯普生物科技有限公司)、恒温金属浴(杭州博日公司)、高速低温离心机(德国Eppendorf公司)。
1.3方法
1.3.1标本的采集与保存 先用消毒棉签拭去皮损表面分泌物,以专用脱落细胞采集器采样,采取皮损组织液及脱落细胞,将其放入装有细胞保存液的标本管中,在管口处将多余的刷柄折断,将刷头留在标本管中,旋紧管盖,于4 ℃保存,并在3 d内检测。
1.3.2病毒DNA的提取 将采有标本的细胞保存液管振荡混匀,取0.8 mL到EP管中,12 000 r/min离心5 min,去上清液,加入400 μL溶液Ⅰ,混匀,100 ℃裂解15 min,加入400 μL溶液Ⅱ,混匀,放置5 min,12 000 r/min离心5 min,去上清液,12 000 r/min离心1 min,再次去上清液,加入60 μL溶液Ⅲ充分溶解提取DNA。
1.3.3导流杂交技术检测HPV-DNA 将提取的DNA用荧光定量PCR仪进行扩增,将PCR扩增产物25 μL在95 ℃变性5 min后立即冰浴2 min,再与导流杂交仪含DNA单链探针膜条上0.5 mL的预热至45 ℃的杂交缓冲液混合孵育15 min,然后进行导流杂交。杂交后再用0.8 mL杂交缓冲液清洗3次,在25 ℃条件下,用封阻液封阻孵育5 min后,加入0.5 mL酶标液孵育3.5 min,用冲洗缓冲液A清洗杂交膜,去除未结合的酶标液。显色过程加入0.5 mL NBT/BCIP底物在36 ℃保持3~5 min,显色后1 h内分析结果,包括15种高危型(16、18、31、33、35、39、45、51、52、53、56、58、59、66、68型),6种低危型(6、11、42、43、44、CP8304型)。
1.4统计学处理 采用SPSS26.0统计软件进行统计学分析。定性资料采用例数或百分率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1HPV感染模式的性别构成 在3 303例检测标本中,男2 101例、女1 202例,共检出HPV阳性1 802例,检出率为54.56%。HPV检出率在男性和女性就诊者中分别为53.26%(1 119/2 101)和56.82%(683/1 202),两者比较差异有统计学意义(χ2=3.912,P=0.048)。单一基因型感染中男性感染低危型较女性感染比例高,差异有统计学意义(χ2=31.138,P<0.001);多重基因型感染中,男女性均以低危型合并高危型感染为主,且女性多重基因型合并感染高于男性,两者比例差异有统计学意义(χ2=23.753,P<0.001),见表1。
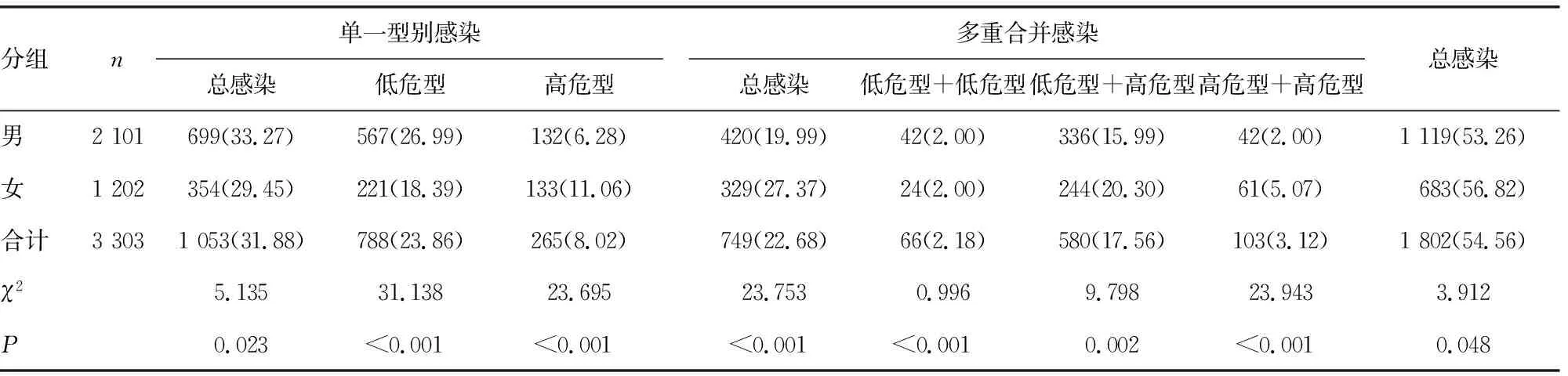
表1 HPV感染模式在不同性别患者中构成[n(%)]
2.2HPV感染模式分析 在1 802例HPV阳性检出者中,HPV 21种常见基因型的每个基因型都有检出,不同基因型检出比例见图1。感染模式及构成情况见表2。单一基因型感染主要以6、11、16、52、58型为主;多重感染模式中二重感染以6/11、6/16、6/52、6/58型为主,3重感染以11/16/52、6/39/52、6/51/CP8304型为主,4~7重感染中各型别均为散在随机分布,分别为67、34、15、6例;其中,四重感染中除了有5例基因型别是高危型+高危型组合外,其余4~7重感染均为低危型+高危型组合。
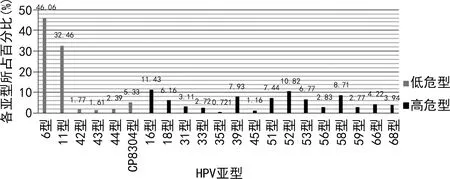
图1 HPV阳性检出者基因型别分布情况
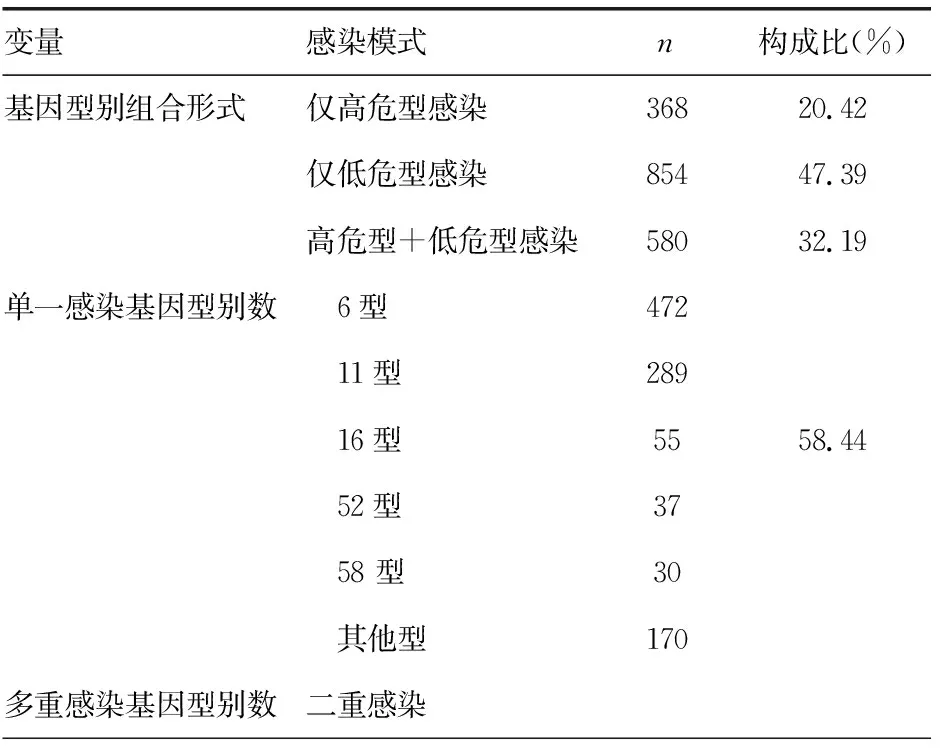
表2 HPV阳性检出者感染模式和基因型别分布基本情况(n=1 802)
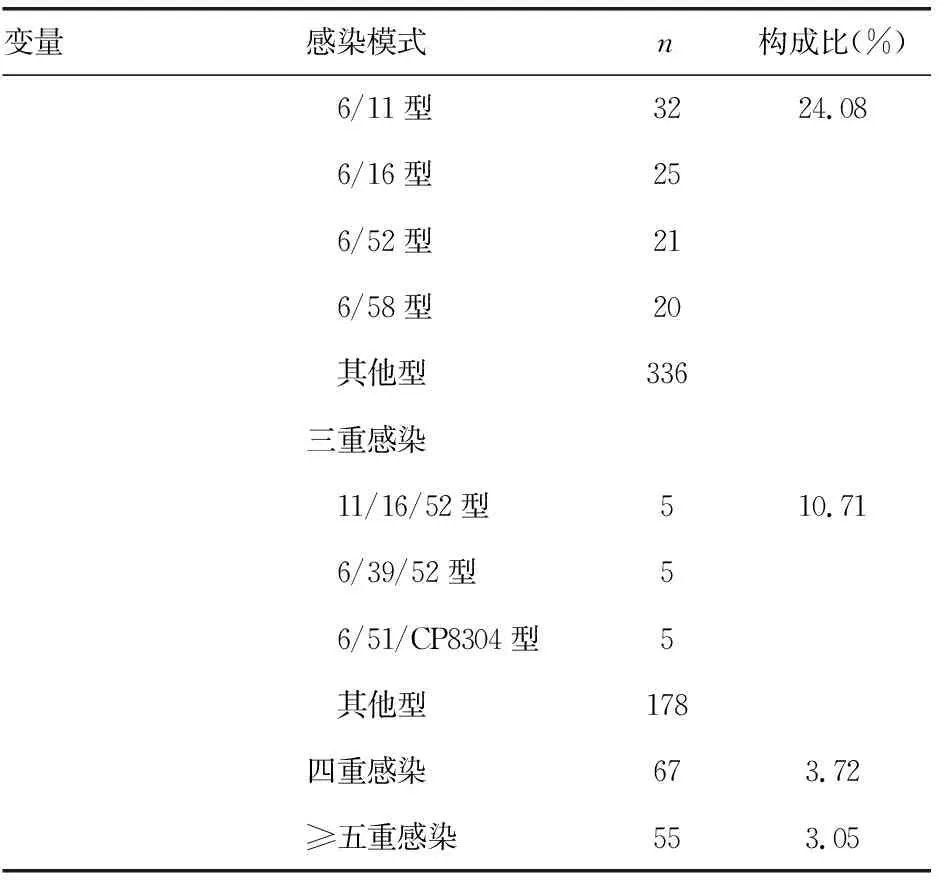
续表2 HPV阳性检出者感染模式和基因型别分布基本情况(n=1 802)
2.3HPV感染模式的年龄组构成 将3 303例患者分为6个年龄组,分别为<20岁,20~29岁,>29~39岁,>39~49岁,>49~59岁,>59岁,各年龄组HPV检出率比较,差异有统计学意义(χ2=12.937,P=0.024)。除<20岁和>59岁组以多重基因型感染为主,其余各组以单基因低危型感染为主;各年龄组多重基因型感染检出率比较,差异有统计学意(χ2=41.006,P<0.001),其中>59岁年龄组的多重基因型感染检出率明显高于其他年龄组。见图2和表3。
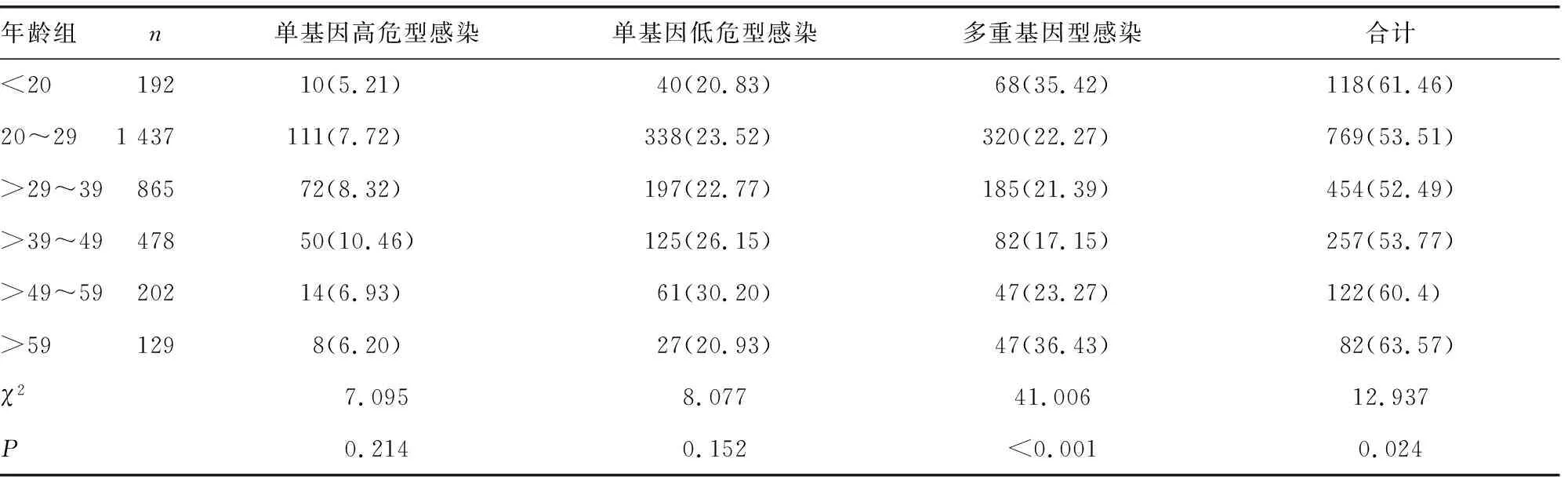
表3 HPV感染模式在不同年龄组患者中构成[n(%)]
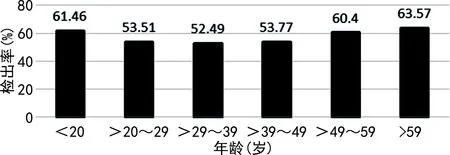
图2 HPV感染不同年龄组检出率的变化趋势
2.4四价及九价HPV疫苗覆盖率假设 假设本研究对象在感染HPV前预先接种HPV疫苗,则本研究纳入的1 802例HPV感染者中能被四价疫苗(HPV6/11/16/18型)和九价疫苗(HPV6/11/16/18/31/33/45/52/58型)完全覆盖例数分别为936例(51.94%)和1 165例(64.65%),两种疫苗的有效覆盖率经χ2检验差异有统计学意义(χ2=59.851,P<0.001)。
3 讨 论
HPV是一种结构为双链闭合环状小分子DNA病毒,无包膜,属于多孔病毒科乳头瘤病毒属。其感染有种属特异性特点,主要针对人的皮肤或黏膜上皮细胞,可导致尖锐湿疣以及宫颈病变,其中高危型HPV感染是宫颈癌发生的主要因素[5,9-11,16-18]。本研究3 303例皮肤性病门诊患者的HPV感染检出率为54.56%,明显高于国外报道的6.60%~45.20%[12,19-20],原因可能是皮肤性病门诊的多数患者为有症状而来就诊,或因性伴感染而来体检。本研究中单一的低危型感染检出率较高的是6型和11型,高危型感染检出率前5名的有16、52、58、39、51型,与国内外文献报道的尖锐湿疣患者的HPV亚型分布相似[12,21-23]。本研究显示多重合并感染形式有低-低危型、低-高危型和高-高危型三种,以二重低-高危型组合形式感染检出最多。
据本研究显示,HPV感染与患者性别因素关系非常密切,女性感染检出率明显高于男性,这与相关研究在2007年和2019年的研究报道一致[24-25]。在感染型别上,男性感染型别主要为6、11型等低危型,而女性感染型别主要为16、52、58型等高危型。男女HPV多重感染结果显示,女性多重感染检出比例明显高于男性,而且女性比男性更容易感染多重高危型HPV,这一结果与张琰等[21]、LI等[23]对尖锐湿疣患者的流行病学调查的结果相似。
据国外报道,HPV感染检出率随年龄分布呈“中间低两头高”的U型分布,感染检出率最低为40~49岁,两个感染高峰分别为18~29岁和70~79岁[6];本研究显示感染检出率最低为30~39岁,第1个感染高峰为<20岁,都比国外感染高峰提前了10岁左右,与国外研究稍有差异。<20岁和>59岁年龄组的感染检出率高于其他年龄组,可见本地区HPV的感染偏向年轻化和老龄化;<20岁患者性生活活跃以及性伴不固定,但生殖系统免疫相对不够成熟,易受HPV感染,而>59岁患者不安全性行为以及绝经期后女性免疫力下降、各项激素水平分泌较低、自身清除HPV能力降低等原因易受HPV感染[5,26],可见应加强对HPV感染的宣传教育、管理和干预。
大量研究表明,HPV感染是导致宫颈癌发生的主要危险因素,90%以上的宫颈癌患者有HPV感染[4-6,27]。HPV预防性疫苗主要以具有天然空间结构的合成L1晚期蛋白病毒样颗粒(VLP)作为主要靶抗原[28]。本研究显示九价HPV疫苗对研究人群的有效覆盖率更高,这与成媛媛等[29]的研究结果一致,提示九价HPV疫苗可能对本地区HPV感染高危人群免疫预防保护效果更好。因此,除适龄女性应接种HPV疫苗外,给男性也接种该疫苗将减少其HPV感染,降低其罹患HPV相关恶性病变的风险。
本地区HPV感染以单基因亚型为主,低危型以6、11型多见,高危型以16、52、58型多见;九价HPV疫苗可能比四价疫苗对HPV感染人群免疫预防保护效果更好。分析HPV感染基因型分布对HPV疫苗的开发应用和防治效果的评估以及预测不典型鳞状细胞、高危型HPV阳性而细胞学检查阴性的患者罹患HPV相关恶性病变的风险具有参考价值。

