酪蛋白胶束乳液凝胶性质及其在大黄素负载中的应用
瓦文强,秦娟娟,杨敏,魏彦明,*,袁子文,纪鹏,甄晨波
1(甘肃农业大学 理学院,甘肃 兰州,730070)2(甘肃农业大学 动物医学院,甘肃 兰州,730070)
酪蛋白是牛乳中含量最高的蛋白质,是一类结构相近且磷酸化的蛋白总称,主要包括αs1-、αs2-、β-和κ-酪蛋白4种单体。牛乳中,4种酪蛋白单体通过疏水、静电等相互作用形成直径大小为80~400 nm的近球形粒子,称为酪蛋白胶束[1]。酪蛋白胶束结构独特,内部由αs-、β-酪蛋白及矿物元素组成,形成多个疏水空腔,κ-酪蛋白覆盖在胶束表面形成毛发层,具有较好的亲水性;因此,酪蛋白胶束具有疏水内部和亲水表面,易溶于水,且结构较为稳定[2]。酪蛋白胶束可通过膜分离技术提取,其来源广泛、成本低廉、营养价值高,且具有可降解和生物相容性高等优点。
果胶是一种天然水溶性阴离子多糖,其中半乳糖醛酸含量超过65%,结构多样,来源广泛,价格低廉[3]。果胶具有降低胆固醇和血糖水平等功效,其抗结肠癌的效果尤为明显[3]。在食品工业领域中,果胶作为一种食品添加剂,可用于改善食品的口感、质地、外观等特性。近年来,众多研究发现,果胶作为天然大分子亲水性多糖,可以用来提高乳液的稳定性[4]。
乳液凝胶是一类具有特殊三维网络结构的凝胶,内部具有乳液的O/W或W/O结构,甚至可以是多相乳液结构,外观表现为凝胶。乳液凝胶不仅给予产品顺滑的口感,还可以用于负载活性分子,将其均匀分散在凝胶质地中,实现功能成分靶向输送[5]。乳化剂是乳液及乳液凝胶制备的关键成分之一。目前,食品工业用乳化剂多为化学合成的小分子物质,其食用安全性及添加量备受消费者关注。因此,选用具有一定乳化功能的天然大分子作为基质,是乳液及乳液凝胶的研究热点,其中以蛋白质-多糖复合物为基质的乳液及乳液凝胶制备倍受研究者青睐[6]。果胶不仅具有优良的乳化性,而且黏度较高,可通过位阻效应、静电斥力等作用稳定油滴,可显著提高乳液的稳定性,因此成为制备乳液及凝胶的常用多糖[7]。另外,还可通过Ca2+交联以促使果胶凝胶,提升其稳定性[3]。有研究指出,以玉米醇溶蛋白-果胶复合物为基质制备的O/W乳液稳定性高于单一基质制备的乳液[8]。酪蛋白具有较好的乳化性和凝胶性,是乳液及凝胶制备的主要蛋白质基材之一[5]。酪蛋白在乳液凝胶制备过程中不仅可用于乳化油滴,还可作为凝胶基质用于制备酸诱导和酶诱导凝胶[9]。另外,添加一定量的多糖可缩短酪蛋白凝胶时间[5]。然而,以酪蛋白胶束-果胶复合物为基质的乳液凝胶制备及性质研究鲜为报道。
乳液及乳液凝胶不仅可作为食品原料,赋予食品特殊质地和品质,还可用于活性分子负载和递送,提高其生物利用度。有研究指出,将姜黄素负载于以酪蛋白-大豆可溶性多糖为基质的O/W型乳液中,有效减缓了其降解,且乳剂组的姜黄素口服生物利用度比姜黄素/吐温-20混悬液组的生物利用度高11倍[10]。而且,酪蛋白酸钠-果胶复合基质的乳剂可用于负载表没食子儿茶素,有效减少了唾液黏蛋白诱导的乳液聚集,实现了对表没食子儿茶素的保护[11]。大黄素是一种从植物中提取的天然药物分子,具有多种药理活性,如抗炎、抗肿瘤、抗应激等[12]。还有研究表明,大黄素可以通过抑制HIF-1α、VEGF-α、EphA2、MMP-2蛋白的表达,抑制前列腺癌的血管拟态形成,从而抑制前列腺癌的发生[13]。然而,大黄素的水溶性较差,在加工、储藏和胃肠道环境中易氧化降解,因此口服大黄素的生物利用度很低。近年来,有研究表明,经脂质纳米粒负载后,大黄素稳定性提高[14]。另外,聚乳酸微球负载的大黄素肝肾毒性降低,缓释效果显著[15]。然而,乳液凝胶对大黄素的负载研究鲜有报道。
本文以胶束态酪蛋白-果胶复合物为基质,以溶解了姜黄素的大豆油作为油相,采用均质法制备出不同酪蛋白-果胶比例的乳液凝胶,系统分析了乳液凝胶的结构、理化性质及稳定性,通过体外模拟消化评价了凝胶中大黄素的释放过程,并研究了凝胶载体中大黄素的细胞毒性。研究结果可为大黄素凝胶剂型的开发提供参考依据。
1 材料与方法
1.1 材料与设备
酪蛋白胶束:巴氏灭菌牛乳,兰州天天鲜乳制品有限责任公司,采用离心机于4 000×g离心脱脂20 min后过100 kDa有机膜浓缩4倍;浓缩液经冷冻干燥即得胶束态酪蛋白。经测定,酪蛋白胶束中蛋白质质量分数为(83.26±1.87)%。
果胶、大黄素、脂肪酶(10万U/g)、胃蛋白酶(15 000 U/mg)、胰蛋白酶(2 500 U/mg)、猪胆盐、尼罗红、罗丹明B,上海麦克林生化科技有限公司;Cell Counting Kit-8,北京索莱宝科技有限公司;其余试剂均为分析纯。
AD500S-H均质机,上海昂尼仪器仪表有限公司;Bettersize 2000激光粒度分布仪,丹东百特仪器有限公司;Nicolet iS50 FTIR红外光谱仪,美国赛默飞世尔科学公司;XD3 X射线多晶衍射仪,北京浦肯氏通用仪器有限公司;STA 449 F5 TG-DSC热分析仪,德国耐驰仪器制造有限公司;H1850离心机,湖南湘仪有限责任公司。
1.2 实验方法
1.2.1 乳液凝胶的制备
参考宁雪莹等[16]的方法并稍做修改。将果胶溶解分散至pH 6.86、0.5 mol/L的磷酸盐缓冲溶液中,37 ℃恒温水浴下充分搅拌过夜至完全溶解(约15 h),质量浓度为0.2 g/L,备用。
将酪蛋白胶束溶解于pH 6.86、0.5 mol/L的磷酸盐缓冲溶液中,使酪蛋白胶束质量浓度为0.4 g/L。添加质量浓度0.2 g/L的叠氮化钠,备用。
将配制好的酪蛋白溶液和果胶溶液分别按照5∶5、6∶4、7∶3、8∶2、9∶1的体积比混合,在37 ℃恒温水浴锅内搅拌3 h,备用[不同体积比的酪蛋白-果胶复合物下文分别用M-P(5/5)、M-P(6/4)、M-P(7/3)、M-P(8/2)、M-P(9/1)表示]。将大黄素分散至食用大豆油中,室温下充分搅拌过夜至完全溶解(约15 h),使大黄素质量浓度为0.5 mg/mL,备用。取9 mL酪蛋白-果胶混合液与21 mL油相于烧杯中,均质机探头伸至液面下2/3处,室温下以14 000 r/min的转速均质3 min,之后储藏于4 ℃冰箱待用[不同比例的酪蛋白-果胶复合物所制备的乳液凝胶下文分别用M-P-O(5/5)、M-P-O(6/4)、M-P-O(7/3)、M-P-O(8/2)、M-P-O(9/1)、M-P-O(10/0)表示]。
1.2.2 乳液凝胶的CaCl2处理
在制备好的凝胶中添加适量0.05 mol/L的CaCl2溶液,使乳液凝胶完全浸泡其中静置6 h,之后将CaCl2溶液倒出,蒸馏水清洗凝胶表面,备用。
1.2.3 荧光显微镜观察
于酪蛋白-果胶混合液中添加0.1 μg/mL罗丹明B并搅拌均匀,油相中添加0.1 μg/mL尼罗红并搅拌均匀,采用1.2.1的方法制备凝胶,在荧光显微镜下观察微观结构。
1.2.4 粒径测量
采用激光粒度分布仪分别测定酪蛋白胶束溶液、果胶溶液以及不同配比下酪蛋白-果胶复合物的粒径,使用前仪器进行清洗和校零,水作为分散剂,平衡时间120 s,样品折射率1.35,介质折射率1.33。
乳液凝胶无法在水中均匀分散,故粒径测量采用光学显微镜观察并且拍照,然后使用软件ImageJ对显微镜照片中的油滴进行粒径统计分析。
1.2.5 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)测量
使用衰减全反射(attenuated total refraction,ATR)模式单元的红外光谱仪,记录各样品的红外光谱。
1.2.6 X射线衍射(X-ray diffraction,XRD)测量
使用X射线多晶衍射仪在Cu Ka辐射下连续扫描,扫描速率为5 °/min,分别记录各样品的X射线衍射谱图。
1.2.7 热稳定性分析
用TG-DSC热分析仪测定各样品的热稳定性。称量样品15~20 mg,置于氧化铝坩锅中,以5 ℃/min的升温速率从25 ℃加热至500 ℃,用空坩埚作空白对照。
1.2.8 贮藏稳定性
将制备好的乳液凝胶贮藏于4 ℃冰箱中,每隔一定时间取出观察并拍照记录;在光学显微镜下观察微观结构。
1.2.9 大黄素体外模拟释放分析
参考MOHAMMADIAN等[17]的方法并稍作修改。将1 g凝胶样品(或与凝胶中所含大黄素等量标品)置于3 mL pH 1.2模拟胃液(simulated gastric fluid,SGF)中(由2 g/L NaCl、7 mL/L HCl、3.2 g/L胃蛋白酶和5 g/L脂肪酶组成,最终pH值为1.2),装于透析袋(截留分子质量1 kDa)中。将透析袋置于含有150 mL释放介质的烧杯中,释放介质由75 mL乙醇和75 mL无酶SGF组成。在37 ℃、100 r/min下振荡2 h。将溶液的pH调至7.5,加入6 mL模拟肠液(simulated intestinal fluid,SIF),由6.8 g/L KH2PO4、10 g/L胰蛋白酶、5 g/L脂肪酶和12 g/L猪胆盐组成,最终pH为7.5。然后将透析袋置于含有150 mL释放介质的烧杯中,释放介质由75 mL乙醇和75 mL无酶SIF组成,并在37 ℃、100 r/min下振荡4 h。在每个特定时间点收集3 mL透析袋外溶液,并添加等体积新鲜介质。采用紫外-可见分光光度计在311 nm处测定透析液的吸光值,以同一释放介质中绘制的大黄素标准曲线为依据计算大黄素浓度,进而计算释放率。
1.2.10 细胞毒性评价
将大黄素标品及酪蛋白-果胶复合凝胶M-P-O(7/3)制备成不同质量浓度(5、10、20、40、80 μg/mL,培养基稀释)备用。在96孔板中配制100 μL的293T细胞悬液。将培养板在培养箱预培养24 h(37 ℃,5% CO2的条件下)。向培养板加入10 μL不同浓度的样品,在培养箱培育6 h。向每孔加入10 μL CCK-8溶液。在加CCK-8之前更换新鲜培养基(除去培养基,并用培养基洗涤细胞2次,然后加入新的培养基),去除药物影响。将培养板在培养箱内培育4 h后用酶标仪测定450 nm处的吸光度,计算细胞活力,如公式(1)所示。

(1)
式中:A加药,具有细胞、CCK-8溶液和药物溶液的孔的吸光度;A空白,具有培养基和CCK-8溶液而没有细胞的孔的吸光度;A0加药,具有细胞、CCK-8溶液而没有药物溶液的孔的吸光度。
1.2.11 数据统计分析
所有实验重复3次,数据以平均值±标准偏差表示。采用SPSS 26进行单因素方差分析,P<0.05差异显著。采用Origin 9软件进行作图。
2 结果与分析
2.1 凝胶显微结构及粒径分析
图1-a为采用粒度仪测定的不同比例下酪蛋白-果胶复合物粒径。酪蛋白胶束平均粒径为(190.72±6.04)nm,果胶平均粒径为(5 180.66±136.09)nm。当酪蛋白胶束与果胶以一定比例混合后,复合物粒径随着果胶添加量的增加逐渐增大,但依然为纳米级粒子。由此可见,与酪蛋白胶束混合后,果胶结构改变,粒径减小。果胶上的羧基基团pKa为3.5,酪蛋白胶束等电点为4.6,果胶与酪蛋白在不同pH条件下相互作用不同,形成的复合物类型不同[18]。研究指出,当体系pH接近中性时,酪蛋白胶束和果胶均带负电荷,二者发生排斥作用,可能形成相容的单相体系,2个大分子分布均匀,体系稳定;也可能形成两相,互不相容;二者形成的体系类型与其浓度有关[3]。本研究中,果胶浓度较低,当与酪蛋白胶束溶液混合时,在静电斥力作用下,果胶分子结构变化,形成粒径较小的粒子,充斥在酪蛋白胶束粒子之间,从而形成稳定的单相体系。因此,复合物粒径显著低于果胶粒径。随着果胶添加量的增大,混合物中果胶粒子数量增加,而果胶粒径大于酪蛋白胶束粒径,所以混合体系粒径随果胶添加量的增加而增大。

a-酪蛋白-果胶复合物粒径;b-乳液凝胶中油滴粒径分布;c-乳液凝胶M-P-O(7/3)荧光显微结构图1 酪蛋白-果胶复合物及乳液凝胶油滴粒径和显微镜照片Fig.1 Particle size of casein-pectin mixture and oil droplets in emulsion gels and optical micrographs of emulsion gels
图1-b为不同比例酪蛋白-果胶复合物乳液凝胶中油滴的粒径分布图。凝胶中油滴粒径随着果胶添加量的增加而减小。其中,酪蛋白胶束乳液凝胶油滴粒径为80 μm,当酪蛋白-果胶体积比为9∶1时,油滴粒径减小至60 μm,酪蛋白-果胶体积比为7∶3时,粒径降至40 μm,这与酪蛋白-果胶复合物的粒径变化趋势相反,说明酪蛋白-果胶复合体系的乳化性较单一酪蛋白胶束好,可以更好地降低油水界面的表面张力[19]。当酪蛋白-果胶体积比为5∶5、6∶4时,复合物黏度过大,难以与大豆油形成均一稳定的凝胶,因此后续实验不再考虑该比例。研究指出,油滴粒径减小不仅有利于增加乳液的稳定性,而且可缩短油滴间距离,从而增加乳滴间相互作用,进而赋予乳液更高的黏度[16]。因此,适量添加果胶可提升酪蛋白胶束乳液凝胶的稳定性。
乳液凝胶M-P-O(7/3)的荧光显微镜照片如图1-c所示,乳液类型为O/W,油滴粒径分布较为均匀。由于果胶浓度较小,且与酪蛋白胶束间形成静电斥力;而且果胶的乳化活性较酪蛋白差,因此酪蛋白胶束覆盖在油滴表面,果胶粒子充斥在油滴之间。酪蛋白胶束与果胶在静电斥力作用下,油滴粒径有所减小,有利于乳液稳定。另外,果胶增加了凝胶的黏度,从而提高了凝胶的稳定性。由此推断,酪蛋白胶束-果胶复合乳液凝胶稳定性高于酪蛋白胶束乳液凝胶。
2.2 乳液凝胶的红外光谱分析
酪蛋白、果胶及其不同比例复合物的红外光谱如图2-a所示。

a-酪蛋白-果胶复合物;b-乳液凝胶图2 酪蛋白-果胶复合物及乳液凝胶的红外光谱图Fig.2 FTIR spectra of casein-pectin mixture and emulsion gels

2.3 乳液凝胶的XRD分析
酪蛋白、果胶及复合物的XRD图如图3-a所示。酪蛋白、果胶为大分子,没有特征衍射峰,这与文献报道一致[22]。酪蛋白和果胶混合后,复合物的衍射峰有所偏移,说明果胶和酪蛋白胶束之间产生了物理作用,果胶结构发生改变,与粒径研究结果一致(图1-a);但复合物依然表现为大分子特征。酪蛋白-果胶复合物乳液凝胶的XRD图如图3-b所示。

a-酪蛋白-果胶复合物;b-乳液凝胶图3 酪蛋白-果胶复合物及乳液凝胶的XRD图Fig.3 X-ray diffraction spectra of casein-pectin mixture and emulsion gels
凝胶衍射峰与油的衍射峰位置基本一致,说明油滴均匀分布于凝胶内部。与大黄素标品XRD图谱相比,凝胶中大黄素的特征衍射峰消失,表明大黄素被完全包裹在乳液凝胶之中,处于内相,再次证实了乳液的O/W结构。
2.4 乳液凝胶的热稳定性分析
酪蛋白胶束、果胶及大豆油的热重(thermogravimetric,TG)曲线如图4-a所示。油的热稳定性最高,其主要失重出现在350~450 ℃,为油的汽化和分解温度。果胶和酪蛋白胶束第一失重阶段在70~100 ℃,为水分蒸发阶段。果胶第二失重阶段出现在200~300 ℃,为果胶的分解所致[23]。酪蛋白胶束的第二失重阶段为250~350 ℃,为胶束解离及酪蛋白分解阶段。可见,酪蛋白胶束热稳定性高于果胶。乳液凝胶的TG曲线如图4-b所示,乳液凝胶的失重曲线相似,说明各凝胶微观结构相似。乳液凝胶的第一失重阶段出现在70~100 ℃,主要原因为凝胶中水分汽化。随着果胶添加量的增加,第一阶段失重率增大,这是因为果胶浓度低于酪蛋白,所以水分含量增加,因此水分汽化引起的失重率随着果胶添加量的增加而增大。当温度升高至350~450 ℃,食用豆油开始汽化和分解,酪蛋白和果胶也开始分解,此时凝胶质量迅速降低。温度高于450 ℃之后,质量损失速度减缓,剩余残渣碳化,这与曹庆龙等的研究结果一致[24]。综上所述,酪蛋白-果胶复合乳液凝胶具有较高的热稳定性。

a-酪蛋白、果胶和大豆油的TG曲线;b-乳液凝胶的TG曲线图4 酪蛋白-果胶乳液凝胶的热稳定性Fig.4 Thermal stability of casein-pectin emulsion gel
2.5 乳液凝胶的贮藏稳定性分析
由图5-a可以看出,贮藏7 d后,乳液凝胶M-P-O(10/0)发生轻微分层现象,底层有少量水相析出;贮藏90 d后,乳液凝胶M-P-O(9/1)也出现乳析,而M-P-O(8/2)、M-P-O(7/3)尚未分层。贮藏240 d后,乳液凝胶M-P-O(8/2)、M-P-O(7/3)依旧未分层,说明这2个样品稳定性较高。由此可见,添加果胶提高了乳液凝胶的稳定性。

a-外观照片;b-显微镜照片图5 贮藏期间酪蛋白-果胶乳液凝胶外观和显微镜照片Fig.5 Apperance and optical micrographs of casein-pectin emulsion gel
酪蛋白胶束带有负电荷,形成乳液时胶束粒子覆盖在油滴表面,使其表面带上负电荷,在乳滴间形成静电斥力,起到稳定油滴的作用;添加果胶后,果胶充斥在油滴之间,与油滴表面酪蛋白胶束间形成静电斥力,进而增加油滴间斥力;另外,果胶黏度较大,也有利于阻止油滴聚集。因此,添加果胶后,乳液凝胶稳定性提升,且其稳定性随果胶添加量增加而增大。吕思伊等[4]研究证实,添加果胶有利于提高核桃蛋白乳液的稳定性,与本文研究结果一致。
由图5-b可以看出,酪蛋白胶束乳液凝胶油滴粒径大于酪蛋白-果胶复合乳液凝胶中油滴粒径,且油滴大小随着果胶添加量的增大而减小。贮藏7 d后,酪蛋白胶束乳液凝胶中油滴粒径略微增大,该现象在贮藏30 d时更加明显。贮藏90 d后,乳液凝胶M-P-O(9/1)的油滴粒径明显增大,这是由于小分子的油滴聚集所致。贮藏240 d后,乳液凝胶M-P-O(8/2)、M-P-O(7/3)的油滴粒径仍然未发生明显改变,这与凝胶的外观变化一致。由此可见,添加适量果胶后,酪蛋白胶束乳液凝胶稳定性显著提高,酪蛋白-果胶复合乳液凝胶的贮藏期较长,可用作药物载体。
2.6 乳液凝胶中大黄素的胃肠模拟释放分析
如图6所示,在模拟胃液中,大黄素溶解性差,释放率极低,而将其分散于凝胶中有利于提高其分散性和溶解性,因此凝胶中大黄素释放率高于游离大黄素。在模拟肠道消化中,随着消化时间的延长,大黄素的释放率呈上升趋势。累积消化240 min后,凝胶中大黄素释放率大于游离大黄素,这是因为凝胶中大黄素分散较好,溶解性增大,更易于扩散,而游离大黄素溶解性差,在肠液中难以分散,其扩散速率较低。肠液环境中,未添加果胶的凝胶中大黄素释放最快,因为其黏度较低,大黄素在凝胶内部扩散较快。
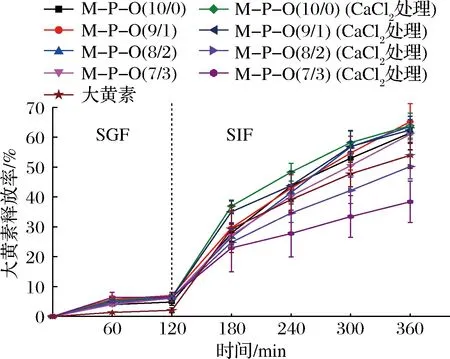
图6 酪蛋白-果胶乳液凝胶中大黄素的胃肠模拟释放曲线Fig.6 Simulated gastrointestinal release of emodin from casein-pectin emulsion gels
就CaCl2处理的凝胶而言,当果胶含量较低时,凝胶中大黄素释放速率与未交联凝胶相当。然而,当酪蛋白与果胶体积比达到8∶2时,大黄素释放率显著降低,且低于游离大黄素的释放率。当消化时间为360 min时,游离大黄素的释放率为(53.97±4.42)%,而CaCl2交联的M-P-O(8/2)和M-P-O(7/3)中大黄素的释放量分别为(50.21±4.14)%和(38.40±6.89)%。由于Ca2+可交联果胶,形成致密的网络结构,不仅提升了乳液凝胶系统的稳定性,而且减缓了大黄素在凝胶网络中的扩散速率。因此,乳液凝胶中大黄素的释放速率减缓[20,25]。综上所述,适宜的Ca2+交联有利于延缓酪蛋白-果胶复合凝胶中大黄素的释放。
2.7 乳液凝胶的细胞毒性分析
如图7所示,当大黄素质量浓度低于20 μg/mL时,细胞活力均大于90%,这说明低浓度大黄素标品对细胞的毒性较小。当大黄素质量浓度为40 μg/mL时,细胞活力下降至45%以下,且随着大黄素浓度的继续升高,细胞活力逐渐降低,表明高浓度大黄素对细胞有明显毒性。当大黄素被负载于乳液凝胶后,大黄素质量浓度≤80 μg/mL时,细胞活力均在85%以上。由此可见,酪蛋白-果胶复合乳液凝胶体系负载可显著降低大黄素的细胞毒性。
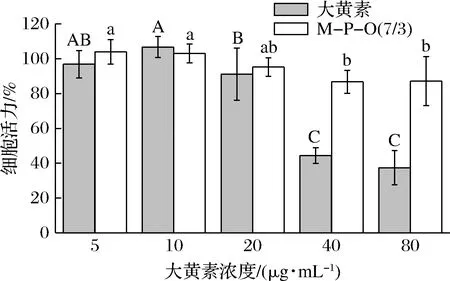
图7 乳液凝胶中大黄素的细胞毒性分析Fig.7 Cell cytotoxic analysis of emodin in emulsion gel注:不同字母代表差异显著,P<0.05
3 结论
以不同配比酪蛋白-果胶复合物为基质,将大黄素负载于油相,制备了含油量70%的乳液凝胶。通过显微镜观察发现,乳液凝胶为O/W型;添加适量果胶,降低了乳液凝胶中油滴粒径。而且,果胶与酪蛋白胶束间产生静电斥力作用,提高了乳液凝胶的稳定性。果胶-酪蛋白胶束体积比为8∶2和7∶3时,凝胶在贮藏240 d时依旧稳定,其油滴粒径未发生明显改变。热重分析发现,乳液凝胶具有较高的热稳定性。经负载后,大黄素在模拟肠液环境中释放速率发生改变,适量Ca2+交联有利于延缓大黄素的释放。细胞毒性实验表明,负载于酪蛋白胶束-果胶复合乳液凝胶中的大黄素细胞毒性显著低于游离大黄素。综上所述,酪蛋白-果胶复合乳液凝胶制备简单,凝胶稳定性高,可实现大黄素的有效负载,并有利于降低其细胞毒性。

