甜菊醇糖苷生物合成关键基因的导入和鉴定分析
张君 张虹 张芮 路国栋 雍婧姣 郎思睿 陈任
(1.宁夏大学西部特色生物资源保护与利用教育部重点实验室,银川 750021; 2.宁夏大学生命科学学院,银川 750021; 3.宁夏大学宁夏优势特色作物现代分子育种重点实验室,银川 750021)
甜叶菊(Stevia rebaudianaBertoni)是菊科甜叶菊属或斯台比亚属多年生草本植物,其叶片富含多种甜菊醇糖苷(steviol glycosides,SGs)[1-2],具有甜度高(甜度是蔗糖的200-300 倍)、热量低(热量约为蔗糖的1/300)、安全无毒等特点[3-4]。随着各国对甜菊醇糖苷作为食品甜味剂安全性的肯定,以及食品安全国家标准的公布,甜叶菊逐渐成为食品和医药领域研究开发的热点[5-6]
甜菊醇糖苷是一系列甜菊糖苷类的混合物,由甜菊醇单糖苷(steviolmonoside,SMono)、甜菊醇双糖苷(steviolbioside,SBio)、甜菊苷(stevioside,ST)、莱包迪苷A-F(rebaudioside A-F,RA-RF)杜尔可苷A、B(dulcoside A,B,DA,DB)等20 多种不同的甜菊醇糖苷组成[7-10]。其中ST 约占60%-70%、RA约占15%-20%。ST 的甜度为蔗糖的250-300 倍,但具有一定的苦味,在一定程度上影响了甜菊醇糖苷的口味,进而也影响了甜菊醇糖苷的商业利用价值。而RA 的甜度则是蔗糖的350-450 倍[11],且甜味最接近蔗糖,是理想的甜味成分。RA 含量越高,甜味就越纯正,也就会越受消费者的青睐[4,12]。因此,在一定程度上,甜菊醇糖苷的口感和甜度取决于RA的含量,要想改善现有甜菊苷产品风味,就必须想办法提高甜菊苷产品中RA 的含量。
自从甜叶菊叶片中分离出甜菊醇糖苷[13]以来,人们一直关注甜菊醇糖苷的生物合成途径。经过多年的研究发现甜菊醇糖苷的生物合成途径的上游(前期)与赤霉素生物合成途径一致[14]。在类异戊二烯及其衍生物的生物合成途径中(图1),以双牻牛儿基二磷酸(geranylgeranyl diphosphate)为原料,在柯巴基二磷酸合酶(copalylpyrophosphate synthase,CPS)的催化作用下生成内根柯巴基二磷酸(ent-copalyl diphosphate),然后在贝壳杉烯合酶(kaurene synthase,KS)的作用下生成内根贝壳杉烯(ent-kaurene),而贝壳杉烯氧化酶(kaurene oxidase,KO)又将其转化成内根-贝壳杉烯酸(ent-kaurenoic acid),这是甜菊醇糖苷生物合成途径与赤霉素生物合成途径的分界点,随后,内根-贝壳杉烯酸在内根-贝壳杉烯酸羟化酶(kaurenoicacid hydroxylase,KAH)的作用下,发生C-13 位脱氢氧化形成甜菊醇(stevoil),它是甜菊醇糖苷合成的前体。甜菊醇在不同的UDP(uridine diphosphate)-葡萄糖基转移酶(UDP-glucosyltransferases,UGTs)的作用下,最终形成一系列不同甜度的甜菊醇糖苷[14-16]。其中,在甜菊醇苷元的C-19 位上连接一个葡萄糖基和C-13 位上连接数个葡萄糖基,最终生成RA 的途径被称之为RA 生物合成途径[14-15]。而在甜菊醇苷元的C-13位上连接的葡萄糖基上再连接鼠李糖基,生成DA、DB/RC 的RC 生物合成途径,以及在葡萄糖基上再连接木质糖基,生成RF 的生物合成途径,有很多步骤仍然不甚明了[17]。

图1 甜菊醇糖苷的生物合成途径Fig.1 Biosynthetic pathways of steviol glycosides
在RA 生物合成的十几步酶促反应中,最后5步酶促反应,即KAH 和4 种不同的UGTs,包括UGT85C2、UGT91D2m、UGT74G1、UGT76G1 的催化是关键步骤[18-24]。编码这些酶的基因被认为是甜菊醇糖苷生物合成途径的关键基因。
本研究通过克隆甜菊醇糖苷生物合成途径中的关键基因UGT85C2、UGT91D2m和UGT76G1,构建植物基因过量表达载体,以单独或组合的形式将这些基因导入到甜叶菊中,对转基因植株进行各种甜菊醇糖苷成分的变化分析,以期明确这些基因在甜菊醇糖苷生物合成中的单独作用和相互影响,为培育RA 含量高的高品质甜叶菊新品系提供了理论依据和技术方法。
1 材料与方法
1.1 材料
供试材料甜叶菊品系‘中山2 号’、大肠杆菌(Escherichia coli)DH5α 菌株、农杆菌(Agrobacterium tumefaciens)EHA105、质粒载体pKAFCR80、pKAFCR100 均由宁夏大学生命科学学院重点实验室提供。
1.2 方法
1.2.1 甜菊醇糖苷生物合成关键基因的克隆 以甜叶菊叶片为材料,利用天根RNAprep Pure 多糖多酚植物总RNA 提取试剂盒提取总RNA,并使用天根TIANScript cDNA 第一链合成试剂盒进行反转录,获得cDNA。
参照NCBI 等数据库公开的甜叶菊SrUGT76G1(AY345974)、SrUGT85C2(AY345978)、SrUGT91-D2m(EU751291)基因的序列,利用引物设计软件Primer Premier 5.0 设计PCR 扩增引物,同时加入相应的限制性酶切位点(Sr76G1-S,A; Sr85C2-S,A;Sr91D2m-S,A; 表1)。以上述合成的cDNA 为模板,使用美国NEB Phusion High-Fidelity DNA Polymerase PCR 试剂盒对上述基因的全长进行扩增,采用1%琼脂糖凝胶电泳检测后用德国Qiagen QIAquick PCR Purification Kit 试剂盒提纯。
1.2.2 过渡载体的构建 利用Qiagen Qiaprep Spin Miniprep Kit 试剂盒,从大肠杆菌DH5α 提取pKAFCR80 和pKAFCR100 的载体DNA,采用本实验室确定的方法构建过渡载体、植物单个或多个基因过量表达载体[25]。
使用相应的限制性内切酶将经PCR 扩增、提纯得到的SrUGT76G1、SrUGT85C2和SrUGT91D2m基因全长和pKAFCR80 过渡用载体进行双酶切处理并分别进行连接反应,使目的基因的前后连接CAMV 35S 启动子(cauliflower mosaic virus 35S promoter)和NOS 终止子(nopaline synthase terminator)(称为基因组合),然后转化大肠杆菌DH5α 感受态细胞,进行PCR 鉴定并测序验证(引物CR80 MCS insert 35SS,A; 表1),构建出3 种过渡载体。
1.2.3 单基因过量表达载体的构建 3 种过渡载体从大肠杆菌DH5α 中提取后,使用相应的限制性内切酶,将这3 个目的基因连同前后的35S 启动子和NOS 终止子基因组合分别连接到 pKAFCR100 相应的酶切位点上,转化大肠杆菌以及菌落PCR 鉴定后测序验证(引物CR100 Cla-S,CR80 MCS insert NOS-A;表1),构建出3 种单基因过量表达载体(图2)。
1.2.4 三基因过量表达载体的构建 同样通过双酶切将上述SrUGT91D2m基因组合、SrUGT85C2基因组合依次连接到SrUGT76G1单基因过量表达载体上,经大肠杆菌转化以及菌落PCR 鉴定后测序验证(引物Sr76G1-S,A; Sr85C2-S,A; Sr91D2m-S,A; 表1),最终形成1 种三基因过量表达载体(图2)。

表1 PCR 扩增引物Table 1 Primers for PCR amplification
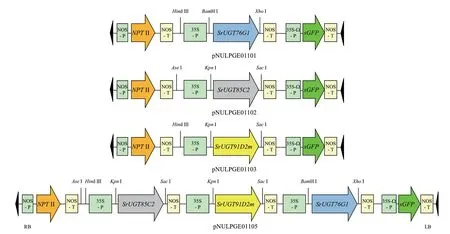
图2 单基因或三基因共表达载体构建示意图Fig.2 Schematic structure of co-expression vectors of single genes or three genes
1.2.5 农杆菌转化及转基因植株的鉴定 将构建好的3 种单基因过量表达载体以及1 种三基因过量表达载体,按照说明书步骤转化农杆菌EHA105 感受态细胞。
选取长势良好的甜叶菊无菌苗的叶片作为实验材料,利用农杆菌介导法分别转化上述4 种基因过量表达载体,转化和培育过程按照实验室确定的方法进行[26]。长出愈伤组织后观察sGFP 荧光的表达情况。
利用植物基因组DNA 提取试剂盒提取4 种转基因植株的基因组DNA,以野生型植株为阴性对照,PCR 鉴定导入的目的基因片段(引物Sr76G1-S,CR100 omega-A; CR100 Cla-S,Sr85C2-A; CR80 MCS insert NOS-S,Sr91D2m-A; 表1)。
1.2.6 转基因植株基因表达量的分析 PCR 鉴定的各种转基因阳性植株和野生型对照植株在温室培养3 个月(未开花)后,各选取10 株系,每株系顶部的3 对叶混合成1 个样本。采用本实验室确定的实时荧光定量PCR 方法检测并计算SrUGT85C2、SrUGT91D2m和SrUGT76G1基因的相对表达量[27]。
1.2.7 转基因植株甜菊醇糖苷含量的分析 采用实时荧光定量PCR 同样的样本提取植株中各种甜菊醇糖苷。甜菊醇糖苷的提取和测定采用本实验室确定的方法[27-31]。
将甜菊醇糖苷标准品(日本Wako)用乙腈-水(80∶20,V/V)溶液配制成浓度为0.02、0.04、0.06、0.08、0.10、0.15、0.20 mg/mL 的标准品溶液系列。分别吸取15 μL 进样,记录色谱图。以峰面积为纵坐标Y,以标准品进样量(μg)为横坐标X 进行线性回归,计算回归方程。
2 结果
2.1 甜菊醇糖苷生物合成关键基因的克隆
从甜叶菊叶片提取的总RNA,经cDNA 合成,进行PCR 扩增,得到的SrUGT76G1、SrUGT85C2、SrUGT91D2m基因的长度分别为1 425 bp、1 511 bp、1 441 bp,均横跨各基因的编码区序列(coding sequence,CDS)区域,同时PCR 产物两端分别引入相应的酶切位点(表1)。琼脂糖凝胶电泳检测PCR扩增条带大小正确(图3)。
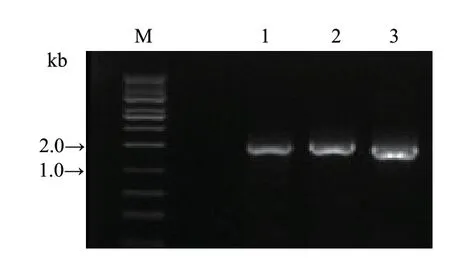
图3 3 个基因PCR 扩增Fig.3 PCR amplification of 3 target genes
2.2 过渡载体的构建
3 个基因的PCR 扩增产物提纯后,利用双酶切方法,将之分别构建至pKAFCR80 过渡用载体上使目的基因的前后连接上35S 启动子和NOS 终止子。获得3 种过渡载体,分别命名为pNULPGE01001(pKAFCR80+SrUGT76G1)、pNULPGE01002(pKAFCR80+SrUGT85C2)、pNULPGE01003(pKAFCR80+SrUGT91D2m)。经大肠杆菌转化后菌落PCR 鉴定,确认阳性菌落里插入到pKAFCR80 过渡载体的目的基因片段条带大小正确,分别为1 675 bp、1 764 bp、1 693 bp(图4)。经测序,与NCBI 公布的序列一致。
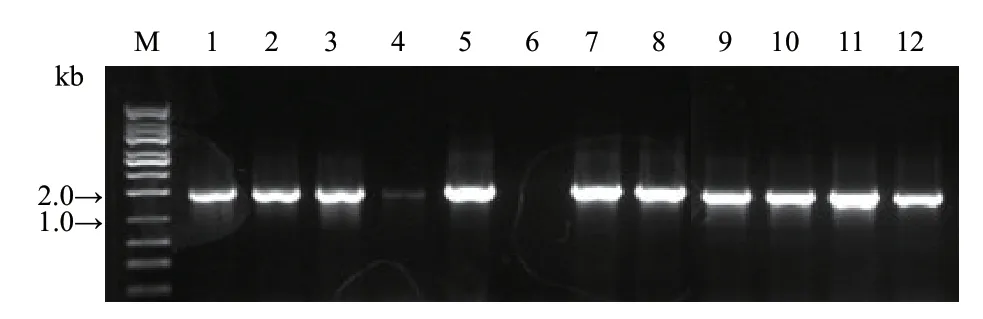
图4 3 个基因以单独形式连接至pKAFCR80 过渡载体后菌落PCR 鉴定Fig.4 Colony PCR identification of the 3 genes individually constructed into pKAFCR80 intermediate vector
2.3 单基因过量表达载体的构建
3 种过渡载体,双酶切处理后将目的基因连同前后的35S 启动子和NOS 终止子的SrUGT76G1、SrUGT85C2和SrUGT91D2m基因组合片段,分别单独连接到pKAFCR100 上,构建出3 种单基因过量表达载体(图2),分别命名为:pNULPGE01101:pKAFCR100+SrUGT76G1基因组合(35S 启动子+SrUGT76G1+NOS 终止子);pNULPGE01102:pKAFCR100+SrUGT85C2基因组合(35S 启动子+SrUGT85C2+NOS 终止子);pNULPGE01103:pKAFCR100+SrUGT91D2m基因组合(35S 启动子+SrUGT91D2m+NOS 终止子)。
根据大肠杆菌转化后菌落PCR 电泳和测序可以确认阳性菌落里插入到pKAFCR100 的目的基因组合存在,且大小和序列正确,分别为2 901 bp、2 808 bp、2 919 bp(图5)。

图5 3 个基因以单独形式连接至pKAFCR100 二元表达载体后菌落PCR 鉴定Fig.5 Colony PCR identification of the 3 genes individually constructed into pKAFCR100 binary vector
2.4 三基因过量表达载体的构建
过渡载体双酶切后的SrUGT91D2m基因组合、SrUGT85C2基因组合,依次连接到pNULPGE01101(pKAFCR100+SrUGT76G1基因组合)相应的酶切位点上。经菌落PCR 和测序验证无误(图6),最终构建出含有3 个基因组合的过量表达载体(图2),pNULPGE01105:pKAFCR100+SrUGT76G1基因组合+SrUGT91D2m基因组合+SrUGT85C2基因组合。

图6 3 个基因以组合形式连接至pKAFCR100 二元表达载体菌落PCR 鉴定Fig.6 Colony PCR identification of 3 genes in combination constructed into pKAFCR100 binary vector
2.5 农杆菌转化及转基因植株的鉴定
4 种基因过量表达载体利用农杆菌介导转化甜叶菊无菌苗叶片后,在含有抗生素的培养基上诱导形成了愈伤组织,进一步培育成完整植株。分别以目的基因和表达载体特有序列设计嵌合引物,经基因组PCR 鉴定,获得阳性再生植株(图7-图8),说明了构建到基因过量表达载体的SrUGT76G1、SrUGT85C2和SrUGT91D2m三个基因已经按单独或组合的形式导入到这些PCR 阳性的甜叶菊植株。而野生型对照甜叶菊植株,PCR 鉴定为阴性,说明了PCR 引物设计是正确的。4 种基因过量表达载体的转基因植株分别命名为Sr01101、Sr01102、Sr01103和Sr01105。

图7 3 个基因以单独形式转化植株的PCR 鉴定Fig.7 PCR identification of the transgenic plant transferred 3 genes individually
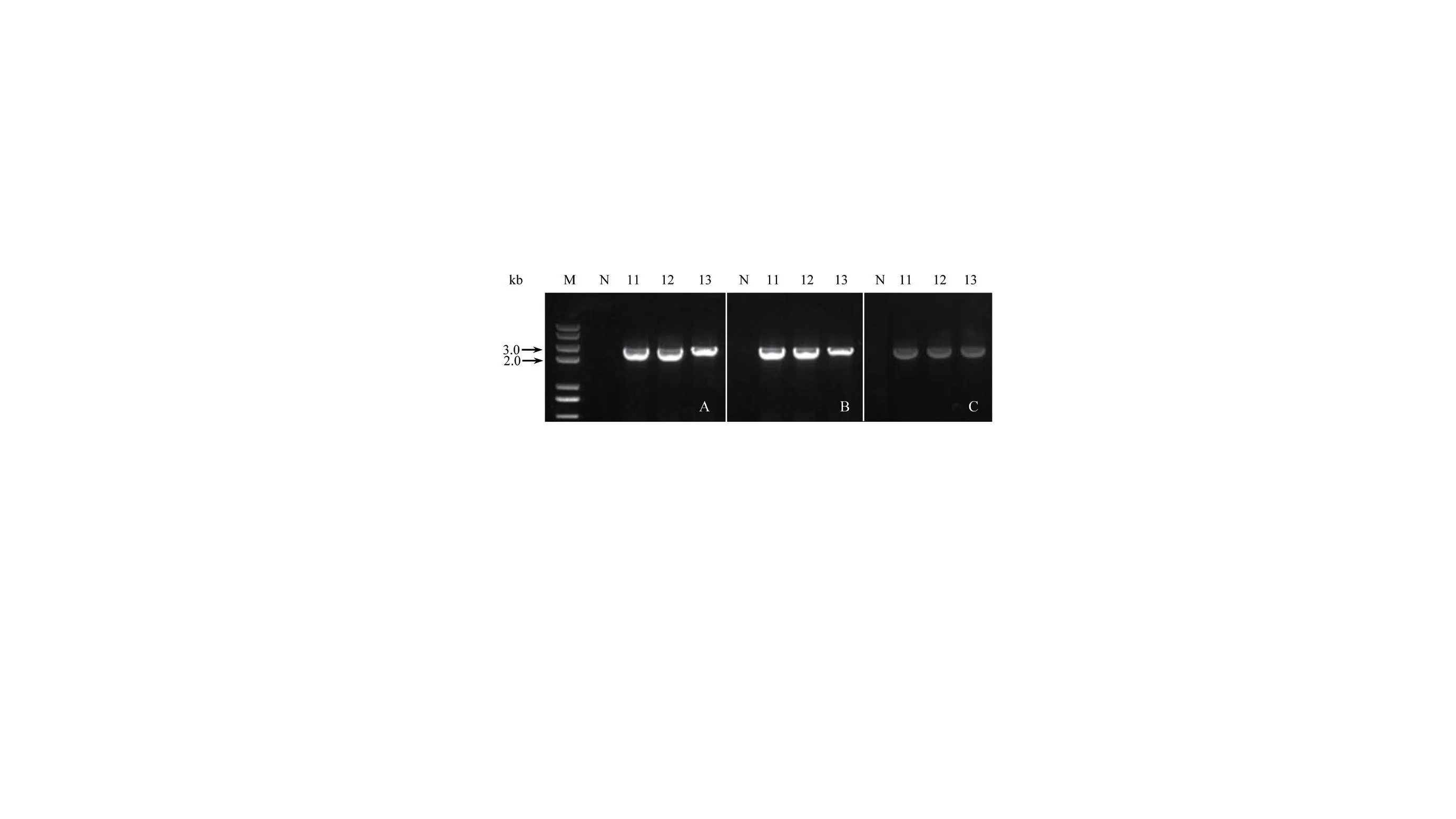
图8 3 个基因以组合形式转化植株的PCR 鉴定Fig.8 PCR identification of the transgenic plant transferred 3 genes in combination
2.6 转基因植株基因表达量分析
根据实时荧光定量PCR 的结果,以野生型甜叶菊植株为对照,相对定量计算出导入基因在转基因阳性植株中的相对表达量和标准误。单独导入SrUGT85C2的转基因植株(Sr01102)中,其相对表达量增加了8.3 倍;单独导入SrUGT91D2m的转基因植株(Sr01103)中其相对表达量增加了10.26倍;单独导入SrUGT76G1的转基因植株(Sr01101)中其相对表达量增加了15.22 倍;3 个基因组合同时导入的转基因植株(Sr01105)中,三基因的相对表达量分别增加了9.76、8.88、11.69 倍(图9)。说明这些导入基因甜叶菊转基因阳性植株中达到了过量表达的效果,且各转基因植株生长情况良好(图10)。

图9 各种转基因植株的基因相对表达量Fig.9 Gene relative expressions in transgenic plantlets

图10 各种转基因植株与野生型对照植株Fig.10 Transgenic plantlets and wild-type plantlets
2.7 转基因植株甜菊醇糖苷含量的分析
以野生型甜叶菊植株为对照,利用HPLC 方法分别对4 种不同基因过量表达载体诱导形成的甜叶菊转基因植株进行甜菊醇糖苷含量的分析。
根据不同浓度的甜菊醇糖苷的标准品溶液的色谱图,得到各种甜菊醇糖苷的回归方程。其中ST 的回归方程为Y= 3 251 326.26X+ 4 582.59,R2= 0.997 5;RA 的回归方程为Y= 2 394 407.22X+2 280.21,R2= 0.999 1,从而计算得出不同转基因植株中各种甜菊醇糖苷的含量。
结果表明,在所有的甜叶菊植株中,总甜菊醇糖苷(SGs)含量在12.74%-16.12%。单独导入SrUGT85C的转基因植株(Sr01102)中,总SGs、ST、RA 含量以及RA/SGs 与对照没有明显变化,而SMono 含量最高,达到1.57%,是对照的1.3 倍。单独导入SrUGT91D2m的转基因植株(Sr01103)的SBio 含量最高,达到1.1%,是对照的1.7 倍;而SMono 含量最低,仅为0.68%,减少1.9 倍;SGs、ST 含量提高,RA 含量没有明显变化。单独导入SrUGT76G1的转基因植株(Sr01101)中,总SGs 含量显著提高;RA 含量最高,达到10.77%,比对照提高2.0 倍;RA/SGs 也最高,达到71.7%,提高了1.8倍;而ST 的含量最低,仅为2.49%,减少2.2 倍。3个基因共表达的转基因植株(Sr01105)中,总SGs含量显著提高;RA 含量、RA/SGs 比例比对照分别提高1.8 倍和1.3 倍;Sbio 含量提高而ST 含量降低(表2)。
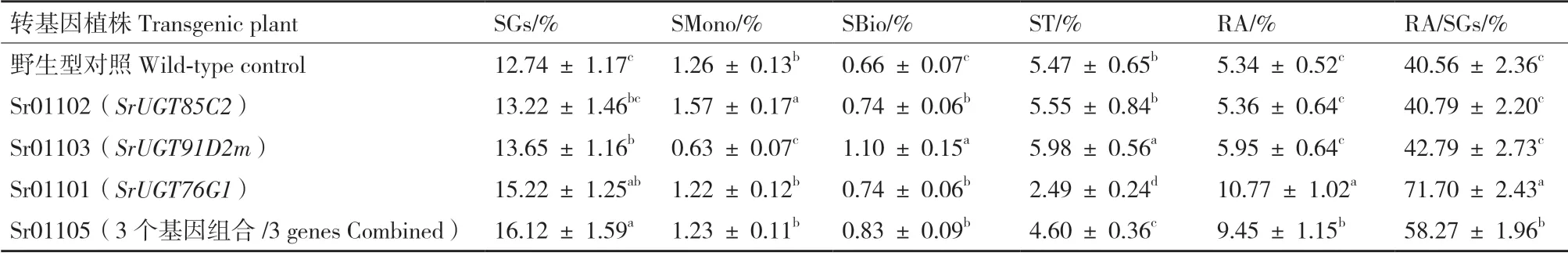
表2 不同转基因植株中各种甜菊醇糖苷的含量Table 2 Variety of steviol glycosides contents in different transgenic plant
3 讨论
本研究从甜叶菊叶片克隆了SrUGT85C2、SrUGT91D2m和SrUGT76G13 个关键基因,构建植物基因过量表达载体,以单独或组合的形式将这些基因导入到甜叶菊中进行过量表达,对转基因植株进行了导入基因相对表达量以及各种甜菊醇糖苷成分的变化分析。从基因单独过量表达的结果看,单独导入SrUGT85C2的转基因植株中,总甜菊醇糖苷、ST、RA 含量以及RA 占总甜菊醇糖苷含量比例与野生型甜叶菊对照植株相比没有明显变化,而SMono 含量提高了1.3 倍。因为SrUGT85C2 能够催化甜菊醇甜菊醇C-13 位上发生糖基化连接第一个葡萄糖基,生成第一个甜菊醇糖苷—SMono,从而开启了各种甜菊醇糖苷的生物合成。但是单独导入SrUGT85C2的转基因植株的其他甜菊醇糖苷含量与对照相差不大,这可能是由于SrUGT85C2属于比较上游的基因,合成SMono 后,由于合成途径分支多,产物分散,效果不容易显现。RA 合成途径中从SMono 转化成SBio 也是重要的一步酶促反应,这一过程以前一直未得到确认。从专利和一些基因库的资料推测该UGT 的序列,克隆了SrUGT91D2m基因。单独导入SrUGT91D2m的转基因植株的SMono 含量显著降低1.9 倍,而SBio 含量显著增加1.7 倍,证明了SrUGT91D2m能够催化甜菊醇C-13 位上再次连接第2 个葡萄糖基,转化SMono 生成SBio。但SrUGT91D2m仍属于上游基因,对其他甜菊醇糖苷生物合成的影响作用比较分散;有报道SrUGT91D2m有多种同源基因,甚至能够催化甜菊醇C-19 位上连接第2 个葡萄糖基,生成RE 或RD[21,32]。
单独导入SrUGT76G1的转基因甜叶菊植株中,总甜菊醇糖苷含量明显提高,特别是RA 含量比对照提高了2 倍,达到10%以上;RA 占总甜菊醇糖苷总量比例提高1.8 倍,而ST 含量减少了一半以上。该效果优于以前报道的在甜叶菊植株中过量表达该基因(RA 含量从0.79%提高到1.87%)[24]。SrUGT76G1能够催化甜菊醇苷元C-13 位上连接第3个葡萄糖基(在第一个葡萄糖基上再连接一个葡萄糖基),将ST 生成转化为RA,它是甜菊醇糖苷生物合成途径中合成RA 的最后一个关键酶[23-24,33]。SrUGT76G1与底物具有很高的亲和力,这种高亲和力可以提高RA 合成前体物的合成量,从而使RA的合成量也提高[19]。SrUGT76G1基因的表达量与RA 的积累存在极显著的相关性,直接影响着RA 的积累[27]。前人利用RNAi 技术有针对性地研究了SrKAH、SrUGT85C2、SrUGT74G1和SrUGT76G1四个基因的功能,其中,SrUGT76G1的沉默使得甜菊醇糖苷的减少量最多。本研究也证明了单独导入过量表达SrUGT76G1基因,能显著提高甜叶菊细胞内RA 的合成,该提高是由于SrUGT76G1催化ST 生成转化为RA 的结果。ST 具有一定的苦味,RA 的甜味最接近蔗糖,是最理想的甜味成分,通过过量表达SrUGT76G1基因能够提高RA 含量,而且甜味更纯正,达到了我们转基因培育甜叶菊优良品系的目的。
3 个基因同时导入SrUGT85C2、SrUGT91D2m和SrUGT76G1的转基因植株与单独导入SrUGT76G1的转基因植株没有太大的差别,总甜菊醇糖苷总量明显提高;RA 含量、RA 占总甜菊醇糖苷总量比例比对照分别提高1.8 倍和1.3 倍,但ST 含量降低没有那么明显。说明了多个基因的共同作用和影响是相当复杂的,甜叶菊体内各种甜菊醇糖苷的生物合成可能存在一定的平衡,上游基因SrUGT85C2、SrUGT91D2m的过量表达牵涉到其他甜菊醇糖苷以及其他代谢物的合成。有报道各种甜菊醇糖苷的生物合成不单单受功能基因即各种UGTs 的影响,还受到转录因子如SrWRKY71 和miRNA 如miRStv_11、miR319g 的调控[34-35],其规律还有待以后进一步研究。
甜菊醇糖苷生物合成途径中还有一个关键基因SrUGT74G1。与SrUGT76G1 不同,SrUGT74G1主要催化甜菊醇苷元在C-19 位上发生糖基化连接第一个葡萄糖基,在RA 生物合成途径中催化Sbio 生成ST。因为ST 带有一定的苦味,影响了甜菊醇糖苷的口味和商业利用价值,所以本研究没有对该基因进行过量表达实验。以上这些结果为以后通过分子生物学技术来调控甜菊醇糖苷生物合成关键基因的表达,培育RA 含量高的高品质甜叶菊新品系提供了理论依据和技术方法。
4 结论
从甜叶菊叶片克隆到SrUGT85C2、SrUGT91D2m和SrUGT76G1基因,将这些基因以单独或组合形式在甜叶菊中过量表达,单独导入SrUGT76G1能够显著提高总糖苷,特别是RA 的含量。

