瓜类细菌性果斑病菌拮抗细菌的筛选及其抑菌作用
张玲 张荣意 刘盛科 谭志琼
(海南大学生命科学学院,海口 570228)
哈密瓜为葫芦科植物,口味清爽、甘甜多汁,有“瓜中之王”的美称。随着19世纪20年代哈密瓜无土栽培技术的推广,哈密瓜逐渐成为了海南省的重要经济作物。在哈密瓜的生长过程中会伴随着多种病害的发生,其中细菌性果斑病(bacterial fruit blotch,BFB)又称细菌性果腐病,是一种由西瓜噬酸菌(Acidovorax citrulli)引起的毁灭性病害。我国新疆、内蒙古、海南、云南、福建等地均有该病害发生的报道,其主要危害哈密瓜的叶片(子叶及真叶)和果实(幼果和成熟果),对哈密瓜种植业造成了极其严重的影响[1]。
目前,瓜类细菌性果斑病的防治主要以化学防治为主,如利用1%的盐酸、200 倍的15%过氧乙酸[2]或300 mg/L 的3%噻霉酮WP[3]处理种子后,可有效除去种子表面的病原菌。在出苗后可采用90%新植霉素可溶性粉剂和3%噻霉酮、47%春雷·王铜对哈密瓜苗期进行喷雾[4],可有效地防治细菌性果斑病的发生。在日常生产中,使用化学农药防治病害十分普遍,但却很难做到科学合理地施用化学农药,且长期施用化学农药会带来环境污染、农药残留以及病原菌产生抗药性等一系列问题,威胁人畜健康,亟需探索生物防治措施[5]。
生物防治因具有环境友好、无毒无残留、不伤害非靶标微生物、防病持效期长等优点,备受学者关注,是植物病害防治新的研究热点。BFB 生物防治常用菌株为酵母菌(Pichia anomala Kurtzman)、荧光假单胞菌工程菌株(Pseudomonas fluorescence)和芽孢杆菌(Bacillus)等,国内研究防治BFB 的生防菌以芽孢杆菌居多。武芳等[6]使用筛选出的芽孢杆菌在哈密瓜种植区域进行拮抗菌株对哈密瓜植株促生、防效等研究,结果显示,每株拮抗菌对哈密瓜植株不仅有促生作用,而且均能不同程度地预防细菌性果斑病的发生,防治效果可达到 19.98%-50.42%。谢心悦等[7]筛选出解淀粉芽孢杆菌BJ-10,其对甜瓜白粉病和甜瓜细菌性果斑病均具有较高的防效。芽孢杆菌以其优秀的定殖[8]、抗逆以及能抑制多种植物病害的能力成为生物防治的重要材料[9]。目前对于真菌性病害的研究较多,而细菌性病害研究较少。已有研究表明,不同的菌株其生长特性不同,如温度、pH 以及营养条件等因素均会显著影响芽孢杆菌的生长情况[10-11],从而影响其对病原菌的拮抗效果。因此,明确菌株的生长条件以及广谱性,更有利于菌株的田间应用以及开发出适用于海南热带地区的生物菌制剂。
近年来,随着海南哈蜜瓜种植面积扩大,哈密瓜细菌性果斑病发生愈发严重,化学农药用量的增加,导致哈密瓜生产食品安全隐患愈发突出,生物防治措施亟待完善。本研究通过试验筛选出对细菌性果斑病效果较好的生防菌,并确定菌株的最佳培养条件、抑菌活性以及防治效果,为菌株后续的开发利用提供理论参考。
1 材料与方法
1.1 材料
1.1.1 供试样品 实验样品采集自海南省昌江、东方、三亚和陵水等哈密瓜大棚的根际土壤,用密封袋密封后于4℃保存,48 h 内对土壤细菌进行分离。
1.1.2 供试菌株 西瓜噬酸菌A.citrulli、荔枝霜疫霉Peronophythoralitchii、火龙果炭疽病病菌Colletotrichum gloeosporioides、黄瓜叶斑病病菌Pseudonwnas cichorii、小麦赤霉病病菌Fusarium graminearum、甜瓜蔓枯病病菌Didymella bryoniae,由海南大学微生物资源开发与利用实验室提供。
1.1.3 培养基 牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,水1 000 mL,pH 7.2。LB 培养基:酵母提取物5 g,胰蛋白胨10 g,NaCl 10 g,水1 000 mL,pH 7。NB 培养基:聚蛋白胨5 g,酵母提取物1 g,牛肉浸膏3 g,蔗糖15 g,水1 000 mL,pH 7.0。KB 培养基:蛋白胨20 g,甘油10 mL,K2HPO41.5 g,MgSO4·7H2O 1.5 g,水1 000 mL,pH 7.2。PDB 培养基:土豆200 g,葡萄糖20 g,水1 000 mL。固体培养基:上述液体培养基+18 g 琼脂。
1.2 方法
1.2.1 土壤细菌的分离 采用平板稀释法[12]进行分离,称取5 g 土样,加入45 mL 无菌水中,振荡培养30 min,静置5 min 后,吸取100 μL 的土壤悬浮液于900 μL 的无菌水中,依次进行梯度稀释(102、103、104),分别吸取稀释倍数为102、103和104的土样悬浮液100 μL 到牛肉膏平板中,用无菌涂布棒涂布,28℃恒温培养2 d,挑取形态、大小、颜色不同的菌落多次纯化后保藏备用。
1.2.2 拮抗菌的筛选 以西瓜噬酸菌为指示菌,筛选有拮抗作用的生防菌[13]。在融化并冷却至50℃的LB 培养基中加入3 mL 浓度为1×108CFU/mL 病菌菌液,混匀后倒平板,将分离出的细菌等距离接种于平板上,28℃恒温培养,2 d 后观察有无抑菌圈生成,采用十字交叉法测量抑菌圈直径。筛选出抑菌作用强的菌株接种至斜面试管培养基中,4℃下保藏菌种。
1.2.3 拮抗菌的鉴定
1.2.3.1 形态特征和革兰氏染色反应 采用平板划线法将获得的具有抗细菌性果斑病菌的菌株131、791 接种于牛肉膏培养基上,28℃恒温培养24 h 至长出单菌落,观察菌落形状,颜色和大小等。挑取培养至14 h 的两株菌株,进行革兰氏染色,并在光学显微镜下观察其形态和染色反应。
1.2.3.2 生理生化特征测定 参考《常见细菌系统鉴定手册》[14]的方法进行接触酶、氧化酶、明胶液化、V-P 试验、碳氮源利用等生理生化实验测定。
1.2.3.3 16S rRNA 和gyrB 基因特征 使用EZNA®Bacteria DNA Kit(Omega)提取两株细菌的基因组DNA,提取的基因组DNA 经1%琼脂糖凝胶电泳检测后用于PCR 扩增。PCR 的引物及反应条件见表1[15-16]。PCR 产物经1%琼脂糖凝胶电泳检测符合要求,送往生工生物工程(上海)股份有限公司进行测序。测序结果在NCBI 数据库中进行Blast 比对,下载相似性高的序列,使用MEGA 7.0 软件利用邻接法(neighbor-joining method)构建系统发育树,Bootstrap 为1 000[17]。
1.2.4 生长曲线测定 将菌株131、791 分别刮取单个菌落,接种至牛肉膏液体培养基,恒温培养12 h,作种子液备用。将种子液分别接种至牛肉膏液体培养基,在28℃、180 r/min 的条件下振荡培养24 h。每隔2 h 取样,用分光光度计测量其OD600的值,重复3 次,并绘制生长曲线。
1.2.5 生长条件的测定
1.2.5.1 最佳培养基的筛选 按2%的接种量将种子液分别加入100 mL 的牛肉膏、LB、NB、KB、PDB培养基中,在28℃、180 r/min 的条件下摇培至对数生长期,分别测量其OD600值。
1.2.5.2 最佳pH 的筛选 按2%的接种量将种子液分别加入100 mL pH 梯度为3、4、5、6、7、8、9、10 的牛肉膏培养基中,28℃、180 r/min 摇培至对数生长期,分别测量其OD600值。
1.2.5.3 最佳培养温度的筛选 按2%的接种量将种子液分别加入100 mL 温度梯度为25、28、31、34、37 和40℃牛肉膏培养基中,180 r/min 摇培至对数生长期,分别测量其OD600值。
1.2.5.4 最佳接种量的筛选 将0.2%、0.5%、1%、2%、10%的种子液分别接种至100 mL 牛肉膏培养基中,在28℃、180 r/min的条件下摇培至对数生长期,分别测量其OD600值。
1.2.6 防病试验
1.2.6.1 离体叶片防病试验 采用针刺接种法[18],挑取生长状况一致的哈密瓜叶片,表面消毒后洗净晾干,用无菌针头在叶片背后叶脉两边各刺3 处接种点,用注射器从叶片的针刺部位缓慢注射接种菌液,实验分为两组处理:(1)先接种131 菌液,后接种BFB 菌液;(2)先接种791 菌液,后接种BFB菌液。以只接种BFB 菌液和只接种水为对照组,叶片置于水琼脂平板上培养,3 d 后开始逐日观察发病情况,于处理后的第7 天统计并计算防效。

1.2.6.2 室内盆栽防病试验 选取若干长至2-3 片真叶的哈密瓜盆栽幼苗,采用叶面喷施法分别接种A.citrulli、菌株131、791,清水处理为空白对照。处理组1:先将1×108CFU/mL 生防菌株菌液喷施于真叶的正反面,1 h 后喷施同等浓度的病菌菌液。处理组2:只喷BFB 菌液,平行试验3 次,喷施后逐日观察发病情况,于处理后的第7 天统计并计算防效。病情分级标准参考李新宇等[19]方法并略作修改,分级标准如表2所示。
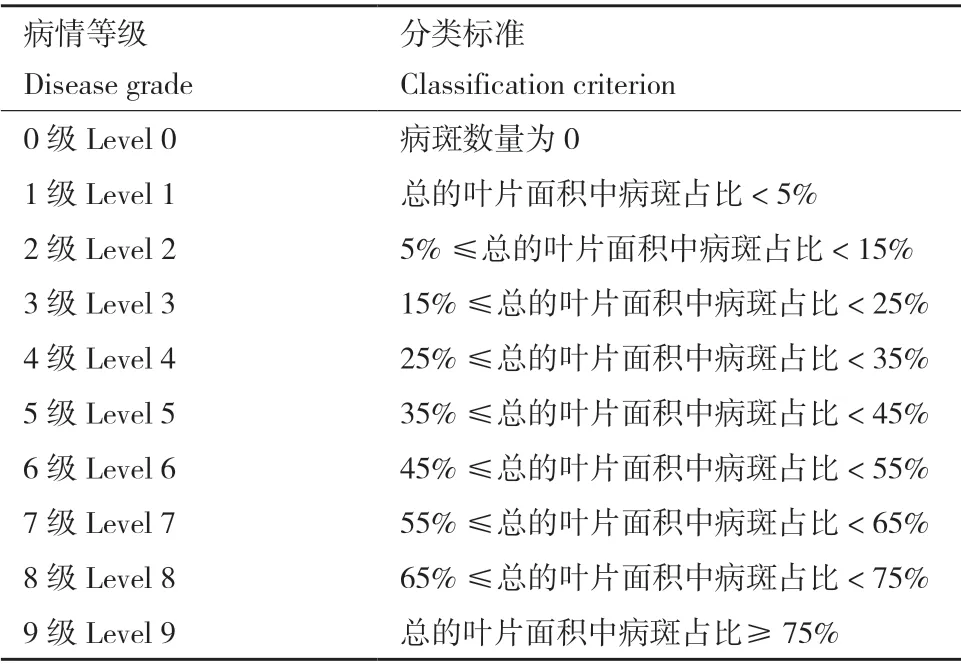
表2 病情等级分级标准Table 2 Classification criteria of disease grade

1.2.7 抑菌作用测试 采用平板对峙法[20]测定菌株131、791 对荔枝霜疫霉、火龙果炭疽病病菌、黄瓜叶斑病病菌、小麦赤霉病病菌、甜瓜蔓枯病病菌等5 种病原真菌的拮抗效果,将直径7 mm 的病原真菌菌饼倒扣至PDA 平板中央,距离菌饼2.5 cm 处接种待测细菌,每个处理重复4 次,以只接病原真菌的平板作对照,28℃恒温培养至病菌长满对照组的培养皿,十字交叉法测量病原真菌的对照组菌落直径、处理组直径,并计算抑菌率。

1.2.8 数据统计与分析 采用Excel 进行数据处理、作图,采用SPSS 软件进行差异显著性分析。
2 结果
2.1 拮抗菌的筛选
从土样中共分离出196 株细菌,通过平板对峙法筛选出具有明显抑制圈的拮抗菌株共20 株,其中编号为131、791 的两株细菌对哈密瓜果斑病菌具有较强的平板拮抗效果,平板抑菌直径分别为(19.03±0.13)mm,(17.55±0.29)mm(图1)。
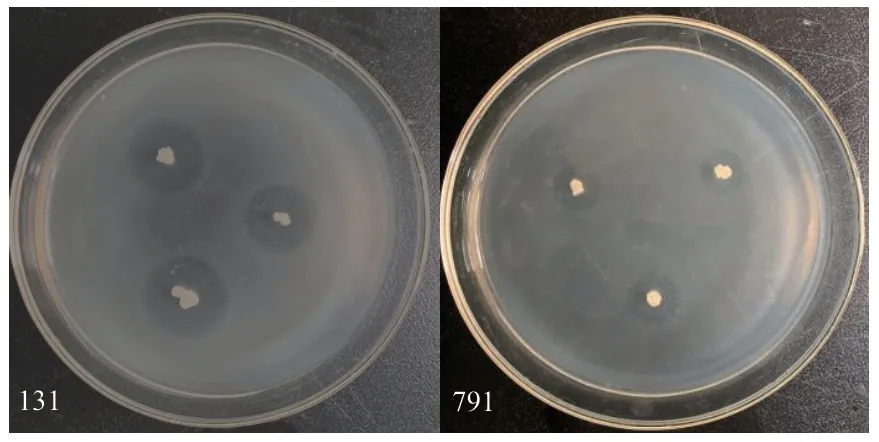
图1 两株拮抗菌对西瓜噬酸菌的抑制效果Fig.1 Inhibitory effects of two strains on A.citrulli
2.2 形态学观察和生理生化鉴定
图2为菌株131、791 的菌落形态图及革兰氏染色图。菌株131 在牛肉膏培养基上菌落为白色,不透明,菌落边缘呈波浪状,顶端光滑凸起,中心呈淡黄色。菌体呈蓝紫色、杆状,为革兰氏阳性菌株。菌株791 在牛肉膏培养基上菌落呈乳白色、有黏性、不透明、边缘不规则、表面光滑。菌体呈蓝紫色、杆状,革兰氏染色结果为阳性。
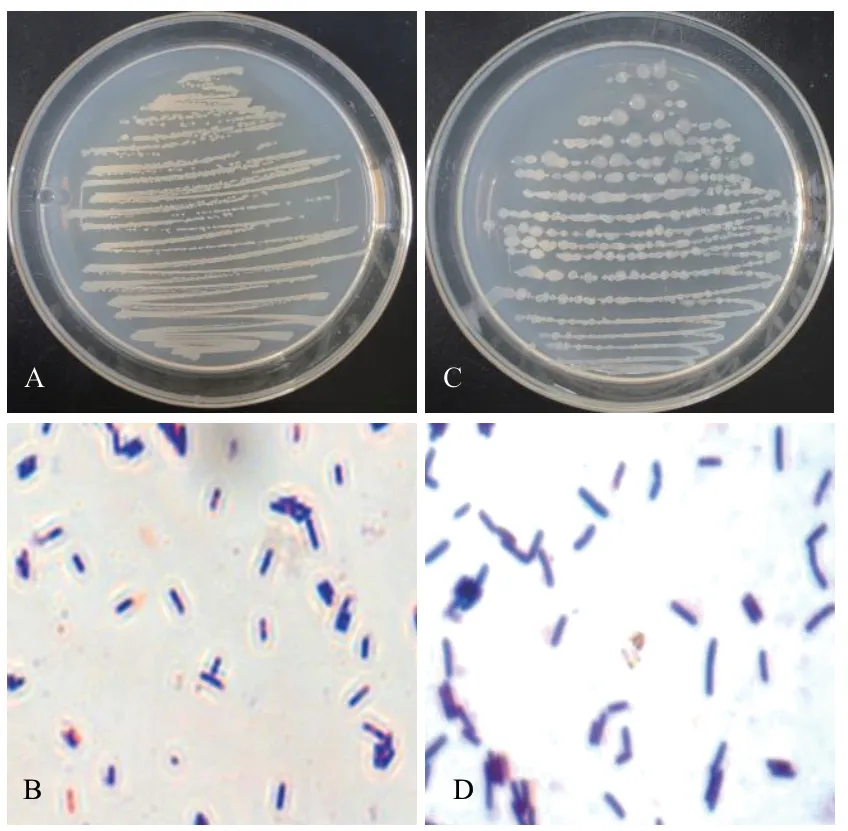
图2 菌株131、791 的菌落图及革兰氏染色图Fig.2 Colony and Gram stain of strain 131 and 791
表3结果表明,菌株131、791 均为好氧菌,接触酶、氧化酶、明胶液化、淀粉水解、MR 和V-P试验等生理生化测定结果均为阳性,两株菌株均可在2%-10%的NaCl 培养液中生长,综合形态学和生理生化结果与《常见细菌系统鉴定手册》进行对照,将菌株131、791 初步判定为芽孢杆菌属细菌。

表3 菌株131、791 的生理生化鉴定结果Table 3 Physiological and biochemical identification results of strain 131 and 791
2.3 16S rRNA基因和gyrB基因鉴定
菌株131、791 的16S rRNA 基因序列长度分别为1 453 bp、1 453 bp,gyrB 基因序列长度分别为1 187 bp、1 189 bp(图3)。图4、图5分别为菌株131、791 的16S rRNA 基因和gyrB 基因的联合系统发育树。通过blast 比对,菌株131 与沙福芽孢杆菌(Bacillus safensis)相似度为99%,在16S rRNA 基因和gyrB 基因的进化树上也都与B.safensis位于同一分支。菌株791 与贝莱斯芽孢杆菌(B.velezensis)相似度为98%,与B.velezensis在进化树中位于同一分支,且分支值高达98。综合形态学、生理生化和16S rRNA 基因、gyrB 基因等多方面特征结果,将菌株131 鉴定为沙福芽孢杆菌,菌株791 为贝莱斯芽孢杆菌。
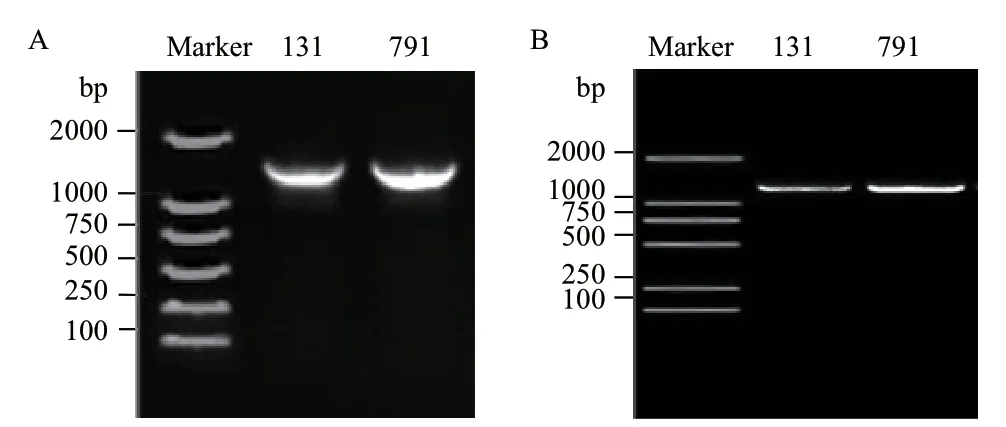
图3 菌株131、791 的16S rRNA 基因电泳图(A)和gyrB 基因电泳图(B)Fig.3 16S rRNA gene electropherogram (A) and gyrB gene electropherogram (B) of strain 131 and 791

图4 菌株131 基于16S rRNA 基因和gyrB 基因的系统发育树Fig.4 Phylogenetic tree of strain 131 based on 16S rRNA genes and gyrB genes

图5 菌株791 基于16S rRNA 基因和gyrB 基因的系统发育树Fig.5 Phylogenetic tree of strain 791 based on 16S rRNA genes and gyrB genes
2.4 生长曲线
菌株131、791 在前6 h 为延缓期,在8-12 h 生长迅速,处于对数生长期,到18 h 菌量均到达最大值并进入稳定期(图6)。
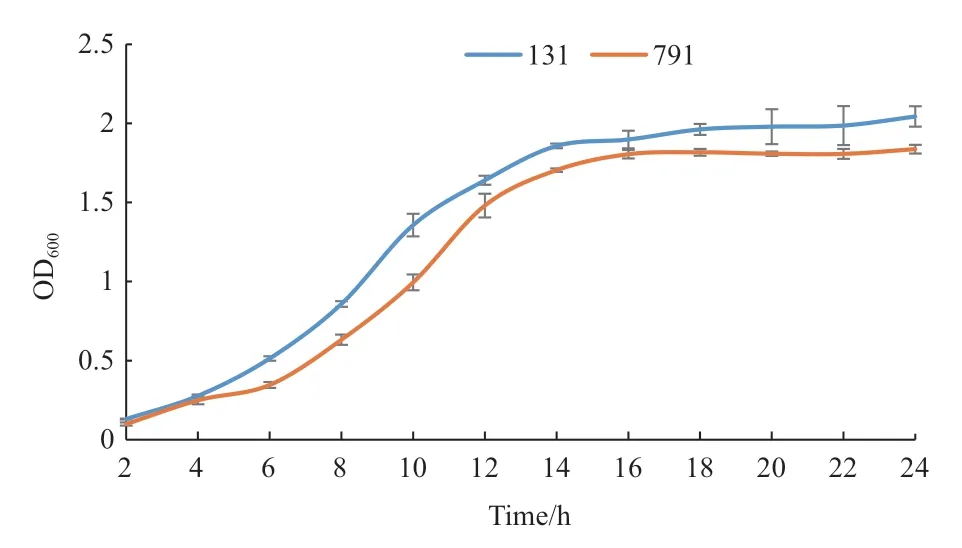
图6 菌株131、791 的生长曲线Fig.6 Growth curves of strain 131 and 791
2.5 生长条件的测定
菌株131 在NB 培养基中生长量最大,OD600值可高达1.76;菌株791 在KB 培养基中生长状况最好,OD600值为1.43(图7-A)。菌株131 在pH 3-5的时候生长量小,在pH 7 时达到最大值;菌株791的pH 生长范围为pH 5-9,且在pH 为6 时,菌量达到最大值(图7-B)。菌株131、791 在25-40℃时均可生长,且最适生长温度均为37℃(图7-C)。菌株131 在接种量为2%时生长最好,菌株791 在接种量为1%时生长量最大(图7-D)。

图7 菌株131、791 在不同条件下的生长状况Fig.7 Growth status of strain 131 and 791 under different conditions
2.6 防病试验
如图8所示,只接种BFB 菌液的叶片从第3天开始出现病斑,病斑面积约占整个叶片面积的49.26%,而接种了生防菌液的叶片,从第5 天才开始出现病斑,且病斑明显减少,其对哈密瓜细菌性果斑病的防效分别为83.33%和87.53%。

图8 两株生防菌对哈密瓜细菌性果斑病的离体叶片效果Fig.8 Effects of two biocontrol bacteria on the isolated leaves of bacterial fruit blotch of cantaloupe
2.7 室内盆栽防效
盆栽试验结果如表4和图9所示,只接种BFB菌液的处理组哈密瓜幼苗真叶及子叶出现明显的水渍状坏死斑,严重时出现叶缘干枯萎缩,植株生长明显较CK 差,经统计分析得到病情指数为77.41,发病较严重。同时接种生防菌菌液和BFB 菌菌液处理组幼苗叶片无明显的坏死斑点,少数叶片存在水渍状小斑点,叶缘无干枯坏死现象,叶片伸展正常,经统计分析,分别同时接种131、791 和BFB 病菌处理组的病情指数依次为23.33、17.04,较只接种BFB 菌菌液处理组,植株发病情况明显改善。上述结果表明,BFB 病原菌对哈密瓜幼苗的生长具有明显的危害,症状为水渍状坏死斑,严重时呈干枯状坏死,接种生防菌菌液后,植株病情指数明显降低,发病情况得到抑制,在室内盆栽中,菌株131、791具有较好的防治哈密瓜果斑病的效果,盆栽防效分别达69.86%、77.99%。

图9 两株菌株对细菌性果斑病的盆栽防治效果Fig.9 Control efficacy of two strains against BFB in potting
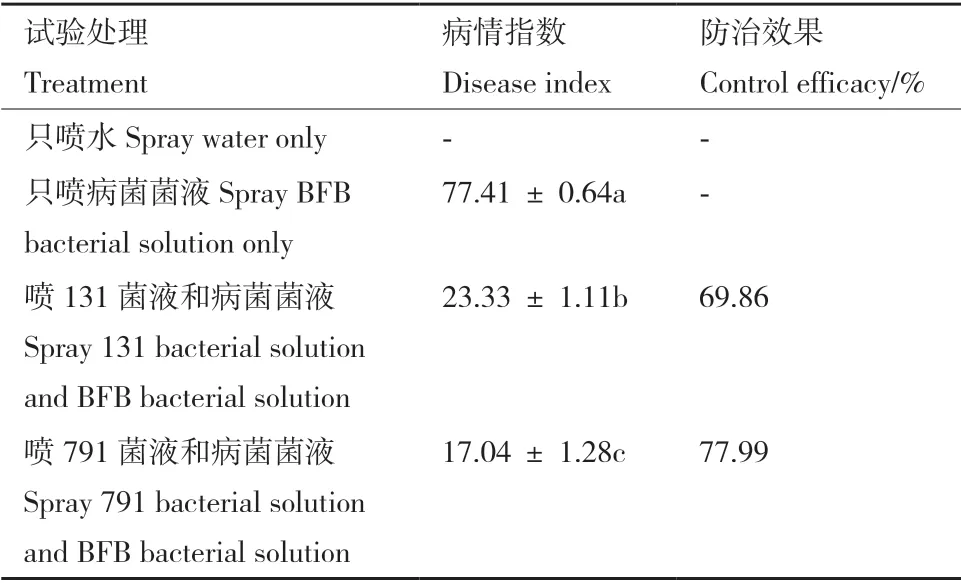
表4 菌株131 和791 的盆栽防病效果Table 4 Control efficacy of strain 131 and 791 in potting
2.8 两株拮抗菌对其它植物病原菌的抑菌作用
菌株131 和菌株791 对供试的5 株农业病原菌的抑菌结果见表5。经测定,所有对照组菌落直径均为85.00 mm。菌株131 对荔枝霜疫霉、火龙果炭疽病病菌、黄瓜叶斑病病菌表现出抑菌作用,其中对荔枝霜疫霉的抑制效果最好,抑菌直径为12.00 mm,抑菌率为14.12%,对其他病菌无活性。菌株791 对5 株农业病原菌均表现出不同程度的抑菌活性,其中对黄瓜叶斑病病菌的抑菌效果最好,抑菌直径可达21.25 mm,抑菌率为25.00%。

表5 菌株131、791 对其它病原菌的抑菌作用Table 5 Inhibition percentage of strain 131,791 against other pathogen
3 讨论
3.1 芽孢杆菌分离筛选的重要性
芽孢杆菌属(Bacillus)是植物表面、根际和土壤中重要的微生物种群,能够产生抗逆性孢子,是研究人员制成生物制剂的第一选择,有着促进生长和有效拮抗多种病害的作用[21]。枯草芽孢杆菌(B.subtilis)、解淀粉芽孢杆菌(B.amyloliquefaciens)、短小芽孢杆菌(B.pumilus)等均已用于防治细菌性果斑病,但关于贝莱斯芽孢杆菌对BFB 防治还鲜有研究,贝莱斯芽孢杆菌是近年来芽孢杆菌属的一株新种,既有促生作用、又有生防作用,还能产生多种酶类和抑菌活性物质[22],如表面活性素(surfactin)、伊枯草菌素(iturin)、芬荠素(fengycin)等具有广谱抑真菌活性的脂肽类物质[23-24]。已有研究发现,贝莱斯芽孢杆菌对黄瓜灰霉病菌Botrytis cinerea[25]、花生白绢病菌Sclerotium rolfsii、玉米黑曲霉病Aspergillus niger[26]、梨灰霉病菌Botrytis cinerea和青霉病菌Penicillium expansum[27]均有显著的抑菌效果。本试验以哈密瓜细菌性果斑病病原菌作为靶向菌,筛选出2 株拮抗作用较强的细菌,其盆栽防效分别为69.86%、77.99%,其中菌株791 对BFB 的离体叶片防治效果最佳且具有良好的稳定性,对荔枝霜疫霉、火龙果炭疽病病菌和黄瓜叶斑病病菌等病菌都有很强的拮抗效果,说明菌株791 不仅能产生可以有效拮抗植物病原真菌的脂肽类物质,还能产生有效防控细菌性植物病害的活性物质,极具开发成微生物农药的潜力。
3.2 芽孢杆菌鉴定的可靠性
芽孢杆菌属种主要根据生理生化特性和16S rRNA 基因序列分析进行鉴定,但是由于沙福芽孢杆菌(B.safensis)和贝莱斯芽孢杆菌(B.velezensis)无论从表型还是系统发育来说与枯草芽孢杆菌(B.
subtilis)、解淀粉芽孢杆菌(B.amyloliquefaciens)亲缘关系都非常接近。对该类菌株准确鉴定的难度越来越大,因此将传统鉴定方法与分子生物学方法相结合,才能对该类菌株进行准确的鉴定[28],本研究采用形态学观察、生理生化特性测定与16S rRNA 基因以及gyrB 基因序列分析相结合的方法,最终将菌株131 鉴定为沙福芽孢杆菌,菌株791 鉴定为贝莱斯芽孢杆菌。
3.3 不同条件对芽孢杆菌生长的影响
发酵培养基中的营养物质是微生物菌群生长以及繁殖的必须条件,并且为其代谢产物提供了原料。研究表明,最适的培养条件可以增加菌量,从而产生更多的活性物质来提高防效[29],因此,为生防菌提供合适的营养物质,并提供最适的生长条件是非常有必要的。在本研究中已明确了两株菌株的最佳生长条件,为后续菌株化合物的分离实验提供一定的参考价值,但菌株的最佳生长条件能否等于菌株产生抑菌物质的优化条件,还需要进一步验证[30]。梁艳琼等[31]以菌量和无菌发酵液的抑菌活性作为指标,采用单因素和正交试验对菌株JNC2 进行发酵条件优化,结果显示,该菌株的最佳生长条件等于产生活性物质的最佳发酵条件。而洪鹏等[32]在优化解淀粉芽孢杆菌B.amyloliquefaciensHF 01 的发酵过程中发现,培养基成分中不同的无机盐对菌体生长和活性物质的产生的影响不同,MgSO4能使菌量达到最大值,CaCl2能使抑菌圈直径达到最大值,说明每株菌株都有自己的生长特性,后续需对生长条件进行优化试验,希望在今后的实验中能进一步对其活性物质进行分离纯化,并且开展田间防治研究等。
4 结论
从哈密瓜根际土壤中分离得到196 株细菌,其中菌株131、791 具有较好拮抗BFB 病原菌效果,其抑菌直径分别为(19.03±0.13)mm,(17.55±0.29)mm。经鉴定,菌株131 为沙福芽孢杆菌(Bacillus safensis),菌株791 为贝莱斯芽孢杆菌(Bacillus velezensis)。菌株131、791 对BFB 室内盆栽防效分别为69.86%、77.99%,还对黄瓜叶斑病病菌等5 种病原真菌具有较好的抑菌效果。

