拟南芥ACOL8基因在乙烯合成与响应中的功能分析
林蓉 郑月萍 徐雪珍 李丹丹 郑志富,
(1.浙江农林大学林业与生物技术学院,杭州 311300;2.浙江农林大学现代农学院,杭州 311300)
乙烯是一种重要的植物内源激素,在植物的生长发育及植物对逆境胁迫的响应中发挥重要作用。植物体在种子萌发[1]、果实成熟[2]、花器官衰老[3]、叶片脱落[4]等生命进程中以及受到机械损伤和逆境胁迫[5-6]时,能产生大量的乙烯,从而促进植物器官成熟与衰老,影响植物对环境胁迫的响应。然而,乙烯的合成机制尚不完全清楚,这在一定程度上对植物生长发育与抗逆性的调控产生了限制作用。
1-氨基环丙烷羧酸是乙烯合成的直接前体,在ACC 氧化酶(ACC oxidase,ACO)的作用下转化为乙烯,ACO 被认为是乙烯合成途径中的关键酶之一[7-8]。植物中存在一个ACO基因家族,其在多种植物生理生化活动中发挥重要作用,如拟南芥ACO1参与根系的发育[9],玉米ACO2 能影响玉米穗长和籽粒产量[10],番茄ACO1 和ACO4 在花梗脱落中发挥作用[11]等。同时,植物中还存在一个ACC 氧化酶同源家族,但目前对其功能知之甚少。有研究发现,番茄中编码ACO 类似蛋白的E8 基因能参与乙烯的合成调控[12-13]。
拟南芥中存在12 个功能未知的ACC 氧化酶类似蛋白(ACO-like homolog,ACOL),其中ACOL8(ACO-like 8,At3g61400)与番茄E8 具有较高的相似性。利用TAIR 网站中的eFP Browser 工具,发现ACOL8 基因表达受茉莉酸诱导。为了探究ACOL8基因在乙烯合成与响应过程中的作用,本研究运用CRISPR-Cas9 基因编辑技术[14-15],创制了该基因的功能丧失型突变体。突变体与野生型的比较分析显示,ACOL8 基因参与乙烯的“三重反应”与拟南芥耐盐性的调控;同时还发现该基因的表达受乙烯信号的正反馈调控。
1 材料与方法
1.1 材料
哥伦比亚生态型拟南芥Col-0 用于CRISPR/Cas9基因编辑载体的转化;RNA 提取试剂盒购自全式金生物技术(北京)有限公司;反转录试剂盒和荧光定量PCR 试剂盒购自翌圣生物科技(上海)股份有限公司;BsaI 限制性内切酶购自宝日医生物技术(北京)有限公司;pCBC-DT1T2 质粒、大肠杆菌DH5α和农杆菌GV3101 由本实验室保存;CRISPR/Cas9 载体由朱丽颖等[15]构建,并由本实验室保存。
1.2 方法
1.2.1 拟南芥的培养方法
1.2.1.1 基质培养法 按腐殖质∶蛭石∶珍珠岩=3∶1∶1(V∶V∶V)的比例制备土壤基质。将在4℃春化3 d 的种子直播于基质表面,加盖保湿,于植物培养间培养,一周后揭盖并进行间苗。植物生长条件为室温23-25℃,湿度50%-60%,光照14 h,黑暗10 h。
1.2.1.2 培养基培养法 进行培养基培养前需进行拟南芥的种子灭菌,避免杂菌在培养基上大量滋生影响植物正常生长发育。取拟南芥种子置于1.5 mL离心管中,用1 mL 75%乙醇溶液消毒3 min,再用1 mL 含0.05% Tween 20 的35%漂白水灭菌5 min,用无菌ddH2O 清洗5 次。灭菌操作在超净工作台进行。随后将灭菌的种子在黑暗低温(4℃)环境下春化,2-3 d 后点种于1/2MS 培养基上于在植物组织培养间培养,生长条件为室温23-25℃,湿度50%-60%,光照14 h,黑暗10 h。
1.2.2 拟南芥ACOL8 基因突变体的构建
1.2.2.1 sgRNA 靶位点选择及引物设计 本研究以AT3G61400(ACOL8)基因为基础设计靶序列,使用CRISPR 在线设计工具(http://www.genome.arizona.edu/crispr/ CRISPR search.html)根据原间隔序列临近基序(PAM)序列,在外显子的上下游选择两个ACOL8 基因的特异性靶序列,并根据靶序列设计两个向导RNA(sgRNA1 和sgRNA2)(图1,表1)。
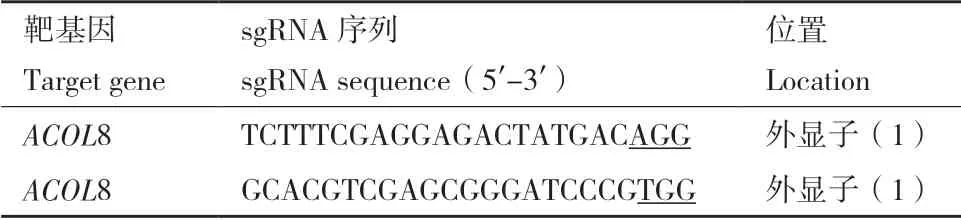
表1 用于ACOL8 基因编辑的靶序列Table 1 Target sequences for ACOL8 gene editing
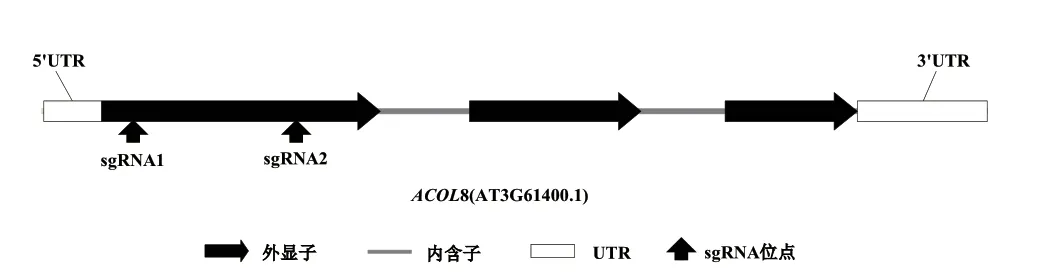
图1 拟南芥ACOL8 基因结构及基因编辑靶位点示意图Fig.1 Diagram of the structure of Arabidopsis ACOL8 gene and the target sites for gene editing
1.2.2.2 sgRNA 表达盒的构建 以稀释100 倍的pCBC-DT1T2 质粒(1 ng/μL)为模板,以ZYP210-F0、ZYP211-R0、ZYP209-BsF 和ZYP212-BsR(表2)为扩增引物,进行四引物聚合酶链式反应(PCR),在sgRNA 片段两端分别克隆一个靶序列和BsaI 酶切位点序列,从而获得具有2 个ACOL8 靶序列的sgRNA表达盒。对反应产物进行琼脂糖凝胶电泳检验,并割胶回收目的片段。
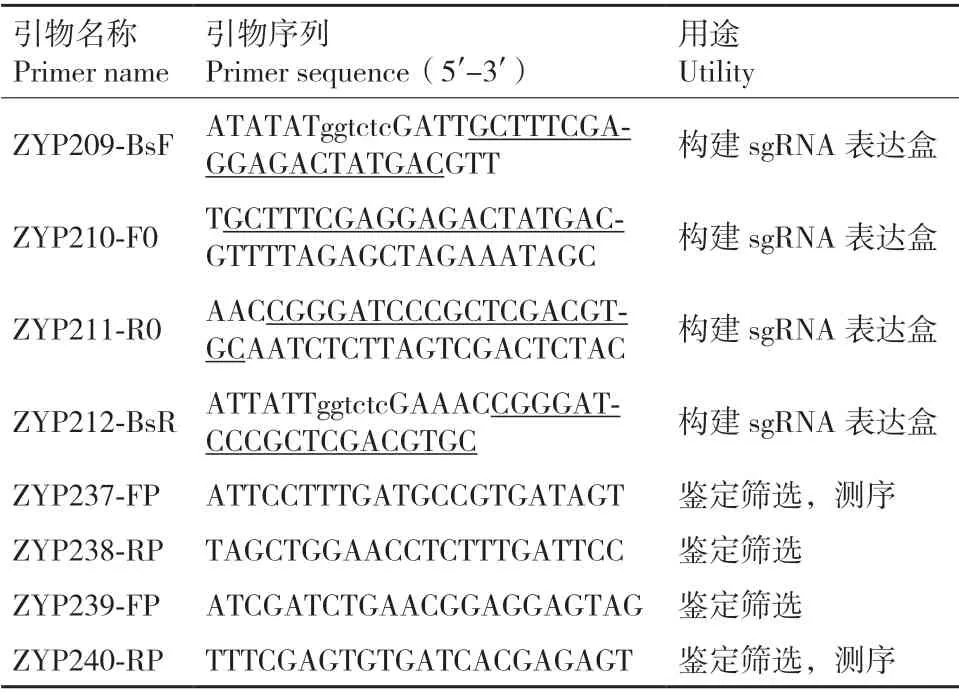
表2 引物序列Table 2 Primer sequences
1.2.2.3 基因编辑重组载体的构建 使用BsaI 限制性内切酶酶切sgRNA 表达盒及由朱丽颖等[15]构建的CRISPR/Cas9 载体,使用T4 连接酶将两个酶切产物进行连接,获得含ACOL8 sgRNA 的基因编辑重组载体。将酶连接产物转化大肠杆菌DH5α 感受态,使用菌落PCR 筛选大肠杆菌阳性转化子并对其扩大培养,随后对大肠杆菌菌液进行质粒抽提并转化农杆菌GV3101 菌株。
1.2.2.4 农杆菌介导的花序浸染转化拟南芥 使用含基因编辑重组载体的农杆菌菌体重悬液浸染野生型拟南芥(Col-0)的花序进行转化。本研究采用的基因编辑重组载体含种子特异性表达的荧光蛋白基因mCherry,可在蓝色激发光下筛选呈红色荧光的T1代转基因阳性种子。
1.2.2.5ACOL8 靶向突变的突变体的分子鉴定 在两个靶序列的上下游分别设计引物(表2),并使用这两对引物分别对T1代阳性转基因植株进行两个靶序列的PCR 扩增,采用8%的非变性聚丙烯酰氨凝胶电泳法(PAGE)对扩增产物进行基因分型鉴定。最后对电泳鉴定出的突变体植株进行靶基因的测序鉴定,测序引物为ZYP237-FP 和ZYP240-RP(表2),本研究的测序结果均由擎科生物技术(杭州)有限公司提供。最后挑选不含红色荧光的突变体种子,即去除了基因编辑载体的突变体株系作为试验材料。
1.2.3 拟南芥的“三重反应”分析 将灭菌后的种子分别点种于1/2 MS 固体培养基和含1 μmol/L ACC的1/2 MS 培养基上,作为对照组和处理组。使用封口膜密封后放入4℃冰箱,避光春化3 d。春化后将培养皿置于室温22℃的黑暗条件下生长。3 d 后用体视显微镜观察与拍摄不同基因型黄化幼苗的表型变化,随后使用ImageJ 软件测量黄化幼苗下胚轴及主根的长度。每个基因型拟南芥设置10 个以上生物学重复,使用SPSS 19.0 进行单因素方差法分析不同基因型间的差异显著性。
1.2.4 实时荧光定量PCR(qPCR) 对基质培养28 d 的拟南芥的根系(n=10)进行RNA 的提取。将RNA 反转录为cDNA,作为实时荧光定量PCR 的模板。以ACTIN为内参基因,对ACOL8 基因进行特异性扩增。各引物序列见表3。本实验使用BIO-RAD CFX9 manager 3.0 软件进行数据分析并导出Ct 值。计算公式为:相对表达量=2-△△Ct。最后使用SPSS 19.0 进行基于单因素方差(One way ANOVA)法分析不同株系间的差异显著性。
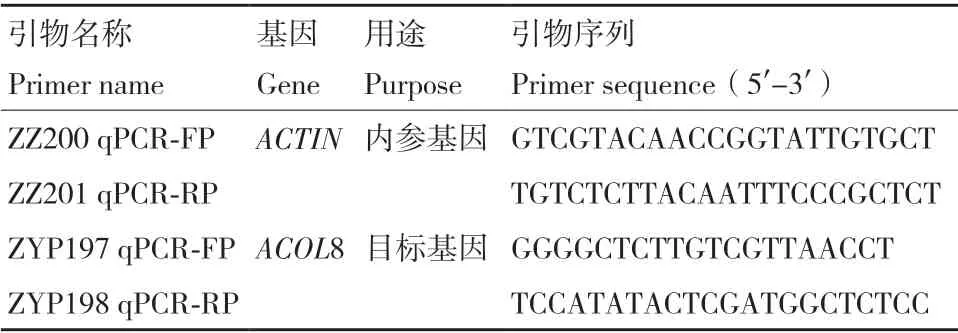
表3 实时荧光定量PCR 引物序列Table 3 Sequences of the primers used in real-time fluorescent quantitative PCR
1.2.5 拟南芥的地上部鲜重测定 取播种后28 d 的植株剪取整个地上部,用电子天平测定其鲜重。每个株系设置6 个生物学重复,使用SPSS 19.0 进行单因素方差法分析不同株系间的差异显著性。
1.2.6 拟南芥的盐处理试验 挑选在1/2 MS 培养基上垂直生长7 d、长势一致的野生型及突变体幼苗,移植于含不同浓度NaCl(0、75、125 mmol/L)的1/2 MS 培养基上进行垂直培养。盐处理5 d 后,观察表型并测定根长、根重、地上部生物量等生理指标。根冠比的计算公式为:根冠比=根鲜重(mg)/地上部鲜重(mg)。每个处理设置10 个生物学重复,使用SPSS 19.0 进行单因素方差法分析不同基因型间的差异显著性。
2 结果
2.1 ACC氧化酶类似蛋白的鉴定
在NCBI(https://www.ncbi.nlm.nih.gov/)数据库搜索拟南芥ACC 氧化酶及其类似蛋白,获得5 个编码ACC 氧化酶(ACO1-ACO5)和12 个编码ACC氧化酶类似蛋白的基因,后者依次命名为ACOL1-12。ACOL基因编码的氨基酸长度在345-398 aa 之间,同ACC 氧化酶氨基酸长度较相近(表4)。使用MEGA7 对这些氨基酸序列进行多重序列比对,并采用最大邻接法构建系统进化树,结果显示ACOL1-ACOL5 和ACOL8 同ACO 家族成员的关系相对较亲近(图2),这促使我们推测一种可能性,即ACOL1-ACOL5 和ACOL8 可能具有ACC 氧化酶的类似功能。

图2 ACC 氧化酶家族及其类似蛋白的系统树图分析Fig.2 A dendrogram analysis of members of the ACC oxidase family and ACO-like homologs
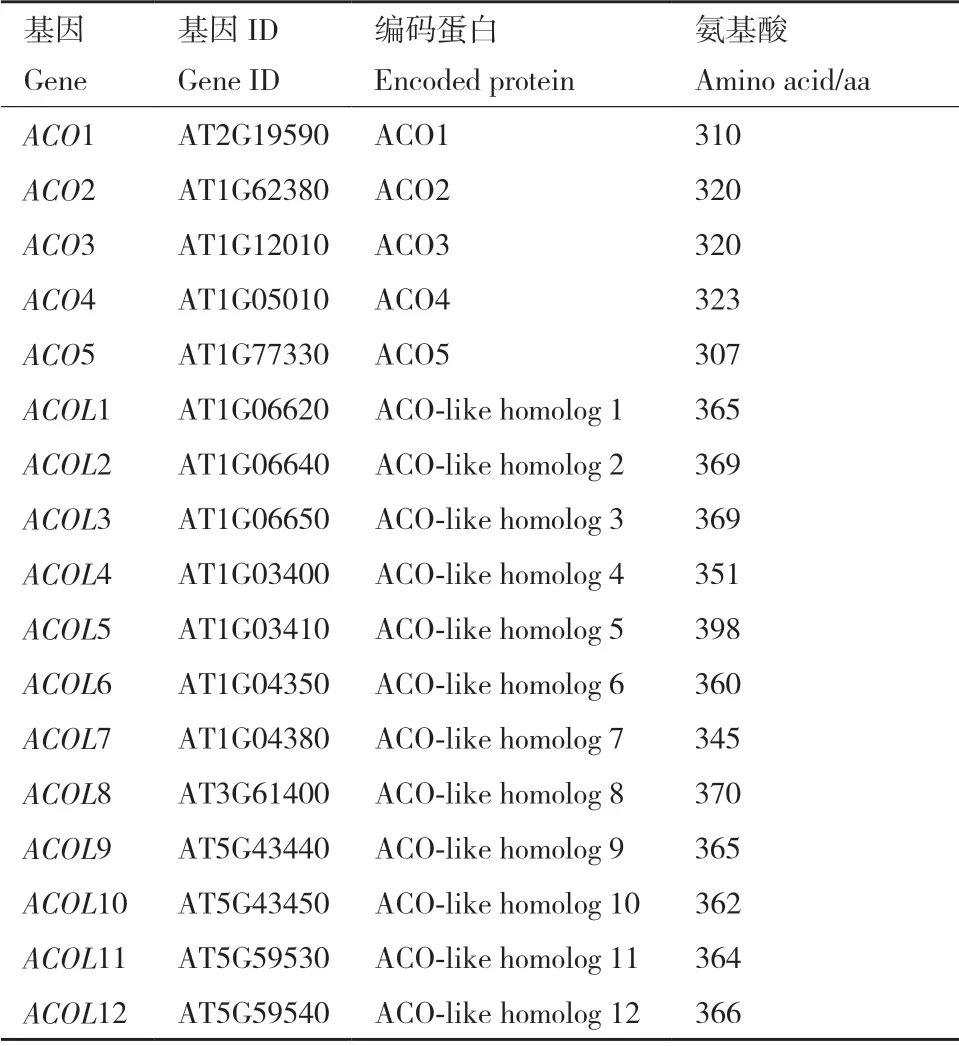
表4 编码拟南芥ACC 氧化酶及其类似蛋白的基因特性Table 4 Characteristics of genes encoding Arabidopsis ACC oxidases and ACO-like homologs
为了进一步了解这些基因的功能,利用拟南芥tair 网站中的eFP Browser 工具(http://bar.utoronto.ca/efp/cgi-bin/efpWeb.cgi)对不同ACOL基因的表达特性进行了分析。发现正常生长条件下ACOL8 基因在植物体内的表达量很低,但其表达受茉莉酸高度诱导。用10 μmol/L 的茉莉酸甲酯处理拟南芥幼苗0.5、1、3 h,该基因的表达量分别比对照增加2.5、4.4与2.2 倍,猜测在茉莉酸信号的诱导下ACOL8 基因可能通过影响ACC 的合成参与乙烯与茉莉酸的交互作用。因此,本文重点研究该基因的功能。
2.2 ACOL8基因突变体的构建
为明确ACOL8 基因的功能,本研究使用CRIS-PR-Cas9 技术构建了ACOL8 基因的功能丧失型突变体,随后对之进行表型分析。本研究设计的编辑位点sgRNA1 对应的氨基酸位于蛋白质的N 端,而sgRNA2 对应的氨基酸位于ACC 氧化酶的保守基序处(图3),这两个氨基酸序列发生改变易导致蛋白结构彻底改变。对突变植株的突变位点分析结果显示,ACOL8 基因在两个靶位点处均发生了编辑。本研究共计筛选出14 个不同编辑形式的纯合突变体株系,其突变类型有3 种,包括碱基的缺失、碱基的插入以及DNA 片段的倒位。碱基的缺失包括1-30 bp 的中小片段的缺失及243 bp 的两个靶序列间的DNA 大片段缺失。碱基的插入则是1-5 bp 的小片段插入,其中以1 bp 的插入为主。DNA 片段的倒位发生在两个靶位点间,为237 bp 的DNA 大片段倒位。值得注意的是,sgRNA1 位点主要发生了在CDS 第65、66 位碱基中间的单碱基T 的插入突变,该碱基的插入在目标序列上引入了终止子,即在mRNA 上引入终止密码子UAA,使得翻译过程提前终止。

图3 ACC 氧化酶家族及ACOL8 的氨基酸序列比对Fig.3 Amino acid sequences alignment of the ACC oxidase family members and ACOL8
根据突变类型及特点,本研究从14 个纯合突变体株系中选择3 个突变体株系作为实验材料进行后续研究,并将其分别命名为acol8-1、acol8-2 和acol8-3(表5)。acol8-1 在sgRNA2 位点处有5 bp 的非3 的倍数碱基对的插入,使阅读框发生改变,进而导致了移码突变,保守序列发生改变。acol8-2在sgRNA1 和sgRNA2 位点间发生了大片段的DNA的缺失,导致超过总氨基酸数1/5 的氨基酸残基缺失,不能翻译出完整的肽链。acol8-3 在sgRNA1 和sgRNA2 位点处各有1 碱基的插入,其中sgRNA1 位点处的单碱基插入引入了终止子,能使mRNA 的翻译在ACOL8 蛋白的N 端提前终止(图4,表5)。这3 个突变体株系的突变基因均不能编码完整的ACOL8 蛋白,因此认为其是ACOL8 的功能丧失型突变体。
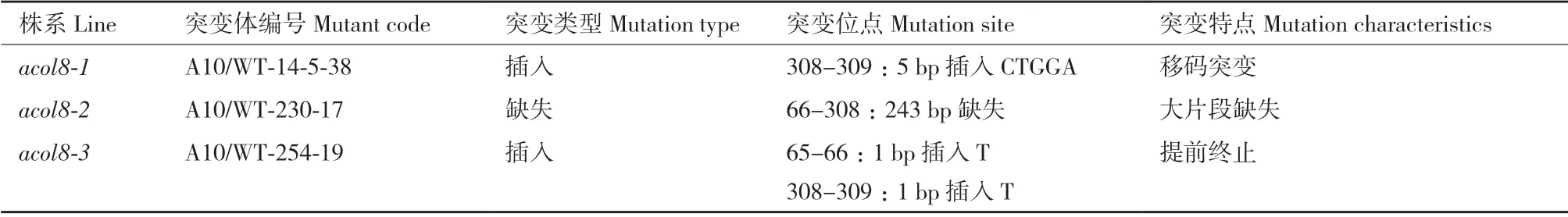
表5 三个acol8 突变体的突变位点Table 5 Mutation sites in the three acol8 mutants
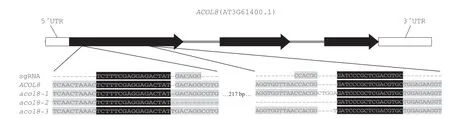
图4 三个acol8 突变体的突变序列Fig.4 Mutated sequences in the three acol8 mutants
2.3 ACOL8基因突变体与野生型的“三重反应”比较
为了揭示ACOL8 基因在乙烯生物合成过程中的潜在功能,利用经典的乙烯“三重反应”比较分析acol8 突变体和野生型拟南芥的黄化幼苗生长情况。结果显示,ACOL8 的突变显著促进暗处理下黄化苗下胚轴及主根的伸长,acol8-1、acol8-2 和acol8-3 的下胚轴长度大约是野生型的2.5 倍,其主根长约为野生型的1.3 倍(图5),这说明ACOL8 基因参与调控黄化幼苗的“三重反应”。
在外源ACC 处理下,acol8 突变体和野生型拟南芥的下胚轴及主根长度均明显下降。与野生型相比,acol8 突变体(除acol8-2 外)的主根长无显著差异。然而,3 个突变体的下胚轴长度达到野生型的1.5 倍及以上(图5)。此外,ACC 处理会使部分acol8 突变体黄化幼苗表现出子叶张开的典型去黄化特征(图5-A)。上述结果显示,ACOL8 的突变减弱了拟南芥对乙烯合成前体的响应。一种可能的解释是,ACOL8 的突变降低了内源ACC 的合成,进而影响乙烯信号响应。
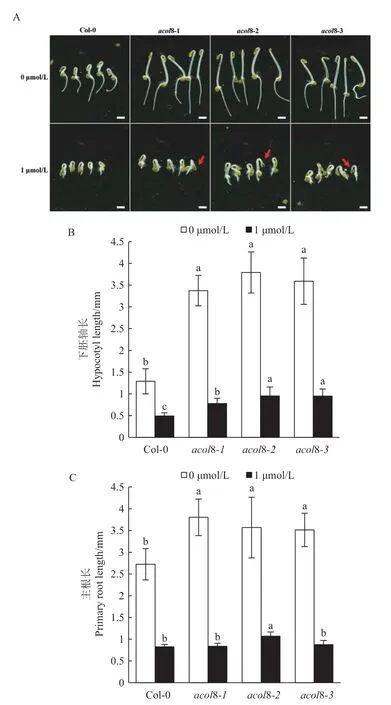
图5 acol8 突变体与野生型拟南芥黄化幼苗的“三重反应”比较Fig.5 Comparison of the “triple responses” of etiolated seedlings of wild type Arabidopsis and acol8 mutant
2.4 ACOL8基因的表达受乙烯信号正反馈调控
鉴于植物体内乙烯的合成受乙烯信号的反馈调控,我们探究ACOL8 基因的表达是否受乙烯信号调控。于是,比较分析了野生型、etr1-3(乙烯受体ETR1 突变体,对乙烯不敏感)和EIN3ox 株系(EIN3 过表达转基因拟南芥,表现出组成型乙烯反应)中的ACOL8 表达水平,结果显示etr1-3 的突变使ACOL8 基因的表达量下调了约87%,而乙烯信号途径中关键转录因子EIN3的过表达则产生相反效应,使ACOL8 基因表达量上调了近1 倍(图6)。以上结果说明ACOL8 基因的表达受乙烯信号正反馈调控。
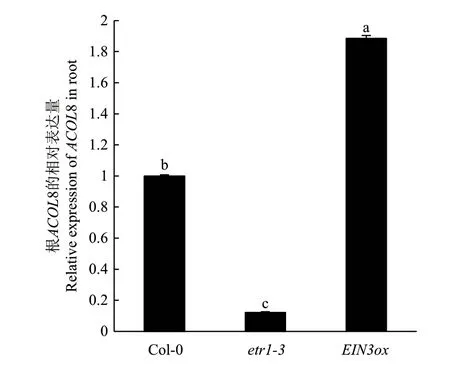
图6 etr1-3 和 EIN3ox 与野生型拟南芥的ACOL8 基因相对表达量比较Fig.6 Comparison of the relative expressions of ACOL8 gene in the roots of wild type Arabidopsis and etr1-3 and EIN3ox line
2.5 ACOL8基因对拟南芥正常生长的影响分析
前面研究发现ACOL8 基因能影响拟南芥黄化幼苗对乙烯的响应,且其表达受乙烯信号调控,于是我们进一步比较分析了正常生长条件下ACOL8 基因突变体与野生型在整个生育期的表型差异。结果显示,3 个突变体株系的地上部生长与野生型无明显差异(图7),说明ACOL8 基因并非拟南芥正常生长所必需的。

图7 三个acol8 突变体与野生型拟南芥的表型比较Fig.7 Comparison of the phenotypes of wild type Arabidopsis and three acol8 mutants
2.6 ACOL8基因突变对拟南芥耐盐性的影响
研究表明,虽然乙烯信号不是拟南芥正常生长所必需的,但它在盐胁迫响应过程中发挥重要作用。若ACOL8 基因参与乙烯的合成,那么该基因的突变会导致拟南芥对盐胁迫的响应发生改变。因此,本研究进一步探究了ACOL8 基因对耐盐性的影响。结果显示,在75 mmol/L NaCl 处理下,3 个acol8 突变体株系的根冠比均显著小于野生型,其根冠比比野生型低了29%-40%(图8-A)。根冠比反映了拟南芥生物量在地上部及根部的分配关系,根冠比增加有利于增强植物对逆境的适应能力。ACOL8 基因的突变降低了盐处理下拟南芥根冠比,其根部无法更好地吸收水分、营养物质等以抵御盐胁迫带来的伤害,因而降低了拟南芥的耐盐性。当用高浓度NaCl(125 mmol/L)处理时,ACOL8 基因的突变会促进拟南芥白化苗的产生,野生型拟南芥的白化率约为20%,而acol8 突变体的白化率则为30%-40%(图8-B),该结果进一步说明ACOL8 基因的突变降低了拟南芥的耐盐性。以上结果暗示ACOL8 基因可能通过参与乙烯的合成影响拟南芥的耐盐性。
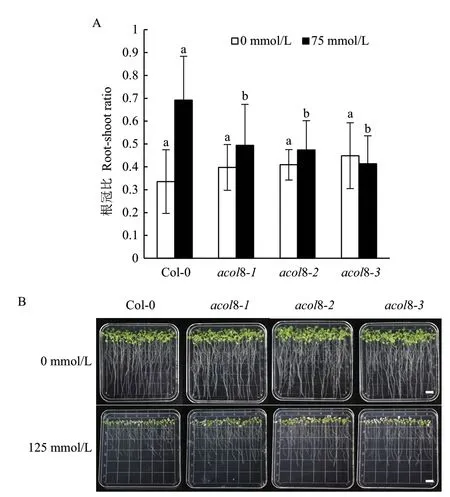
图8 acol8 突变体与野生型拟南芥的耐盐性比较Fig.8 Comparison of salt tolerances of wild type Arabidopsis and acol8 mutants
3 讨论
植物激素乙烯的合成机制尚不完全清楚,为了完善乙烯的合成机制,本文利用反向遗传学探讨ACOL8 基因在乙烯合成中的作用。本研究利用CRISPR/Cas9 技术高效靶向编辑ACOL8 基因,从发生编辑的突变体植株中选取3 个发生了无义突变或错义突变的突变体,它们在各种生长条件下的表型一致,说明这些表型的产生的确是ACOL8 基因的突变引起的,这为剖析ACOL8 基因的功能提供可靠材料。
通过对ACOL8 基因功能丧失型突变体与野生型的比较分析,我们首先发现该基因参与调控经典的乙烯“三重反应”,这是因为在没有外源ACC 处理条件下,黄化幼苗的下胚轴与主根长度因ACOL8基因的突变增加了;同时,该基因的突变降低了拟南芥黄化幼苗对外源ACC 的敏感性。其次,本研究发现该基因的表达受乙烯信号的正反馈调控,这体现于两个方面:(1)因EIN3 基因的过表达引起的乙烯信号加强促进了该基因的表达;(2)因ETR1 的突变导致的乙烯信号减弱产生了相反效应。这一发现得到了过去研究结果的支持,即乙烯信号可以正反馈调节乙烯合成相关基因的表达,促进乙烯的合成[16-17]。再者,本研究发现ACOL8 基因的突变不影响拟南芥正常生长,但降低了拟南芥的耐盐性,这与乙烯提高植物的耐盐性[18-20]的观点一致,因而不能排除这种可能性,即ACOL8 基因的突变减弱了盐胁迫条件下的乙烯合成,从而影响拟南芥的耐盐性。综上所述,我们有理由推断,ACOL8 可能具有ACC 氧化酶功能,参与乙烯的合成,进而调控拟南芥对乙烯的响应。然而,要彻底明确ACOL8 是否具有ACC 氧化酶的功能,还需要在生理生化水平上加以证实。一是,运用气相色谱法分析特定条件下acol8 突变体与野生型体内的乙烯含量差异,鉴定ACOL8 基因在乙烯合成中的作用;二是,对ACOL8基因进行异源表达分析,鉴定其是否具有ACC 氧化酶的功能。
4 结论
运用CRISPR/Cas9 基因编辑技术成功创制了多个ACOL8 基因的功能丧失型突变体。突变体与野生型的比较分析显示,ACOL8 基因参与黄化幼苗生长及拟南芥耐盐性的调控。该基因的表达受乙烯信号的正反馈调控,同时受茉莉酸信号的诱导,表明它在乙烯与茉莉酸互作过程中发挥某种作用。

