泛素-蛋白酶体系统影响植物农艺性状的研究进展
王翠翠 傅达奇
(1.北京电子科技职业学院生物工程学院,北京 100176;2.中国农业大学食品科学与营养工程学院,北京 100083)
当前人口、环境、气候、生态平衡等问题层出不穷,改良植物农艺性状,提高产量,增强品质,维持植物内稳态至关重要。目前一些研究已经揭示了植物蛋白质分子的识别和分子作用机制。活细胞内的蛋白质通过调节特定的生化或代谢途径控制细胞活动和生理过程。构象的改变,亚细胞定位或稳定性变化都会影响蛋白质的活性。蛋白质的降解与合成一样重要。除了线粒体和细胞质中的蛋白酶及溶酶体,泛素-蛋白酶体系统(UPS)是蛋白质降解的主要途径,负责细胞中大多数蛋白质的降解(80%-90%)[1]。UPS 提供了一种有效和快速的方法来选择性降解蛋白达到广泛调节哺乳动物和植物细胞的细胞学和生理过程的目的。近年来,遗传和细胞生物学方法揭示了UPS 在植物内稳态的几乎所有方面的作用,包括植物生长发育、对植物激素的反应以及对非生物和生物刺激的信号传递[2-4]。本文主要讨论了近年来UPS 调控农艺性状方面的研究进展和未来的发展方向。
1 E2 结合酶的功能
成千上万的蛋白质参与泛素化、识别和处理泛素化蛋白质以及26S 蛋白酶体的调控,表明泛素在植物细胞生理学和植物对环境条件的反应中具有广泛的作用[5]。泛素通过泛素激活酶(E1)、一种或多种泛素结合酶(E2)和泛素连接酶(E3)附着在底物蛋白上[6]。E1 启动共轭级联,对靶标特异性影响不大。拟南芥中只有两种E1 亚型,其中一种可能是核定位的[7]。相比之下,在拟南芥基因组中,E2 亚型是一个由至少37 个E2 基因组成的大家族,这些基因分为12 个亚家族和8 个E2-like 基因[8]。有趣的是,许多E2 编码基因是应激诱导的。如大豆GmUBC2(Ub conjugating enzyme E2)、花生AhUBC2和拟南芥AtUBC32在干旱或盐胁迫下转录水平上调[9-11]。atubc32突变体植株更耐盐胁迫,超表达AtUBC32使植株对盐胁迫敏感[9]。此外,在拟南芥中过表达豇豆Vignaradiata UBC1(VrUBC1)、AhUBC2或GmUBC2植株具有更强的干旱耐受性[12]。Pan 等[13]还发现拟南芥中AtUBC27 正向调控ABA信号转导和抗旱性,AtUBC8 和AtUBC24 分别是应对氮限制或磷缺乏所必需的[14]。最近研究发现,OsUBC26,一种水稻泛素结合酶,可以防御稻瘟病菌。通过接种稻瘟病菌和茉莉酸甲酯处理可以诱导OsUBC26的表达。OsUBC26基因沉默的水稻对稻瘟病菌的抗性减弱[15]。
2 E3 连接酶的功能
蛋白质降解在植物生长发育中起着至关重要的作用。越来越多的研究表明,UPS 也是植物适应环境胁迫的一个组成部分,如干旱、盐度、寒冷、营养剥夺和病原体。根据植物E3 连接酶的结构组成和激活的泛素(Ub)片段的结合过程,可以将植物E3 连接酶分为三大类:PUB(plant U-box)、HECT(homologous to the E6-AP carboxyl terminus),以及RING-type E3 连接酶[16-19]。与PUB 和RINGs 连接酶不同,HECT E3s 是E3 酶中唯一一组在识别并催化底物泛素化之前被E2 -泛素结合酶泛素化的酶。在拟南芥中,7 种HECT 酶已被鉴定[20]。PUB 蛋白与HECT 酶类似,在非植物真核生物中构成一个小型E3 连接酶家族,如人类中含2 个和酵母中含21个[21]。然而,它们在植物中数量更多[22]。例如,对番茄进行全基因组分析发现,62 种E3 连接酶含有一个U-box 结构域[23]。RING E3 连接酶是植物基因组中最复杂、最神秘的一组蛋白质。它由单亚基和多亚基E3 酶组成。一个单亚基RING 型E3 连接酶包含一个RING 基序,用于与E2 泛素结合酶相互作用,以及一个底物识别区域来招募底物。多亚基RING 型E3 酶可分为大组CRL E3(Cullin(Cul)-RING)连接酶[24-25]和小组后期促进酶复合物APCs(anaphase-promoting complexes)[26-27]。植物CRL E3连接酶可以根据底物受体的不同进一步分为3 个主要的亚组:(1)Skp1-Cul1-F-box(SCF)复合物,其中大量的F-box 蛋白作为底物受体;(2)Broad complex-Tramtrack-Bric a brac(BTB)-Cul3a/b 复合体,利用其BTB 蛋白识别底物;(3)DDB1-binding/WD40-Cul4 复合物,通过DDB1-binding/WD40 蛋白引导蛋白泛素化[28]。2019年有研究表明RING 型E3 连接酶基因在单子叶和双子叶植物基因组中都有编码(表1)[29]。植物基因组中如此大的E3 连接酶扩展群,为植物应对各种环境挑战提供了必要的基因组资源,如病原体响应、干旱敏感性、营养平衡和耐热性等。
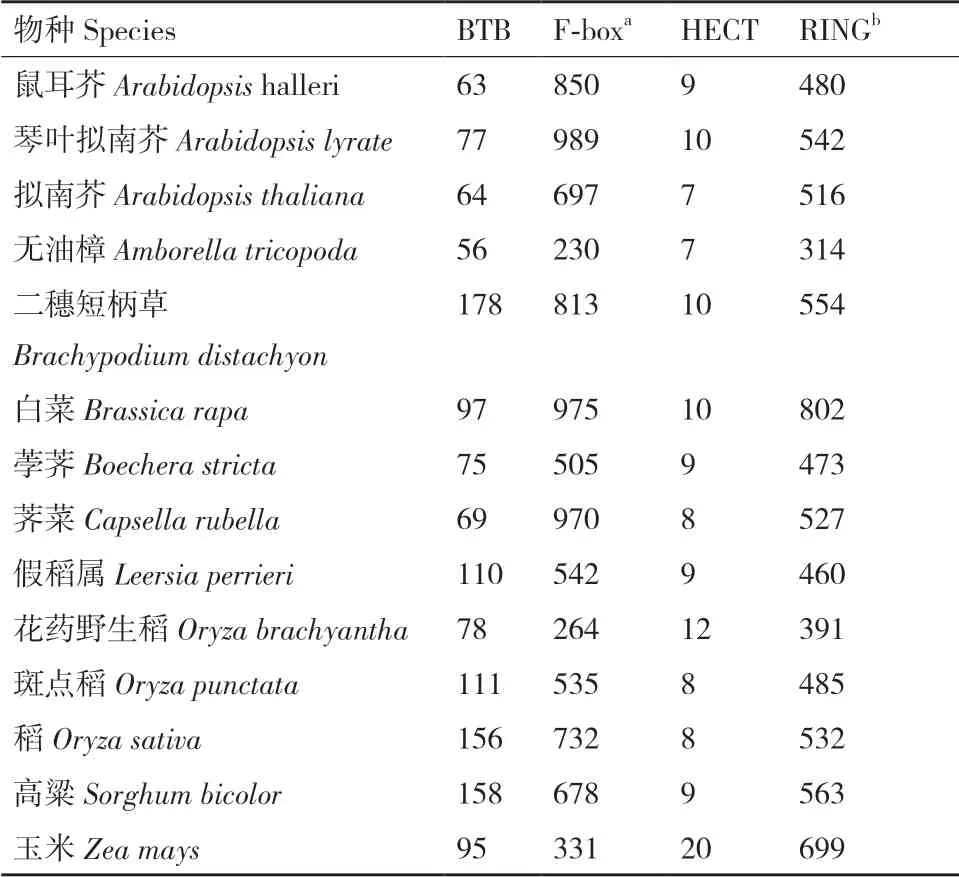
表1 在选定的14 个植物基因组中预测的E3 连接酶数量Table 1 Number of E3 ligases predicted in 14 selected plant genomes
2.1 E3连接酶影响植物对干旱和盐度的响应调控
苹果中RING-type E3 连接酶MIEL1(MYB30-interaction E3 ligase)可以通过26S 蛋白酶体途径介导MdBBX7(B-BOX 7)的泛素化降解,是干旱胁迫响应的负调控因子。MdBBX7的过表达增强了其抗旱性,而敲除MdBBX7则降低了其抗旱性[30]。RING-type E3 连接酶DRIP1 和DRIP2 功能冗余,通过泛素介导的蛋白水解,降解DREB2A(dehydrationresponsive element binding protein 2A),一种调控干旱和盐胁迫诱导基因表达的转录因子,负向调节干旱胁迫响应[31-32]。drip1、drip2双突变体表现出比单突变体更好的干旱耐受性。在双突变体中增加DREB2A基因的表达,导致干旱响应基因的表达量进一步升高[32]。进一步研究发现,DREB2A 中一个30-aa 的负调控域(NRD)的缺失会使DREB2A 转化为一种稳定的、组成性的活性形式,Cullin3(CUL3)E3 连接酶的作用底物BPM(BTB/POZ and math domain proteins),可与DREB2A 的NRD 相互作用。因此BPM 表达的缺失增强了DREB2A 的稳定性使拟南芥耐热性提高[33]。3 个RING 型E3 连接酶拟南芥RGLG1、RGLG2 和水稻OsDIS1 的功能缺失也能提高植物的抗旱性[34-35]。目前RGLG1 和RGLG2 影响植物抗旱性的作用机制包括两点:RGLG1 和RGLG2介导了AtERF53(ethylene response factor 53)的蛋白酶体降解,AtERF53 是调控干旱诱导的基因表达的转录因子;泛素连接酶RGLG1 和RGLG2 在赖氨酸残基K32 和K154 处泛素化MAPKKK18(mitogen activated protein kinase kinase kinase 18),并促进其降解,负向调控MAPKKK18 介导的拟南芥的耐旱性[36]。OsDIS1 通过调节蛋白OsNek6(一种与微管蛋白复合物相关的丝氨酸/苏氨酸蛋白激酶)的数量,从而影响与干旱胁迫相关基因的转录。气孔运动的调节是植物适应环境胁迫的关键。拟南芥中的泛素E3连接酶MREL57(microtubule- related E3 ligase 57)和微管稳定蛋白WDL7(wave-dampened2-like7)相互互作,泛素化并降解WDL7,MREL57-WDL7 模块通过调节微管的分解来调节气孔在干旱胁迫和ABA处理下的关闭[37]。
在辣椒中,最近几项研究表明CaATBZ1,一个负调控脱落酸(ABA)信号转导的bZIP 转录因子,受RING E3 连接酶CaASRF1(Capsicum annuumABA sensitive RING finger E3 ligase 1)[38]和CaATIR1(Capsicum annuumATBZ1-interacting RING finger protein 1)的调节,正向调控脱落酸信号通路和干旱响应[39]。CaASRF1 也可通过调节CaAIBZ1(Capsicum annuumASRF1-interacting bZIP transcription factor 1)的稳定性,正向调控ABA 信号转导和干旱胁迫响应[40]。
由于盐胁迫和渗透胁迫与耐旱性密切相关,许多E3s,如AtPUB18/19/22/23、SDIR1、AtAIRP3/LOG2、AtATL61 和TaPUB1 等参与ABA 介导的盐、渗透和干旱响应[41-46]。UPS 组件调节ABA 生物合成或ABA 信号转导。脱落酸(ABA)在干旱情况下可以激活植物抗旱性[47]。除干旱外,ABA 还与各种不利的盐度和温度条件导致的非生物胁迫相关[48]。ABA 在幼苗发育和植物开花中也发挥着重要作用[49]。UPS 通过调节ABA 信号通路,在很大程度上影响应激的感知和转导[50]。E3 Ub 连接酶靶向不同的ABA 信号传导核心组分,即ABA 受体、PP2C、SNRK2 和ABFs/ABI5 等转录因子。
2.2 E3连接酶影响植物对寒冷、营养缺乏的响应调控
植物对冷胁迫的反应有些是由转录级联介导的。转录因子ICE1 及相关蛋白促进CBFs(C-repeat(CRT)-binding factors)的表达,导致下游效应基因表达增加。过表达RING-type E3 连接酶AtHOS1(osmotically responsive gene),介导ICE1 的降解,使拟南芥植株对温度波动更加敏感[51]。E3 泛素连接酶在泛素介导的热相关蛋白降解途径中起重要作用。C3HC4 锌指泛素E3 连接酶AtPPRT1 过表达株系增强了幼苗的基础和获得性耐热性,且热处理后AtPPRT1 和几个热相关基因(AtZAT12、AtHSP21和AtHSFA7a)的转录水平大幅上调[52]。而atpprt1突变体在高温胁迫下的萌发率和存活率降低。辣椒U-box E3 泛素连接酶CaPUB1(Capsicum annuumputative U-box protein 1)增强了转基因水稻的抗寒性,降低了其抗旱性[53]。另外还有一些具有非蛋白水解功能的E3 连接酶,如AtCHIP、OsHCI1。在低温条件下,过表达PUB E3 连接酶AtCHIP 的植物中可以观察到较高的磷酸酶活性,AtCHIP 介导的蛋白磷酸酶2A(PP2A)泛素化具有非蛋白水解功能[54]。另一个在温度胁迫信号转导过程中具有非蛋白水解功能的E3 连接酶是OsHCI1(Oryza sativaheat and cold induced 1),OsHCI1 介导的核蛋白(如OsbHLH065)重新定位促进了植物对高温胁迫的耐受性[55]。热诱导的OsHIRP1(Oryza sativaheat-induced RING finger protein 1)在热处理后定位于细胞核,并直接泛素化OsAKR4(主要在细胞核中)和OsHRK1(主要在胞质中)并将其降解[56]。
除了干旱、盐、冷胁迫,植物还能感知营养缺乏引起的胁迫。RING-type E3 连接酶NLA(nitrogen limitation adaptation)是植物对低氮响应的正调控因子。在拟南芥nla突变体中,NLA 亚细胞定位的改变破坏了NLA 与泛素共轭酶8(AtUBC8)的相互作用。与野生型相比,突变型植株对氮素缺失和衰老具有超敏感性[14]。具有泛素E3 连接酶活性的SDEL1 和SDEL2 的生化功能一致,SDEL1 或SDEL2的过表达导致无机磷酸盐(Pi)的过度积累,即使在Pi 充足的条件下也会诱导Pi 饥饿信号。相反,功能缺失的突变体则表现出Pi 积累减少和Pi 饥饿信号减弱。研究表明SDEL1 和SDEL2 促进SPX4(SPX-domain-containing protein 4)的降解,从而调节PHR2(phosphate starvation response protein 2)活性,调节Pi 稳态和Pi 信号,以响应外源Pi 的有效性[57]。碳(C)和氮(N)的利用比例对植物生长至关重要。碳/氮(C/N)比值,但C/N 平衡和C/N 信号转导的感知机制仍不清楚。FERONIA(FER)是一种受体激酶,FER 的突变导致拟南芥对高碳氮比过敏。FER 磷酸化E3 泛素连接酶ATL6,通过调节14-3-3蛋白的稳定性响应碳氮比[58]。
2.3 E3连接酶影响植物对生物胁迫响应的调控
在自然环境中,植物经常暴露于各种病原体,包括细菌、病毒、真菌和昆虫。植物已经进化出多种机制来保护自己免受病原体和昆虫的入侵,特别是通过茉莉酸(JAs)和水杨酸(SA)等激素介导的途径。与CSN(COP9 signalosome)相互作用的CRL-type E3 泛素连接酶包括SCFTIR1[59]和SCFCOI1,它们分别作用于生长素和JA 信号通路。CSN 在依赖JA 的植物防御反应中发挥重要作用,正调控植物对草食性烟草天蛾幼虫和坏死性真菌病原菌葡萄孢属灰霉菌的抗性[60]。SCFCOI1是茉莉基-I-异亮氨酸受体(JA-Ile)[61],JA-Ile 促进COI1-JAZ 相互作用并触发JAZ 的降解,释放结合的转录因子(如MYC2),激活下游防御基因的转录[62-63]。拟南芥coronatine insensitive1(coi1)突变体无法表达保护性病原体诱导的基因,导致对昆虫和病原体攻击的敏感性增加[64]。COI1 还与组蛋白去乙酰化酶RPD3b(reduced potassium dependency 3b)相互作用,通过去乙酰化调节靶基因的转录[65]。
NPR1(nonexpressor of pathogenesis-related geges 1)组装到BTB E3 连接酶中,通过SA 介导对病原体的系统获得性抗性(SAR)[66]。NPR1 是免疫应答的正向调节因子。而NPR1 的两个类似序列NPR3和NPR4 负向调节对病原体的应答[67]。NPR3/NPR4作为转录共抑制因子,SA 通过抑制其活性促进下游免疫调节因子的表达。U-box- E3 泛素连接酶CMPG1在宿主免疫相关PCD 中发挥积极作用。研究发现烟草中超表达NtCMPG1增强对黄分枝霉的抗性[68]。小麦亲缘种Haynaldia villosaL.中CMPG1-V,是CMPG1 的同源物,具有对白粉病的广谱抗性[69],表明CMPG1 也参与了单子叶植物先天免疫的调控。最新研究发现泛素E3 连接酶SINAT4基因超表达可削弱干旱诱导的对丁香假单胞菌Pseudomonas syringaepv.Tomato DC3000(Pst-DC3000)的免疫[70]。非生物胁迫和生物胁迫的相互作用,干旱诱导免疫的分子机制在很大程度上仍需进一步研究。
2.4 E3连接酶对植物生长发育的影响
2.4.1 泛素化是激素介导的植物生长发育的前提条件 Skp1-Cullin-F-box(SCF)E3 连接酶参与激素感知。生长素与F-box TIR1 结合形成一个活性复合物,靶向转录抑制因子Aux 和IAA 降解[71]。在相同的模式下,JA 作为氨基酸结合COI1 导致转录抑制因子JAZ 家族的降解[72]。GA(gibberellic acid)与GID1 结合导致构象改变,从而与DELLA 结合,该复合物随后被SCFSLY检测,引导DELLA 蛋白降解,释放对下游转录因子的抑制[73]。乙烯途径通过一个非常有趣的新基因(RING)- E3 连接酶,即SDIR1,它正调控乙烯的反应,并促进EIN3 的积累。研究表明,SDIR1 通过介导温度诱导的EBF1/EBF2 降解和EIN3 积累,调控乙烯对温度变化的响应[74-75]。
2.4.2 泛素化影响花发育的昼夜节律 花的发育是一个受多重调控的复杂过程,在过去的几十年里吸引了大量的研究。本文着重对近几年的研究进行综述。F-box 蛋白ZTL、FKF1 和LKP2 在昼夜节律调节中发挥重要作用,并存在功能重叠[76]。这些F-box蛋白都包含一个独特的光-氧-电压域,使它们能够检测蓝光[77]。作为SCF 复合体的一部分,ZTL 导致组分TOC1 降解[78]。ZTL 也调控PRR5[79]。PRR5通过影响TOC1 磷酸化和定位对昼夜节律钟有调节作用[80],并调节开花时间[81]。
RING E3 连接酶SINAT5 促进LHY 的降解,在开花过程中发挥了不可或缺的作用[82]。而另一种蛋白质DET1,保护LHY 免受SINAT5 的降解[83],但DET1 的作用机制尚不清楚。这3 种蛋白之间的相互作用似乎在决定开花时间方面很重要,因为sinat5突变体和LHY超表达植株都表现为开花延迟[84]。FLC(flowering locus C)的抑制是拟南芥从营养阶段过渡到生殖阶段的关键。FLC 抑制数个参与花诱导的基因的表达,研究发现SINAT5 通过泛素介导的FLC 蛋白水解来调控开花时间[85]。FLC 位点组蛋白H2B 的单泛素化和去泛素化都是FLC 适当表达所必需的。在一些作物物种中,HUB(histone monoubi quitination)同源基因在组蛋白H2B 泛素化过程中发挥了类似的作用。番茄的同源基因SlHUB1和SlHUB2在体外分离得到了单硫喹酸H2B[86]。FRRP1(flowering-related RING protein 1) 是HUB2在水稻中的同源基因,它能单泛素化H2B 并影响水稻的开花[87]。
FRIGIDA(FRI)是一个转录激活复合物中的支架蛋白,通过促进FLC的表达来抑制开花。FRI同样影响油料作物甘蓝型油菜、芥菜叶类蔬菜和芸薹类作物的花期[88-89]。水稻RING E3 连接酶HAF1(heading date-associated factor 1)负向调节ELF3(early flowering 3),这是一个在长日照下促进开花的转录因子。HAF1 在体外泛素化ELF3 并促进其在水稻中的降解[90]。另外haf1突变体在短日和长日条件下均表现出较晚的开花抽穗期,haf1主要通过调控Hd1(heading date 1)决定抽穗期[91]。泛素系统调节许多其他影响开花时间的蛋白质的丰度,特别是与调节昼夜节律时钟和激素合成有关的蛋白质[92]和调节开花信号的激素,尤其是赤霉素[93]。
2.4.3 泛素化影响果实品质 泛素化对果实成熟,品质等方面的研究目前还较少。葡萄中U-Box E3泛素连接酶VlPUB38 通过促进脱落醛氧化酶降解负调控果实成熟[94]。AtARRE,环型E3 泛素连接酶,通过控制蜡类生物合成酶ECERIFERUM1 和ECERIFERUM3 蛋白水平,负调控拟南芥表皮蜡质合成[95]。这为果实的品质调控提供一些参考。植物的角质层的主要组分为角质和蜡质。果实的角质层对果实的生理和品质具有重要的影响,它能够影响果实的外观(色泽、质地、均一性),采后处理效果,贮藏、运输和货架期等。乙烯激活的U-box 型E3 泛素连接酶MdPUB24 直接与MdBEL7 相互作用并泛素化MdBEL7。MdBEL7 的降解导致MdCLH、MdPPPH2和MdRCCR2的表达增强,从而导致叶绿素在苹果果实贮藏过程中的降解。研究表明,Ethylene- MdPUB24 - MdBEL7 模块在苹果果实贮藏过程中通过翻译后修饰调控叶绿素降解[96]。
2.4.4 泛素化影响种子发育 种子在脂质体中积累淀粉、三酰基甘油酯和蛋白质,以维持幼苗生长,直到它们能够通过光合作用产生自己的能量。除了为幼苗提供能量外,种子也是包括人类在内的动物的主要营养来源。种子大小是一个重要的农艺性状。首次发现泛素系统参与决定种子大小是在一个水稻的数量性状位点上,该位点编码环型E3 连接酶Grain WIDTH 2(GW2),GW2 负向调节种子大小和产量[97]。随后的研究表明,泛素系统调控多种影响种子大小的蛋白质[98-99],主要路径有3 条:(1)E3连接酶UPL3(ubiquitin-protein ligase 3)路径。在甘蓝型油菜中,HECT E3 连接酶UPL3 负向调控种子大小,并以LEC2(leafy cotyledon 2)蛋白为降解目标[100]。(2)DA1 路径。拟南芥最近的研究表明,泛素特异性蛋白酶UBP12 和UBP13 将DA1、DAR1和DAR2 去泛素化,降低了它们的肽酶活性。同样,组蛋白去泛素酶OTU1(ovarian tumor domain(OTU)-containing dub 1)也可以抑制DA1 和DA2 的表达[101]。小麦DA1 抑制细胞增殖,并与拟南芥DA2 的同源E3 连接酶GW2 相互作用[102]。研究发现,泛素特异性蛋白酶OsUBP15 促进水稻的大粒化,也与DA1密切相关[103]。DA1 路径通过抑制细胞增殖负向调节种子大小,但确切机制尚不清楚。(3)F-box 蛋白SAP 路径。拟南芥中SAP 靶向转录因子PPD1 和PPD2(PEAPOD 1 和2)进行降解;在豆科植物中,SAP(sterile petala)的同源基因SLB1(small leaf and bushy 1),是E3 连接酶复合体的一个组成部分,靶向BS1(big seeds 1)降解影响种子大小[104]。
3 26S 蛋白酶体对植物农艺性状的影响
3.1 蛋白酶体亚基在环境胁迫耐受性中的作用
26S 蛋白酶体功能的缺失或抑制也会改变植物的农艺性状。26S 蛋白酶体是由20S CP 和19S RP 组成的复合体。19S RP 亚基的突变导致复合物积累减少,靶蛋白依赖泛素化的蛋白水解速率降低,从而影响植物对非生物或生物胁迫的响应[105-106]。例如,拟南芥rpn10-1突变体植株对盐胁迫和热休克的耐受性较差,对紫外线辐射和DNA 损伤剂过敏[107]。RPN10 调节ABA 诱导的对环境环境胁迫的响应[106]。20S CP 既以泛素依赖的方式降解蛋白质也通过不依赖泛素化的蛋白质降解[105]。如氧化蛋白的降解是不依赖泛素化的[108],这与rpt2a,rpn10和rpt12a突变体对氧化应激的耐受性增强观点相一致[105,109]。
对20S CP 亚基的研究表明,α2 亚基OgTT1 有助于提高非洲水稻的耐热性和适应性[110]。与水稻OsTT1 相比,OgTT1 似乎在去除热应激变性的细胞毒性蛋白方面更有效,这与OgTT1 有不同的SNP(单核苷酸多态性)位点有关。ars5编码α6 亚基,基因敲除的拟南芥突变体在砷胁迫下,砷和巯基化合物积累增加,但ARS5 抑制转录反应的靶向蛋白仍有待鉴定[111]。最新研究表明,砷诱导的蛋白毒性胁迫导致拟南芥同源PUB22 和PUB23 U-box E3 泛素连接酶上调,pub22、pub23双突变体表现出砷敏感性种子萌发和根生长表型。PUB22/PUB23 通过负调控26S 蛋白酶体完整性在亚砷酸盐诱导的蛋白毒性应激反应中发挥关键作用[112]。
β1、β2 和β5 亚基分别具有半胱天冬酶、胰蛋白酶和胰凝乳蛋白酶活性[113]。外源病原菌信号增强了这3 个亚基的活性,参与植物对细菌感染的抗性,拟南芥中β1 负调控内质网应激导致的程序性细胞死亡[114]。然而,这些表型背后的分子机制尚不清楚。最近的一项研究报道,β5 亚基PBE1 的缺失影响了盐胁迫下蛋白酶体的组装,表明PBE1 对完整的蛋白酶体组装至关重要[115]。此外,研究发现PBE1 可以减少转录因子ABI5 的蛋白积累,从而调节ABA 介导的植物盐胁迫信号。
除了蛋白水解活性,20S 蛋白酶体也被证明具有核糖核酸酶(RNase)活性,可在体外降解莴苣花叶病毒(LMV)和烟草花叶病毒衍生的RNAs,例如拟南芥α5 亚基敲除突变体对LMV 感染的易感性显著增强[116]。
3.2 蛋白酶体亚基在植物正常生长发育中的作用
在拟南芥中,19S RP 中RPT2a 亚基,对植物细胞大小、抗氧化胁迫能力、芽尖及根尖分生组织的维持有十分重要的作用。同源基因RPT2b 在基尖及根尖分生组织中也有表达,但是突变体却没有任何表型上的变化[117]。rpt2a,rpt2b双突变体会造成雄配子和雌配子的死亡[118]。单个rpn5b突变体表现为野生型,而单个rpn5a突变体则表现出大量的形态缺陷,包括胚胎发生异常、在黑暗条件下去黄化发育、在光照下生长时出现严重的侏儒表型以及不育[119]。在拟南芥中过表达RPN5a 则会引起植株提前衰老。在rpn12a突变体中,两个细胞分裂素诱导基因CYCD3和NIA1被上调,使植株对细胞分裂素的响应敏感,影响植株根系的延长和叶子的形成[120]。rpn10-1突变体除了改变植物环境胁迫耐受性,还会导致种子萌发率降低、生长速率降低、生殖发育不良[121]。研究发现,拟南芥RPN10 还可以作为一种选择性自噬受体,通过与泛素化的蛋白酶体亚基/靶标和包裹自噬膜的脂化ATG8(autophagyrelated protein 8)同时相互作用,靶向失活的26S 蛋白酶体[122]。细胞内成分的自噬转换对于真核生物的细胞管理、营养循环和生长发育的各个方面都是至关重要的[123]。RPN11 与去泛素化有关,从蛋白酶体的靶向底物上去除泛素链是底物加工的先决条件,由去泛素酶Rpn11 完成。在盖子与蛋白酶体结合之前,Rpn11 去泛素酶活性被抑制,以防止多泛素化蛋白的非必要去泛素化[124],对植物正常生长发育至关最重要。
4 总结与展望
泛素-蛋白酶系统在植物生长发育和响应环境胁迫中起着关键作用。这里我们总结了泛素化影响的农艺性状包括:诱导开花、种子大小、果实品质和病原体反应等。
鉴于大量基因参与泛素系统,剖析具体的相互作用和这些相互作用的后果,这仍然是一个重大挑战。迄今为止编码UPS 组件的基因数量非常多,但只有少数基因及其功能得到了阐明。进一步鉴定E2s,不同的E3 底物,单亚基E3 连接酶和多亚基E3 连接酶,蛋白酶体亚基和蛋白酶体调节器将有助于阐明植物在蛋白质水平上影响植物农艺性状的调控机制,并为提高作物育种、对生物和非生物胁迫的耐受性提供有用策略。
基于异体或同源基因表达的遗传操作可以提高作物的农艺性状。UPS 中与种子大小相关的正调节因子,如SLB1 和OsUBP15 等,可以尝试通过超表达转基因技术提高水稻、玉米和小麦等作物的产量[103]。相反,GW2 和UPL3 等负向调控种子大小,可以通过基因敲除等手段提高作物产量[97,100]。此外,最近发展起来的基因组编辑技术(TALENs、Crispr/Cas9 等)允许相关蛋白酶体亚基基因的新等位基因的创建,这可能赋予更强的酶活性或促进蛋白酶体组装。新的等位基因可以用于分子育种,改进植物基因型。例如,与OsTT1 相比,OgTT1 在去除热应激变性的细胞毒蛋白方面的功能更有效,OsTT1 的SNP 位点与OgTT1 不同,因此,用CrispR/Cas9 替代水稻中的SNP 位点,可能有助于培育出更耐热的水稻。

