多发性骨髓瘤IgA-κ型转变为IgG-λ型1例并文献复习
刘海珠,徐晓涵,邵淑丽△
(1.威海市立医院中心实验室,山东 威海 264200;2.潍坊医学院医学检验学院,山东 潍坊 261053)
多发性骨髓瘤(multiple myeloma,MM)是一种治愈不良的,具有生物异质性的浆细胞疾病。MM特征是骨髓中单克隆浆细胞无限增长,从而产生过多没有功能的完整免疫球蛋白(Ig)或Ig链[1]。这些Ig的积累、异常的单克隆浆细胞与骨髓中其他细胞的相互作用从而产生了一系列问题,包括高钙血症、感染、贫血、骨病损、肾衰竭等[2]。MM约占所有血液系统恶性肿瘤的10%,MM之前有一个惰性期,称为意义不明的单克隆γ病(monoclonal gammopathy of undetermined significance,MGUS),该病无终末器官损害或骨髓瘤特征。MGUS的病因目前尚不清楚,但这种疾病可以发展成有症状的MM,每年发展为MM的风险约为1%,危险因素为单克隆蛋白水平高、骨髓浆细胞百分比高、存在IgA单克隆蛋白、游离轻链比率异常等。从20世纪60年代初到21世纪初,美国、法国等国家化疗加用类固醇(泼尼松或地塞米松)成为治疗MM的基础方案。梅尔法兰也被用于不适合移植的患者调理化疗和治疗。近年来,随着沙利度胺、来那度胺和硼替佐米等新的靶向疗法的发展,MM的治疗取得了进展,这些新药物显著改变了治疗策略。本例患者行PCD方案(硼替佐米[3]+环磷酰胺+地塞米松)或VTD方案(硼替佐米+地塞米松+沙利度胺)方案治疗MM的过程中发生一过性轻链转化,由IgA-κ型转变成IgG-λ型,现将本病例报道如下。
1 临床资料
1.1病例介绍 患者,男,69岁,有胃溃疡、“高血压”病史10年余,“脑梗死”10年余,因“无明显原因胸背部疼痛”入院检查。腰胸椎MIR检查显示:腰椎退变,胸6/8/10锥体压缩性骨折。入院行“胸6/8/10锥体压缩性骨折成形术”后出现呕血、黑便、失血性休克,经升压、扩容止血等治疗后病情逐渐改善。查体呈贫血貌,眼睑结膜苍白,心肺未见异常。
1.2实验室检查 常规检查:轻链转变前,中性粒细胞百分比59.8%,转变后明显升高(79.0%),略高于参考值。轻链转变前后,淋巴细胞绝对值均低于参考值。轻链转变前后,红细胞沉降率、球蛋白均明显高于参考值;轻链转变后,总蛋白明显升高,高于参考值;轻链转变后,清蛋白有所下降,略低于参考值。血清体液免疫检查:轻链转变前后,IgA、β2-微球蛋白、血清KAP轻链均高于参考值,IgG、IgM、γ-球蛋白均低于参考值。见表1、2。
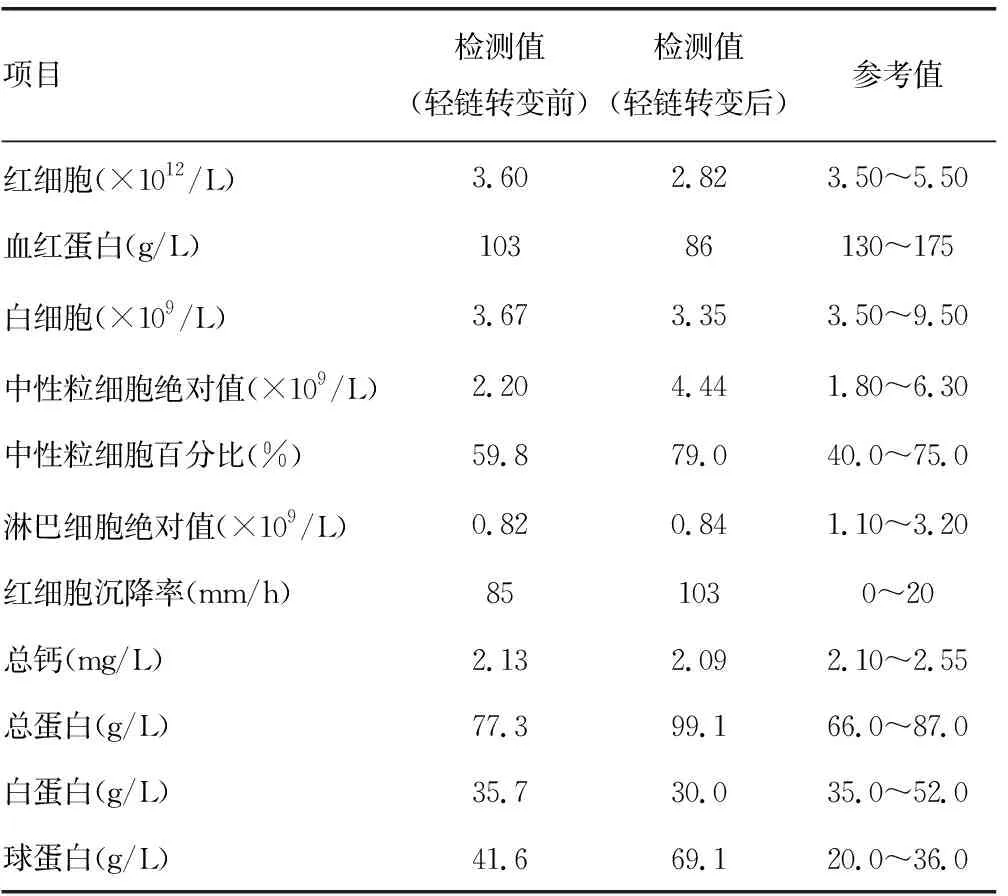
表1 常规检查结果
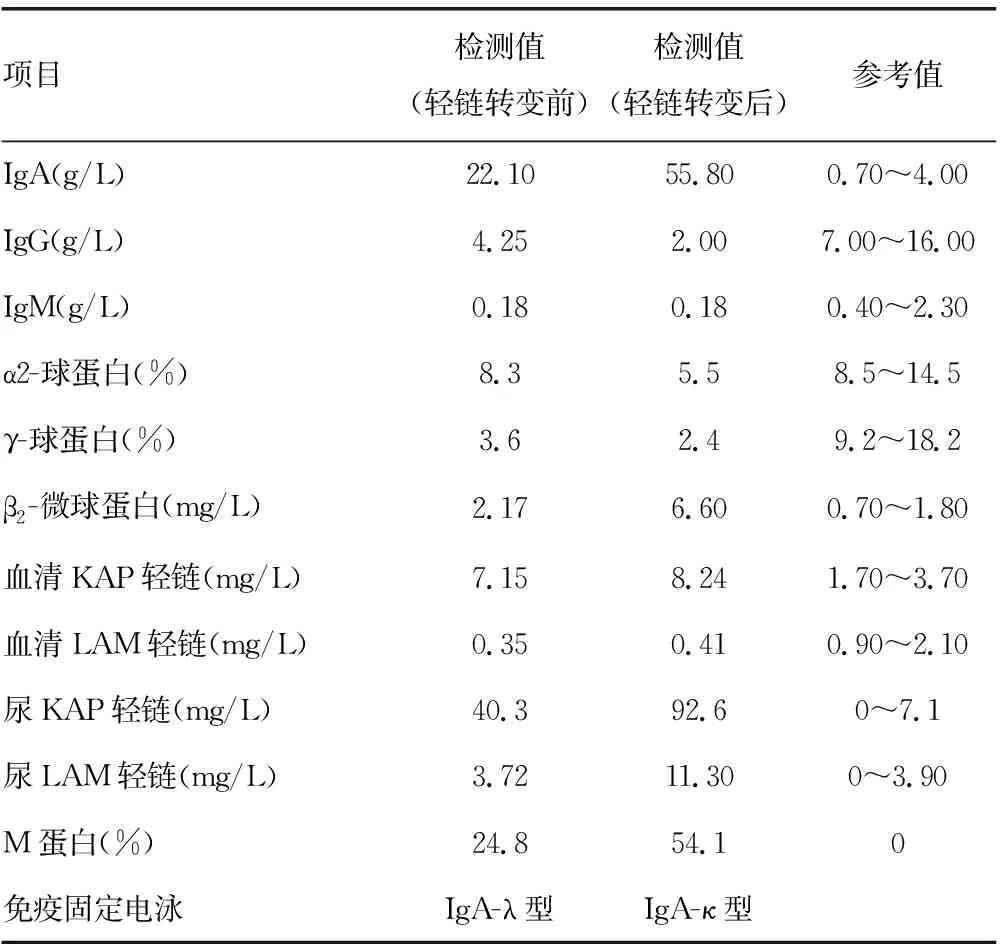
表2 血清体液免疫检查结果
骨髓细胞学检查:骨髓瘤细胞35.50%。流式细胞术:异带细胞群约占有核细胞的32.46%,表达cKappa,部分表达CD138,弱表达CD27,不表达CD19、CD45、CD117、CD56、CD200、CD20、CD81、cLambda,符合浆细胞肿瘤表型。
FISH检测:CDND1/IGH隔合基因阴性,1号染色体相关CKS1B基因扩增阳性; IGH基因重排阴性,部分细胞可见3~4个IGH基因信号;IGH/FGFR3融合基因阴性;IGH/MAF融合基因阴性;IGH / MAFB融合基因阴性,部分细胞可见3个MAFB和3~4个GH基因信号,TP53基因缺失阴性,部分细胞可见4个P53和CEP17基因信号;RB-1基因未见异常。
头部CT:符合双侧基底节区腔隙灶、脑部白质疏松CT体现。头MRI+MRA:脑内多发腔隙灶表现;符合老年脑、脑白质疏松MRI表现;符合脑动脉硬化MRI表现。
1.3诊疗经过 综合以上检查结果,患者确诊为IgA-κ型MM。行“PCD方案”化疗1.25周期,2019年1月于天津血液病研究所继续治疗,方案为“VTD”化疗0.75周期,一般状况良好。2019年2月入本院行第3周期治疗,方案为“VTD”。 3月11日出院,出院后患者继续服用阿昔洛韦、来那度胺、司匹林、雷贝拉唑、骨化三醇、碳酸钙等药物,无明显不适。3月15日返院行第4周期第3次万珂化疗,3月18日行第4周期第4次万珂化疗,3月28日行第5周期第1次万珂化疗,4月10日行第5周期第2次万珂化疗,4月17日行第5周期第3次万珂化疗,4月20日行第5周期第4次万珂化疗,当天出院。6月12日入院后予以唑来膦酸抑制骨质破坏,当天出院。定期复查血清免疫固定电泳,结果显示:2019年8月23日至11月30日患者结果持续无异常;2019年12月13日至2020年7月13日免疫固定电泳显示为IgG-λ型;之后至今免疫固定电泳结果持续无异常。
2 讨 论
MM的显著特征是异常浆细胞的克隆性增生导致全身性骨髓受累[4],好发于中老年人[5],特点是血清中出现克隆性蛋白、骨骼溶骨性破坏、病理性骨折、骨痛、高钙血症、贫血等[1-2]。根据MM分泌的Ig类型不同可分为以下类型:IgA、IgG、IgM、IgD、IgE、轻链型。轻链型又分为κ、λ型。IgG最常见,其次为IgA。目前MM的病因尚不完全清楚,最常见的是Ig重链区(14号染色体长臂上),骨髓内的肿瘤细胞由一群非恶性间质细胞支持,这些间质细胞产生细胞因子,如白细胞介素-6(IL-6)可促进骨髓瘤细胞生长并防止细胞凋亡。在浆细胞病中,MM早期临床症状不一,没有特异性,误诊率比较高[6]。本例患者为老年男性,腰部疼痛、胸腰椎压缩性骨折、贫血等均提示可能存在浆细胞疾病。通过骨髓穿刺细胞学及流式细胞学、血清蛋白电泳与免疫固定电泳等检查,诊断明确。遂进行PCD或VTD方案的化疗,经过5个疗程,化疗结果不满意,骨髓活检显示骨髓瘤细胞比例仍旧较高。在化疗的过程中复查免疫固定电泳为IgA-κ型,经过5个疗程的化疗后结果无异常持续3个月,随后出现低比例的IgG-λ型单克隆蛋白,持续约7个月。
2014年,国际骨髓瘤工作组(IMWG)修订了MM的诊断标准,允许使用特定的生物标记物和现代成像工具来诊断MM,并阐明其他几个诊断要求:MM的诊断需要在骨髓检查中有超过10%的克隆浆细胞,或活检证实的浆细胞瘤,或一个或多个恶性肿瘤的生物标记物。本例患者行骨髓细胞学检查发现骨髓瘤细胞35.5%,表达浆细胞肿瘤表型基因。目前,MM的发病机制并不完全清楚,可能与基因的不稳定性[4,7]、早期遗传学的改变、细胞因子(IL-6[8]、TNF-α)与骨髓微环境(黏附分子与细胞外基质)的作用相关[9]。近年来,陆续发现MM经常出现双克隆的骨髓瘤细胞,病例多表现为初诊时免疫固定电泳发现两种M蛋白[10-13]。本例患者与此略有不同,初诊时为典型高比例的IgA-κ型M蛋白,总IgG的含量极低,这并不能完全排除发病初期该患者是双克隆性MM。这可能与IgA-κ型异常克隆的骨髓瘤细胞大量增殖,抑制了其他Ig的分泌有关[14],治疗后IgA-κ型的骨髓瘤细胞被清除,IgG-Lambad型亚克隆才显现,出现一过性的IgG-λ型转变。经过规律化疗后IgG-λ型也消失。有报道指出50岁以上老年人存在3%的MGUS[15];本例患者也可能存在IgG-λ型MGUS与IgA-κ型M蛋白共存的情况,后者经化疗被抑制后前者显现出来。究竟一过性克隆型变化的原因是什么,尚有待于进一步探讨,还需要更多的病例资料来评估。

