干燥综合征伴肺动脉干巨大血栓短期自溶1例
周 洋
(河北燕达医院重症医学科,河北 廊坊 065201)
肺栓塞是以各种栓子阻塞肺动脉或其分支为其发病原因的一组疾病或临床综合征的总称,其中肺血栓栓塞症(pulmonary thromboembolism,PTE)为肺栓塞最常见类型[1]。肺主动脉干肺栓塞可造成大面积肺栓塞及血流动力学改变而导致休克。干燥综合征(sjogren’s syndrome,SS)可累及多系统,肺部受累是SS的常见和严重并发症[2],自身免疫性疾病是PTE的重要诱发因素。现报道SS合并肺动脉干巨大血栓栓子短期自溶病例1例,并结合相关文献进行分析。
1 临床资料
患者,男,37岁,主因“背痛伴喘憋7 d,加重2 d”于2021年1月11日就诊。入院7 d前无明显诱因出现背痛,范围局限于双侧肩胛间,喘憋进行性加重2 d至本院急诊,入室血压90/54 mm Hg(1 mm Hg=0.133 kPa),指尖血氧饱和度 94%,急诊完善心脏超声:主肺动脉内可见范围5.4 cm×3.0 cm低回声影漂浮,内血流信号充盈缺损(图1);三尖瓣反流长度法(TI)估测肺动脉压:99 mm Hg;右心增大,左室短轴切面呈“D”形改变,三尖瓣反流(中-重度)。双下肢静脉超声提示无血栓形成。急诊凝血、血小板检查见表1,肝功能检查见表2。血气分析:pH酸碱度7.425,氧分压 114.8 mm Hg,全血剩余碱(BE) -3.3 mmol/L,乳酸 2.6 mmol/L。收入重症监护病房。既往2012年间断出现呼吸困难,诊断为“肺间质纤维化,SS”。给予“泼尼龙、环磷酰胺、吡非尼酮(具体不详)”抗炎,调节免疫,改善肺纤维化治疗,2017年自行停药,后未规律治疗。入本科室后给予绝对卧床、鼻导管3 L/min吸氧,查体:体温36.8℃,心率83次/分,呼吸23次/分,血压123/80 mmHg,指尖血氧饱和度100%,喘息状,意识清楚,言语尚流利,咳痰可见血丝,口腔、鼻腔无黏膜出血,无口干、眼干,无腮腺肿大,无龋齿,无皮疹,双肺呼吸音粗,双肺可闻及散在湿啰音,肺血管杂音,P2亢进,三尖瓣收缩期杂音明显,右上肢前壁桡侧肿胀,触痛明显,尿色无异常,神经查体阴性。入院初步诊断:肺栓塞、肺动脉高压、SS、凝血功能异常、肝功能衰竭。
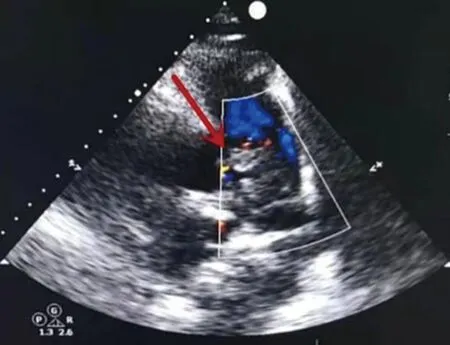
图1 心脏B超检查
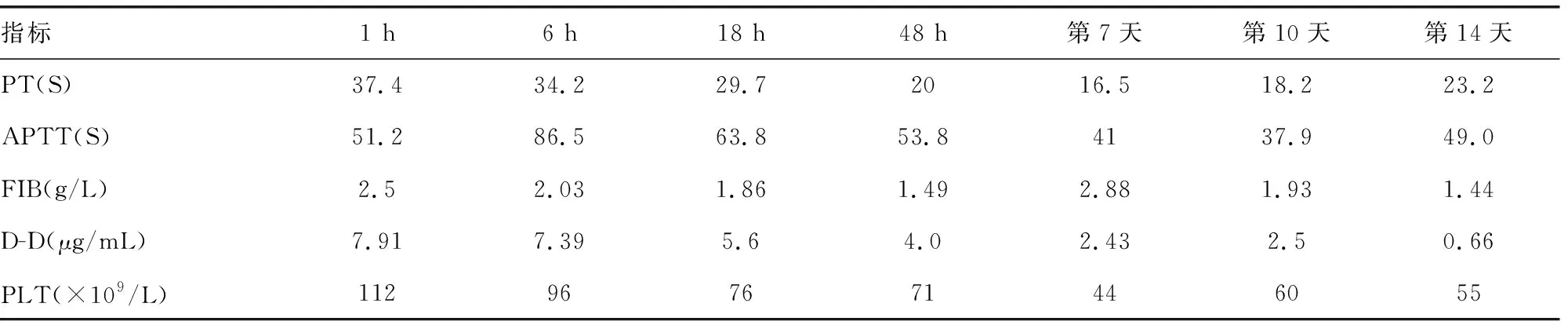
表1 患者入院各时间点凝血功能及血小板的变化
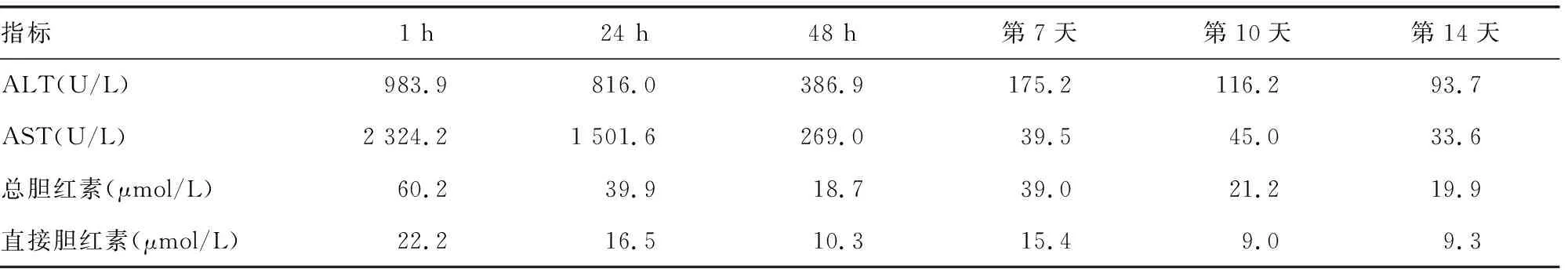
表2 患者入院各时间点肝功能的变化
评估出血风险:凝血酶原时间(PT)延长3倍余、活化部分凝血活酶时间(APTT)延长2倍余,且痰液可见血丝,考虑溶栓治疗出血风险较一般人群明显增高,介入治疗可解除肺动脉干巨大血栓梗阻,可能造成血栓崩解后远端二次栓塞且介入手术过程出血风险高。现血压、血氧饱和度暂时稳定,经讨论后给予低分子量肝素100 IU/kg每12小时1次抗凝治疗,同时给予丁二磺酸腺苷蛋氨酸、异甘草酸镁、谷胱甘肽保肝治疗,监测凝血、血流动力学、氧饱和度变化。入院6 h监测凝血功能。入院8 h后给予完善胸部CT血管造影(CTA)提示:两肺下叶背段及后基底段远端小动脉充盈不佳,伴邻近肺组织磨玻璃样改变,符合肺栓塞;未见肺主动脉内栓子等血管内占位(图2)。考虑患者肺主动脉内巨大血栓自溶。入院12 h复查心脏超声:TI估测肺动脉压60 mmHg;主肺动脉内异常信号消失,左室短轴切面“D”形改变消失,三尖瓣反流(中-重度)。入院18 h监测凝血功能,给予调整抗凝治疗为利伐沙班片 15 mg口服,2次/天。入院7 d血小板进行性降低给予输注2个治疗量血小板治疗。针对SS增加甲泼尼龙琥珀酸钠40 mg静脉滴注,1次/天调节免疫治疗。入院10 d一般情况平稳,转入风湿免疫科继续治疗:联合硫酸羟氯喹0.2 g、环孢素软胶囊100 mg,口服2次/天调节免疫治疗,静脉滴注人免疫球蛋白(PH4)10 g,连续5 d,共计50 g封闭抗体。入院后动态监测各时间点凝血功能、血小板及肝功能,见表1、2。期间动态复查心脏超声提示肺动脉压逐步下降,于入院20 d后降至正常压力范围,心包积液减少至4 mm,利伐沙班片调整为10 mg口服1次/天。出院3、6个月随访无特殊。
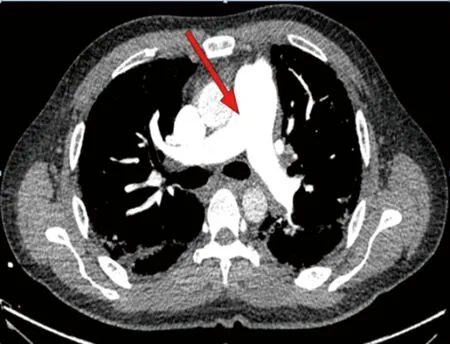
图2 肺CTA
2 讨 论
自身免疫性疾病是静脉血栓栓塞症的重要危险因素,CHUNG等[3]随访中国台湾8 920例SS患者后发现,其发生急性肺栓塞风险是健康人群的3.29倍。SS合并急性肺栓塞病例在祖国大陆临床报道中少见,尤以急性肺栓塞为首发症状更易漏诊[4]。此SS病例既往存在肺间质纤维化,尚无肺动脉高压形成,确诊初期服用激素类、抗免疫类药物,近3年已完全停药,无其他活动性进展。入院前7 d首发症状背痛,考虑肺动脉血栓已形成。肺栓塞可分为大面积肺栓塞和非大面积肺栓塞,大面积肺栓塞伴有明显全身性血流动力学改变,易造成严重肺动脉高压及梗阻性休克;非大面积栓塞不伴有全身性血流动力学改变,可合并右心室功能障碍或心肌损伤。本例患者符合大面积栓塞,考虑肝功能衰竭是由急性肺栓塞致血流动力学改变肝脏缺血低灌注所致,肝功能衰竭致使凝血功能异常由高凝状态转变为低凝状态。栓塞形成后的缺血激发机体纤溶系统应答,导致动态监测凝血纤维蛋白原逐步降低,纤维蛋白降解产物(FDP)、D-二聚体均呈较高水平。
目前临床上有效治疗急性肺栓塞的诊疗方案主要包括溶栓治疗、 抗凝治疗和改善血流动力学及呼吸治疗[5]。阿替普酶作为国内外治疗效果较理想的溶栓药物,近年来其临床应用较广泛[6]。急性高危PTE或伴有临床恶化的中危PTE,若有主动脉干或主要分支血栓,并存在高出血风险或溶栓禁忌,经溶栓或积极的内科治疗无效,在具备条件下可进行经皮导管介入治疗[1]。介入血管腔内治疗是包括抽吸取栓、导管机械取栓、碎栓及经导管局部溶栓的综合治疗手段。本病例高度低凝状态、纤溶系统应答,已出现痰中带血,溶栓治疗出血风险极高,入院后监测生命体征暂无明显血压、血氧饱和度下降,介入治疗可暂时在内科治疗下备用。故本例患者给予低分子量肝素100 IU/kg抗凝治疗。短期完善进一步血管影像学检查,入院8 h肺部CTA可见肺主动脉干内血栓消失,部分远端肺动脉仅可见血栓栓塞。提示肺动脉干巨大血栓短期内自溶。
国内报道血栓自溶现象以冠状动脉血栓栓塞为主[7-9],其他动脉血栓栓塞自溶现象少见,SS合并肺动脉巨大血栓自溶罕见,二者多考虑因不同血管环境致血栓形成,而其血栓溶解机制相似。自溶机制的因素主要分为内源性及外源性两部分,内源性机制以纤溶系统应答为主,属细胞外基质降解系统。有研究表明,短暂的缺血发作为间接内源溶解机制,其机制为增强重组纤溶酶原诱发的冠状动脉血栓溶解,提高自溶概率,属继发性纤溶应答[10]。外源性部分多为多支病变、侧支循环形成、糖尿病血管损伤等叠加时间因素作用于血栓承载的负荷,使血栓瞬间剪切力发生变化而影响自溶。本病例结果显示,血栓的短期自溶受两部分因素同时作用:纤溶系统及缺血发作使内源性溶解机制迅速启动;多种外源性溶解机制参与:SS患者自身免疫性疾病致血管损伤,肺部间质纤维化所致的相关血流动力学改变,巨大血栓形成后肺动脉血流动力学的二次改变机制等。
综上所述,在临床诊疗中,对于SS患者肺部病变与肺栓塞的鉴别应谨慎,特别是合并肺动脉高压的患者;纤溶系统应答、低凝状态患者溶栓治疗应全面评估病情及禁忌证,谨慎进行;血栓自溶在冠状动脉病例中多见,而PTE患者少有研究与报道,其未合并生命体征紊乱时可尝试评估自溶风险,目前无法预测血栓自溶概率及绝对条件,抗凝、溶栓及介入等仍是目前主要治疗手段。对于血栓自溶有待临床进一步研究。

