TRIM19泛素化IGF2BP3对卵巢癌细胞增殖及迁移的影响
王琪 廖振蓉 罗德平 余瑛 李荣 (赣州市肿瘤医院,江西 赣州 341000)
卵巢癌是发生在女性生殖器官的一种常见恶性肿瘤〔1〕,具有极高的死亡率,对女性生命具有极大的威胁〔2〕,病症发生在盆腔深处,较为隐匿,且体积较小,无典型症状,因而早期较难发现〔3〕。而泛素化作为一种翻译后可进行特异性修饰的过程〔4〕,对细胞的多种进程都具有调控作用,比如细胞的增殖、凋亡、周期等〔5〕。三方基序蛋白(TRIM)蛋白家族拥有进化保守的结构域〔6〕,被定义为细胞生物学中的一种关键调控子〔7〕,其对细胞的增殖、凋亡、免疫、迁移等生物学功能都具有一定的调节功能〔8〕。目前已有研究显示TRIM3、TRIM16、TRIM21等在实体瘤中的功能〔9〕,但TRIM19对肿瘤的作用还未有报道,本研究就其对卵巢癌细胞的影响进行探究。
1 材料与方法
1.1实验材料 卵巢癌细胞系 SKOV3(中国科学院细胞库,hce-0155),胎牛血清、DMEM培养液、双抗(含100 U/ml青霉素及链霉素)、0.25%胰蛋白酶(美国Gibco公司),MTT检测试剂盒(上海酶联生物),Transwell小室(北京萌壮科技有限公司),pmirGLO载体(北京华越洋生物),转染试剂:LipofectamineTM2000(北京科展生物科技有限公司),胰岛素样生长因子-2 mRNA结合蛋白(IGF2BP)3质粒(上海羽朵生物,BAS6784),TRIM19质粒(山东维真生物,CH849963)。
1.2细胞培养 将细胞系SKOV3在含有10%胎牛血清的DMEM培养液中进行培养,培养条件控制为37℃、5%CO2,恒温培养箱中培养,2 d间隔更换1次培养液,3~5 d时使用0.25%的胰蛋白酶进行消化传代,当细胞培养至3~5代且处于对数生长期时进行收集以继续后续实验。
1.3细胞转染 将卵巢癌SKOV3细胞分为对照组、过表达TRIM19组(转染 TRIM19)、敲减TRIM19 组(转染TRIM19-inhibitor),另对TRIM19与IGF2BP3进行共转染。当细胞生长至融合度为70%~80%时,将其接种到细胞瓶中,按照LipofectamineTM2000试剂说明书进行转染。通过RT-PCR检测转染效率,转染成功即可用于后续实验。
1.4Western印迹检测IGF2BP3的表达 十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)收集转染后SKOV3细胞中的总蛋白,通过BCA 法对蛋白总量进行测定,聚偏氟乙烯(PVDF)膜进行2 h的转膜,加入5%的脱脂奶粉密封1 h,后加入一抗(稀释比例均1∶1 000),4℃下孵育过夜。TBST洗涤,去除非结合抗体,然后添加辣根过氧化物酶(HRP)标记二抗,室温下孵育2 h。洗涤后加入显色剂进行显影。最后用凝胶成像软件分析,得出表达结果。
1.5免疫共沉淀检测泛素化情况 将卵巢癌SKOV3细胞分为A组(转染HIS-TRIM19和MYC-IGF2BP3)、B组(转染空载体)、C组(转染HIS-TRIM19)、D组(转染HIS-TRIM19)、E组(转染HIS-TRIM19和HA-UB)、F组(转染HA-UB)、G组(转染HIS-TRIM19)、H组(转染HIS-TRIM19和HA-UB)、I组(转染HA-UB),当细胞生长至融合度为70%~80% 时,将其接种到细胞瓶中,按照LipofectamineTM2000试剂说明书进行转染。将含目的基因的质粒与脂质体混合静止约20 min后,缓缓滴入SKOV3细胞。通过RT-PCR检测转染效率,转染成功即可用于后续实验。按比例加入抗体(1∶200)孵育,加入蛋白A/G琼脂糖珠进行孵育,洗涤。进行蛋白质变性后,在3 000 r/min,4℃的条件下进行离心。转移上清液至新管,加入适量一抗,于振荡器上缓缓振荡过夜,免疫共沉淀孵育后,用HA抗体去免疫沉淀,进行SDS-PAGE,以β-actin作为内参蛋白,从而得出结果。
1.6噻唑蓝(MTT)实验检测细胞的增殖情况 将转染的各组SKOV3细胞接种到96孔板上,每孔100 μl,培养箱中培养,并且在培养结束之前的4 h加入20 μl MTT溶液(5 g/L)贴壁后进行收集,时间点分别是0 h、24 h、48 h、72 h,最终通过酶标仪来检测其A490值。
1.7Transwell检测SKOV3细胞的迁移情况 使用培养基对各组细胞进行重悬,调整密度至2×105个/ml,接种至Transwell小室的上室,在下室加入培养基,后在培养箱中培养1 d,培养后将细胞用磷酸盐缓冲液(PBS)冲洗3次,擦净上室表面,90%无水乙醇中固定后使用结晶紫染色,显微镜下观察计数细胞个数。
1.8统计学分析 采用SPSS24.0软件进行单因素方差分析、t检验、F检验。
2 结 果
2.1过表达 TRIM19 对卵巢癌细胞增殖的影响 与对照组及敲减TRIM19组相比,过表达 TRIM19组48、72 h的细胞活力显著下降(P<0.05),与对照组相比,敲减TRIM19 组的细胞活力显著上升(P<0.05)。见表1。
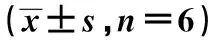
表1 各组卵巢癌细胞不同时间的细胞活力
2.2过表达TRIM19对卵巢癌细胞迁移的影响 与对照组〔(156.42±18.43)个〕及敲减TRIM19组〔(211.57±19.24)个〕相比,过表达TRIM19组细胞的迁移能力显著下降〔(97.68±16.51)个,P<0.05〕,敲减TRIM19组与对照组相比迁移能力显著上升(P<0.05)。见图1。
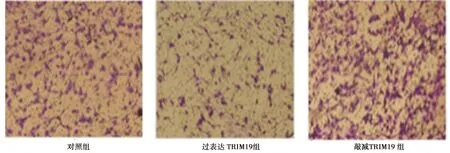
图1 各组卵巢癌细胞的迁移情况(结晶紫染色,×200)
2.3TRIM19对IGF2BP3表达量的影响 如图2所示,与对照组(0.82±0.05)相比,过表达TRIM19组内源IGF2BP3的表达量显著减少(0.51±0.03,P<0.05),敲减TRIM19组内源IGF2BP3的表达量显著上升(1.09±0.06,P<0.05)。
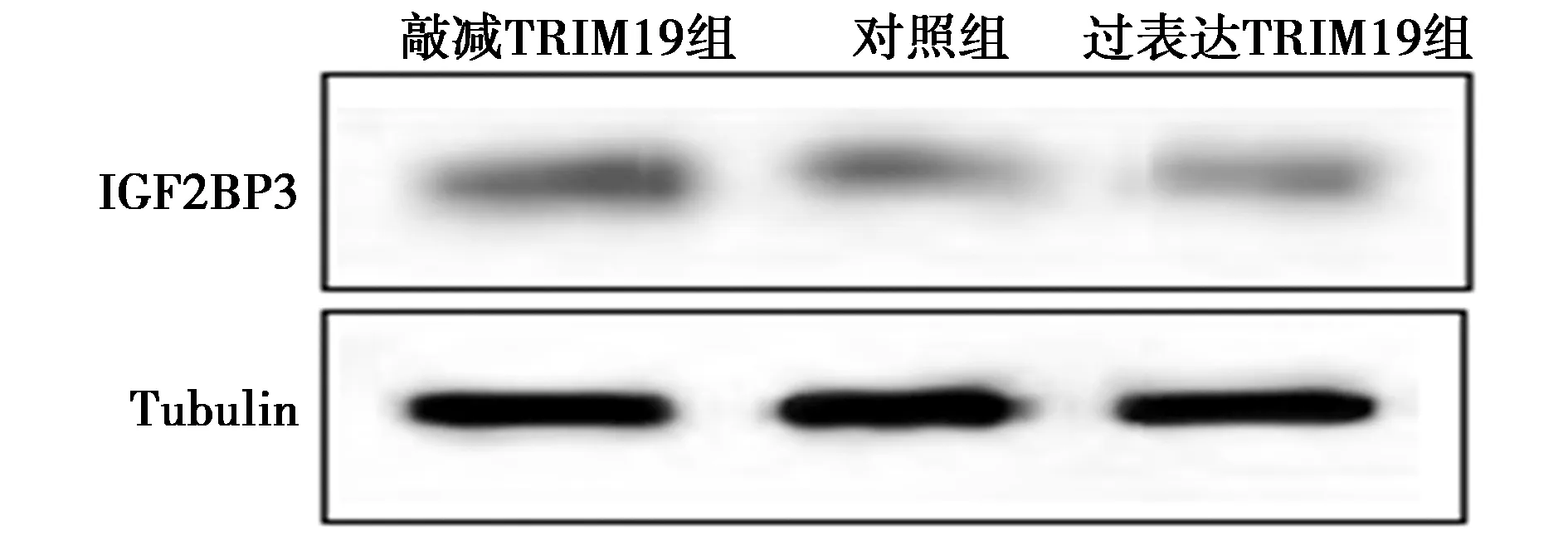
图2 各组细胞IGF2BP3的表达
2.4TRIM19与IGF2BP3之间的相互作用 如图3所示,在仅转染TRIM19及空载体中无法检测到TRIM19的存在,而当HIS标记的TRIM19(HIS-TRIM19)与MYC标记的IGF2BP3(MYC-IGF2BP3)共转染时可以检测到HIS-TRIM19的存在,提示TRIM19与IGF2BP3之间存在一定的相互作用。

图3 TRIM19与IGF2BP3之间的相互作用
2.5过表达 TRIM19 对IGF2BP3 泛素化程度的影响 如图4所示,过表达TRIM19后会使免疫沉淀后的IGF2BP3多聚泛素化链有所增加,表明过表达TRIM19可增加IGF2BP3的泛素化程度。


图4 过表达 TRIM19 对IGF2BP3 泛素化程度的影响
3 讨 论
卵巢癌具有早期症状隐匿、侵袭能力强、恶性程度高等特点〔10,11〕,其发生与内分泌紊乱、精神压力大、年龄等因素具有紧密的联系〔12〕。而其增殖转移对患者的临床疗效、预后等都具有较大的影响〔13〕,因而对其增殖及迁移的影响因素进行研究就极为必要。
泛素化过程中,泛素分子介导的信号传导在癌细胞中会有所改变〔14〕。部分肿瘤抑制因子及癌基因同泛素-蛋白酶体途径之间具有相互作用,并在泛素缀合及解耦联之间起到一定作用,与肿瘤的发生进展具有一定的联系〔15〕。TRIM19又称为PML,是TRIM家族的成员之一,几乎在所有可被检测到的细胞系中都有所表达,定位于细胞核中〔16〕,有研究证明,其含有视黄酸受体(RAR)α,对于细胞防御具有一定的参与作用〔17〕。IGF2BP3又称为IMP3,是一种可以对胰岛素生长因子2及癌胚RNA进行调控的结合蛋白,在肺癌、乳腺癌、肾癌中呈高表达状态,而在正常组织呈现低表达的状态〔18,19〕。如王瑾等〔20〕在了解相关蛇鳞状细胞癌及miR-299-3p的研究进展基础上,对此细胞癌发展的相关机制进行研究,最终得出miR-299-3p对TRIM27具有靶向下调的作用,对蛇鳞状细胞癌的迁移、增殖及侵袭具有一定的抑制作用。除此之外TRIM3、TRIM16、TRIM21等与癌症进展的相关性均有所研究。
本研究结果提示,TRIM19与IGF2BP3之间具有相互作用,TRIM19会对IGF2BP3进行泛素化修饰;过表达TRIM19会增加IGF2BP3的泛素化程度。蛋白质泛素化是真核生物调控各个生物过程的翻译后修饰过程,并且相关研究表明这种过程也会对癌基因蛋白产物及肿瘤抑制蛋白进行调节〔21〕。本研究结果提示,过表达TRIM19可能可以抑制卵巢癌细胞的增殖能力;过表达TRIM19可能可以抑制卵巢癌细胞的迁移能力。
综上,TRIM19可增加IGF2BP3的泛素化程度,从而抑制卵巢癌细胞的增殖及迁移。但由于研究规模及时间的限制,其表达模式未进行探索,仍需扩大研究规模进一步探索。

