脂多糖抑制海马神经前体细胞增殖
梁倩 高虹 李海
(1广西医科大学附属武鸣医院,广西 南宁 530100;2宁波卫生职业技术学院医学技术学院基础医学教研室;3右江民族医学院组织学与胚胎学教研室)
人和大多数哺乳动物的部分脑区产生新神经元的过程谓之神经发生〔1〕,海马齿状回(DG)的颗粒下层是目前研究最多的神经发生区之一。研究表明,外周注射脂多糖(LPS)抑制DG区海马的神经发生〔2~4〕。但是,LPS抑制DG区海马神经发生的机制却鲜有报道,本研究拟从在离体和体内水平观察LPS对海马DG神经发生的影响,一方面原代培养海马神经前体(NPCs)细胞,镜下观察神经球减少的数目,另外在体水平上大鼠腹腔注射LPS,用5溴脱氧尿嘧啶(BrdU)标记DG区的增殖细胞、双皮质醇(DCX)标记神经元、胶质纤维酸性蛋白(GFAP)标记星形胶质细胞、钙接头蛋白分子(Iba1)标记小胶质细胞变化的数目以追踪观察这些细胞的存活和分化状况,探讨增殖细胞减少的可能机制。
1 材料与方法
1.1实验动物及分组 48只少年期雄性SD 大鼠,体重100~200 g,由右江民族医学院实验动物中心提供。随机分成实验组(LPS组,n=30)、生理盐水对照组(NS组,n=18),按腹腔注射LPS和BrdU的先后时间,实验组分为:①先注射LPS后BrdU标记(下简称先LPS后BrdU)组;②先Brdu标记后注射LPS(下简称先BrdU后LPS)组;③仅注射LPS组。对照组分为④先注射生理盐水(NS)后BrdU标记(下简称先NS后BrdU)组;⑤先BrdU标记后注射NS(下简称先BrdU后NS)组;⑥仅注射NS组。每组分1、3、5、7 d四个时程。
1.2主要试剂 DMEM/F12培养基、B27(Gibco公司);表皮生长因子(EGF)、多聚赖氨酸、LPS、BrdU、BrdU抗体(Sigma公司);钙接头蛋白分子(Iba-1)抗体、胶质纤维酸性蛋白(GFAP)抗体、双皮质醇(DCX)抗体、神经上皮干细胞蛋白(Nestin)抗体、Toll样受体(TLR)4抗体(Abcam公司)。
1.3LPS诱发炎症 NS组与LPS组均分别进行腹腔注射NS或LPS 1.0 mg/kg (溶于无菌生理盐水),观察LPS诱导的炎症对NPCs存活与分化的影响和小胶质细胞的影响。
1.4大鼠发育变化观察 腹腔注射生理盐水或LPS前3天开始,每天用电子天平称量大鼠体重,连续观察9 d。
1.5BadU标记 NS组与LPS组均分别行腹腔注射NS或LPS后第1、3、5、7天进行BrdU 200 mg/kg (溶于无菌生理盐水)2 h,后于相应的时间点分别处死动物。
1.6组织切片制备 动物麻醉后,依次用(0.01 mol/L)PBS和4%多聚甲醛溶液(PFA)灌流,断头取脑,将脑组织置于4% PFA 中后固定6~8 h后,转移到20%的蔗糖溶液中4℃过夜至脑块自然下沉。冰冻切片,自前囟后2.3 mm把含有齿状回的海马部分做连续冠状切片,片厚40 μm,每6张切片取1张用于免疫组织化学染色。
1.7NPCs的分离和培养沿用本实验室分离和培养NSCs的方法,将新生SD大鼠(0~2 d)置于75%的乙醇中浸泡消毒1~2 min后断头取脑,在超净台内用4℃平衡盐溶液(HEBSS)洗两次。在解剖显微镜下剥离脑膜和血管,切取海马组织块,制成单细胞悬液。1 000 r/min离心5 min,去除上清液,加入培养基(1∶1 DMEM/F12,2%B27),添加EGF 20 ng/ml,调整细胞密度为1×105个/ml,接种于25 cm2培养瓶内,在CO2培养箱悬浮培养。以后每3 d半量换液一次,并添加新鲜的EGF。细胞培养5~7 d后形成原代神经球。将原代神经球机械分离制成单细胞悬液,再培养5~7 d形成次代神经球。取次代神经球进行实验。
1.8免疫组织化学和免疫荧光染色
1.8.1BrdU免疫组织化学 冰冻切片经2 mol/L盐酸(37℃,30 min) 变性、0.1%胰酶(37℃,20 min)消化后,2%~3%的BSA室温封闭30 min,弃液后直接加入小鼠抗BrdU单克隆抗体(1∶200)室温孵育20 h,加入生物素化的羊抗鼠二抗IgG(1∶200),室温孵育2 h,随后加入ABC(1∶200)室温下孵育2 h,最后将切片放入含终浓度为0.03%过氧化氢的0.05%二氨基联苯胺(DAB)溶液中显色5~8 min,用磷酸盐缓冲液(PBS)终止显色。各步骤间均用0.01 mol/L PBS漂洗3次。常规贴片,风干,乙醇梯度脱水,二甲苯透明,中性树胶封片。
1.8.2BrdU和DCX或GFAP免疫荧光双标 冰冻切片同上进行变性、消化、封闭后,同时加入小鼠抗BrdU单克隆抗体(1∶200)和兔抗DCX多克隆抗体(1∶500),室温下共同孵育20 h,经PBS充分漂洗后同时加入Alexa Fluor 594标记的驴抗小鼠荧光二抗(1∶500)和Alexa Fluor 488标记的驴抗兔荧光二抗(1∶500),避光、室温下共同孵育2 h,PBS漂洗后用50%缓冲甘油封片,在共聚焦显微镜下观察阳性细胞的表达并拍照。
1.8.3TLR4、Iba1免疫组织化学染色冰冻切片至室温后放入3%过氧化氢,避光 30 min;PBS清洗后,加兔抗TLR4抗体(1∶200)、羊抗Iba1(1∶1 000)孵育,4℃过夜。次日复温和清洗3次后加入滴加荧光二抗,室温避光孵育2 h,封片剂封片。
1.8.4Nestin、TLR4免疫细胞化学染色检测将次代神经球移至PLL包被的24孔培养板内继续培养4 h后吸去培养液用4%多聚甲醛固定15 min 0.01 mol/L PBS(pH7.4)漂洗3遍加入1∶2 000的兔抗nestin单抗、兔抗TLR4抗体(1∶200)4℃孵育过夜,漂洗3遍后加入二抗(生物素标记羊抗兔IgG,1∶200),室温孵育2 h后,漂洗3遍后用DAB显色,梯度乙醇脱水,二甲苯透明后中性树脂封片。
1.9统计学方法 采用SPSS20.0软件进行t检验。
2 结 果
2.1LPS对大鼠体重的影响 NS组自给生理盐水前3 d开始,连续观察9 d其体重呈直线上升趋势。LPS组注射LPS 1 d体重突然减轻,第2天马上恢复至给药前水平,之后其体重平稳增长,见表1,体重增长曲线与NS组相平行。LPS诱发炎症7 d,大鼠日均体重生长较NS组低,差异有统计学意义(P<0.05),即大鼠受到LPS刺激后,其生长发育减慢。
表1 腹腔注射LPS对大鼠体重的影响
2.2LPS影响DG区小胶质细胞的形态变化 光学显微镜下发现,NS组DG区小胶质Iba1阳性细胞为纤细分支状,胞体小,具有伸向各个方向的细胞突起;LPS组腹腔注射LPS后第1天DG区小胶质Iba-1阳性细胞数量增多,细胞变为高分支状,表现为胞体变大,突起及其分支变短且增多、增长增粗,着色最深;随着诱发炎症时间的延长,实验组Iba1阳性细胞数逐渐减少,胞体缩小,突起变短变细,分支减少,着色渐渐变淡。见图1。

图1 LPS诱发炎症影响小胶质细胞的形态变化(免疫组化染色)
2.3LPS对海马DG颗粒下层(SGZ)区神经前体细胞增殖影响的时程变化 NS组1、3、5、7 d BrdU阳性细胞数目分别为(118.6±8.85)个,(107.4±9.5)个,(105.4±9.3)个,(106.3±11.4)个。LPS组注射后1 d,细胞数减少到(88.7±9.5)个;之后开始渐渐恢复,至第3天为(95.8±6.5)个;5、7 d,阳性细胞数目保持在正常水平为(106.7±6.2)个和(104.3±8.7)个。与NS组相比,LPS组BrdU免疫反应阳性细胞数第1天明显减少(P<0.05)。见图2。
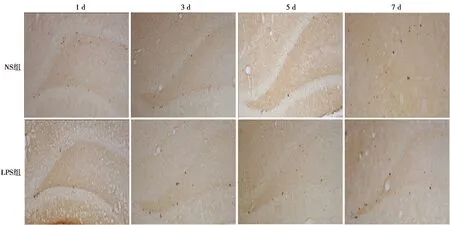
图2 两组注射后各时间点BrdU阳性细胞(免疫组化染色,×40)
2.4海马DG颗粒下层BrdU标记的细胞被LPS刺激持续刺激7 d其增殖和分化 注射LPS 2 h后再注射BrdU 7 d,与NS组相比,LPS组BrdU阳性细胞数显著减少(P<0.05)。见表2、图3、图4。
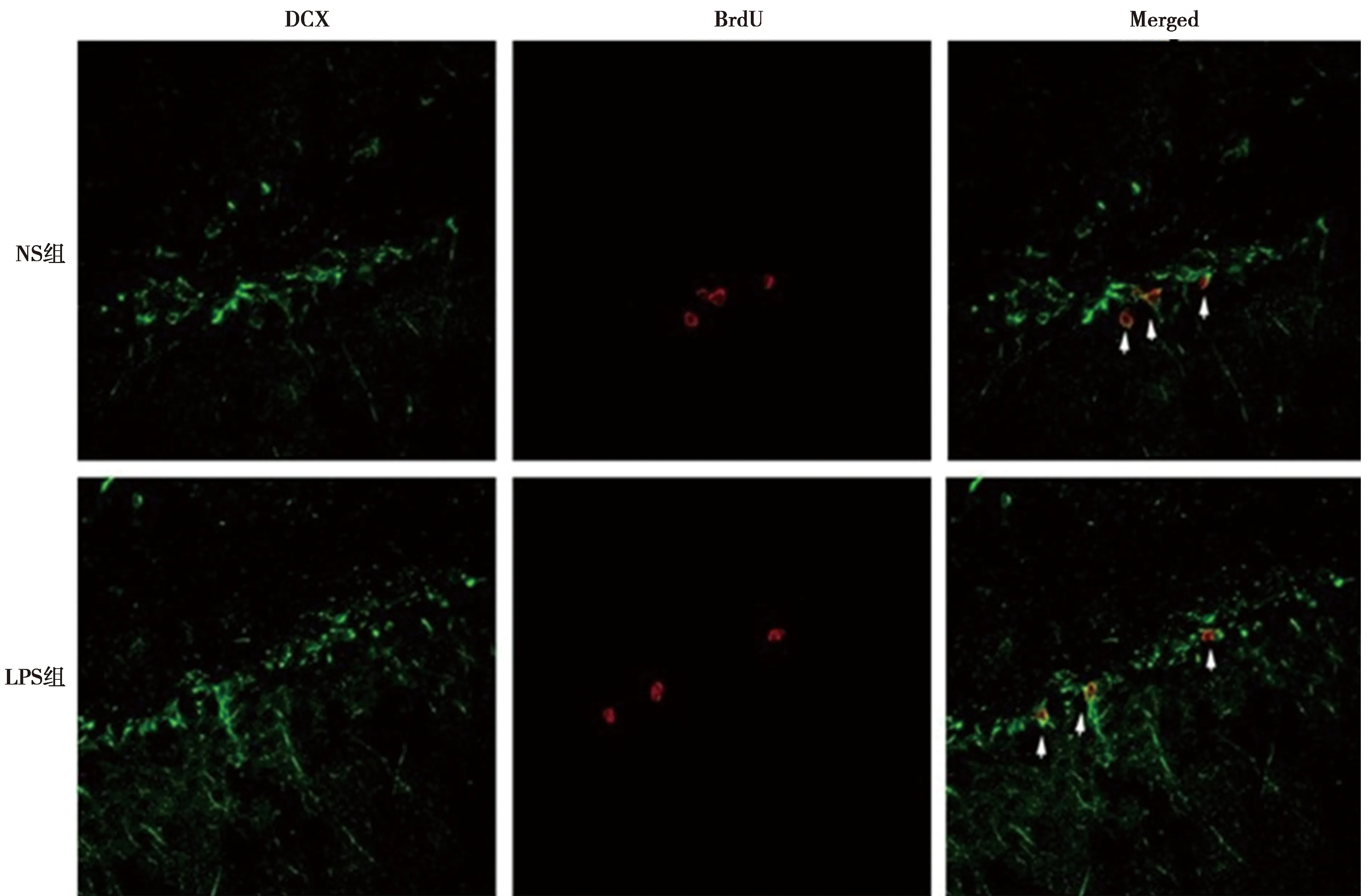
图3 海马DG颗粒下层BrdU标记的细胞被LPS持续刺激7d,共聚焦结果显示DG区BrdU+/DCX+细胞的表达(免疫荧光双标,×200)
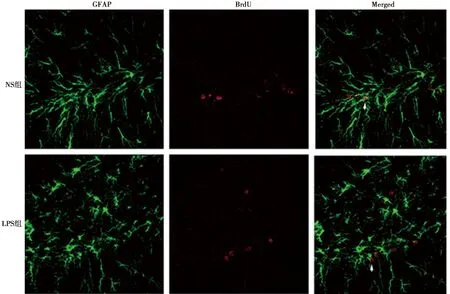
图4 海马DG颗粒下层BrdU标记的细胞被LPS持续刺激7 d,共聚焦结果显示DG区BrdU+/GFAP+细胞的表达(免疫荧光双标,×200)

表2 两组BrdU+细胞及共聚焦结果显示DG区BrdU+/DCX+细胞及BrdU+/GFAP+细胞的表达
2.5BrdU 和DCX、GFAP的共表达 免疫荧光双标结果显示,注射LPS 2 h后再注射BrdU 7 d,海马颗粒细胞层发现少量BrdU 和DCX、GFAP双阳性细胞,大多数的BrdU阳性细胞都表达DCX。NS组BrdU和DCX双标阳性细胞数为(84.8±5.4)%, BrdU和GFAP阳性细胞数为(3.7±0.7)%;LPS组BrdU和DCX双标阳性细胞数为(86.3±7.1)%,BrdU和GFAP阳性细胞数为(4.1±1.2)%;两组差异无统计学意义(P>0.05)。
2.6LPS的受体TLR4在神经干细胞/神经前体细胞上的表达 细胞免疫组化和组织免疫荧光的结果显示,离体培养的海马神经干细胞和大鼠海马DG颗粒细胞下层都发现TLR4阳性细胞,见图5。提示BrdU 阳性细胞数目的减少可能与LPS刺激引起的TLR4信号传导通路的激活有关。
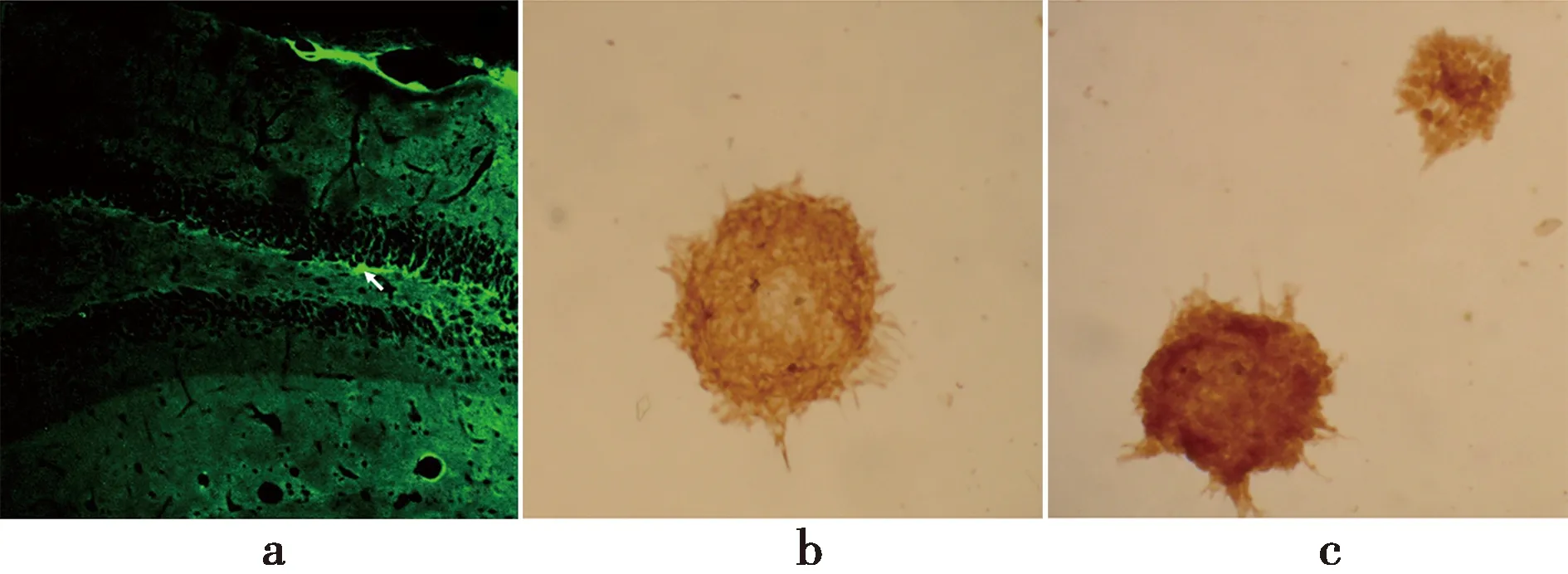
a:TLR4 在DG的表达(免疫荧光染色);b:神经球Nestin 的表达; c:神经球TLR4表达(免疫细胞化学染色)图5 TLR4在DG、原代培养神经球的表达(×200)
3 讨 论
传统的观念认为,中枢神经系统是一个能够逃离免疫监视的一个特殊区域。然而,近来的研究发现,内源性的NPCs在炎症反应和促进组织修复的退行性伤害过程中,NPCs调节自身的迁移和分化潜能〔5〕,激活的小胶质细胞提供的炎症信号和抗原特异性T细胞调控着胚胎CNS区域神经发生和胶质细胞的发生〔6~8〕。
本实验说明正常情况下,处于静止状态的小胶质细胞具有一定的迁移能力,在炎症激活过程中,小胶质细胞作为定居于大脑中的巨噬细胞,开始改变形态而被激活。在大脑的其他区域如:丘脑、皮层、海马没有观察到小胶质细胞的激活,说明DG区小胶质细胞的激活是特异性的。GFAP在形态和数目上并没有变化说明LPS并不诱导GFAP的激活,说明小胶质细胞是LPS优先选择的细胞目标。LPS诱导DG区小胶质细胞形态和数量的改变,说明海马DG区神经发生的环境已经发生改变。
BrdU 是一种合成性胸腺嘧啶类似物,它能在细胞分裂的DNA 合成期(S 期)有效地掺入DNA 中,使新生细胞可通过BrdU 免疫组织化学染色法显示。有研究报道,成年大鼠SGZ区神经前体细胞增殖周期为25 h,5、7 d处于有丝分裂后时期〔9〕,本实验说明,LPS对DG区前体细胞的作用仅仅发生在增殖阶段,LPS诱使BrdU阳性细胞数目的减少是急性的,短时间的。一些研究表明外周注射LPS 1 w以内,能够抑制DG的神经发生〔3,4〕,本研究表明内毒素能诱发快速的抑制效应,LPS注射24 h能显著抑制BrdU阳性细胞数目,另外注射LPS 2 h后再注射BrdU 7 d,海马DG颗粒下层BrdU标记的细胞被LPS刺激持续刺激7 d,BrdU阳性细胞数目显著减少也说明了这一点。这个结果与大鼠和猴一些心理应激的结果是一致的〔10,11〕。也不排除LPS诱导的炎症导致细胞死亡的可能性,有文献报道,BrdU阳性细胞的减少可能是因为新生细胞的死亡〔12〕。Bain等〔13〕证实急性应激减少大鼠BrdU阳性细胞数,而相同的应激却增加小鼠BrdU阳性细胞数。LPS已经被证实能够产生普遍的应激反应,如发热〔14〕、脑内细胞因子〔15,16〕的产生、下丘脑-垂体-肾上腺〔17,18〕的激活,下丘脑-垂体-性腺〔17,19〕的抑制,在大鼠和小鼠身上,LPS对BrdU阳性细胞的不同效应说明了LPS对神经发生种属特异性。
本实验结果说明,LPS诱导的急性炎症过程不能改变成年大鼠DG区新生神经前体细胞分化。然而,有研究发现LPS能抑制神经前体细胞向神经元的分化,但不改变其向GFAP分化的命运推测结果不同的原因有:①本实验仅注射1次BrdU(200 mg/kg),后者连续3次每隔8 h(200 mg/kg)或者8次每隔2 h(50 mg/kg)注射BrdU,海马神经发生是不断进行的持续过程,单次进行BrdU标记的细胞只能标记某个时间点的处于细胞分裂周期S期的细胞;多次BrdU标记能将持续进行细胞分裂和增殖的神经前体细胞标记。所以本实验BrdU阳性细胞数目少于其他研究结果。本实验结果与其他研究结果不一致可能来源于单次BrdU标记的阳性细胞数太少造成的结果不一致。②在小鼠上,另一方面,注射LPS 7 h内不影响BrdU阳性细胞数目,但是在7 h和28 d后能减少BrdU阳性细胞数〔20〕,本实验表明LPS诱发炎症效应在短短2 h内还不足以影响BrdU标记的神经前体细胞的分化走向,LPS诱发炎症效应对神经发生的抑制效用需要更长时间。也不排除不一致可能与LPS与BrdU在体内摄取效率不同有关。在啮齿动物成年海马神经发生区域的NPCs感受入侵的炎症代理(可能通过TLRs)调节自身的增殖和分化能力是目前研究的热点之一。了解炎症发应对NPCs的增殖和分化能力的影响有利于通过细胞移植治疗急性或慢性疾病。本实验结果说明TLR4可能调节着神经干/前体细胞上的神经发生。而在体的实验也同样发现在少年期正常大鼠DG区低表达TLR4。
综上,LPS诱导的炎症效应能够抑制神经前体细胞的增殖,但是并不影响新生的神经前体细胞分化。LPS的这种效应可能通过激活TLR4途径抑制神经前体细胞的增殖。TLRs不仅参与识别广泛的入侵分子(如细菌、真菌和病原体的微生物产品)同样监视着损伤和启动组织修复,可以设想NPCs同样参与保护大脑免受损伤的信号传导过程。

