新辅助用药帕妥珠单抗联合曲妥珠单抗在局部晚期、炎症性或早期her2阳性老年乳腺癌患者中有效性及安全性
魏松之 魏淑琴 李铂
(1南昌市第三医院肿瘤内科,江西 南昌 330006;2江西省肿瘤医院肿瘤内科;3南昌大学第四附属医院普外科)
人表皮生长因子受体(her)2是细胞生长和增殖的一种有效介质,是系统性乳腺癌(BC)治疗中仅次于雌激素受体的第二大靶点〔1,2〕。Her2基因的扩增和her2的相应过度表达发生在大约20%的乳腺肿瘤中,与不良预后相关〔3〕。目前,her2靶向治疗被认为是晚期和早期疾病的标准治疗〔4〕。人源化单克隆抗体曲妥珠单抗的分子靶向性,提高了转移性和早期her2阳性乳腺癌患者的无病生存率和总体生存率〔4,5〕。在新辅助治疗中,使用曲妥珠单抗为基础的方案治疗her2阳性乳腺癌患者达到了39%~45%的病理完全缓解(CR),但也有报道称比例低至25%,高至65%〔6〕。尽管her2靶向治疗的结果有所改善,但约1/4接受早期乳腺癌治疗的患者在8年后仍有复发的风险,大约15%将在10年内死亡〔7,8〕。既往研究发现,与单药her2靶向治疗相比,双药her2阻断增加了获得病理CR的患者数量,且不显著影响安全性〔9〕。帕妥珠单抗是一种针对her2的人源化单克隆抗体与曲妥珠单抗her2上的不同表位结合,并抑制her2与其他her家族成员形成异二聚体〔10〕。帕妥珠单抗与曲妥珠单抗在没有竞争的情况下结合her2,并通过不同机制抑制her2信号〔11〕。帕妥珠单抗与曲妥珠单抗通过不同机制的双重抑制提供了比单独抗体更全面的her2信号阻断〔12〕。在转移性/局部复发性不可切除的her2阳性乳腺癌患者中,在曲妥珠单抗和化疗的基础上添加帕妥珠单抗显著提高了无进展生存期和总生存期,是这种情况下患者的标准治理方案〔13〕。在her2阳性的早期乳腺癌患者中,帕妥珠单抗结合曲妥珠单抗和化疗被批准作为早期乳腺癌的新辅助治疗,基于该方案提高了病理完全缓解率,且心脏毒性没有增加〔6,14〕。本研究旨在探究辅助用药帕妥珠单抗联合曲妥珠单抗在局部晚期、炎症性或早期her2阳性老年乳腺癌患者中的有效性及安全性。
1 资料与方法
1.1一般资料 回顾性选取南昌市第三医院和江西省肿瘤医院2018年3月至2022年3月就诊的局部晚期、炎症性或早期her2阳性老年乳腺癌患者112例,采用前瞻性研究方法随机分为观察组与对照组各56例。纳入标准:(1)年龄≥60岁;(2)经病理学及免疫组化检查确诊为局部晚期、炎症性或早期her2阳性乳腺癌;(3)第1次接受药物治疗;(4)肿瘤体积>2 cm;(5)淋巴结阳性;(6)患者自愿参加研究。排除标准:(1)已接受药物治疗者;(2)有严重肝肾功能障碍者;(3)心脏功能较差者;(4)意识不清醒,无法配合研究者。两组一般资料无统计学差异(P>0.05),见表1。
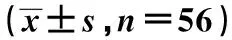
表1 两组一般资料对比
1.2治疗方法 对照组在化疗基础上给予曲妥珠单抗注射液8 mg/kg,输注时间<1.5 h。曲妥珠单抗在第2个疗程的剂量改为6 mg/kg。观察组在对照组基础上,给予帕妥珠单抗注射液840 mg,帕妥珠单抗在第2个疗程的剂量改为420 mg。两组共治疗4个疗程,每隔21 d重复给药,并随访1年。
1.3临床效果评价 按实体瘤临床疗效评价标准分为CR、部分缓解(PR)、病情稳定(SD)、疾病进展(PD),CR:目标病灶均消失,其中任意病理性淋巴结短轴值减少<10 mm;PR:目标病灶直径的总和较基线至少减少30%;SD:病灶缩小程度没有达到PR,病灶增加程度也没有达到PD水平,介于两者之间;PD:以所有出来靶病灶直径之和最小值为对照,肿瘤病灶直径总和至少增加20%。另外,直径总和增加的绝对值增加至少5 mm。客观缓解率=(CR+PR)/总例数×100%。疾病控制率=(CR+PR+SD)/总例数×100%。
1.4肿瘤标志物水平 抽取患者3 ml空腹血,以3 000 r/min离心15 min,留用上层血清,检测患者治疗前后癌胚抗原(CEA)、糖类抗原(CA)125水平。
1.5不良反应发生情况 依据美国国立癌症研究所不良反应通用术语标准〔16〕判定不良反应发生情况。
1.6统计学分析 采用SPSS22.0统计学软件进行t检验、χ2检验。
2 结 果
2.1两组临床效果对比 对照组CR 18例,PR 14例,SD 10例,PD 14例,客观缓解率为57.14%,疾病控制率75.00%;观察组CR 29例,PR 12例,SD 12例,PD 3例,客观缓解率为73.21%,疾病控制率96.64%。观察组CR、SD例数多于对照组,客观缓解率及疾病控制率高于对照组,有统计学差异(P<0.05)。
2.2两组肿瘤标志物水平比较 两组治疗前肿瘤标志物水平差异无统计学意义(P>0.05),治疗后两组均有所下降,且观察组低于对照组,有统计学差异(P<0.05),见表2。
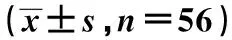
表2 两组肿瘤标志物水平比较
2.3两组不良反应对比 对照组与观察组不良反应发生情况无统计学差异〔P>0.05,恶心9例(16.07%) vs 7例(12.50%)、呕吐7例(12.50%) vs 8例(14.29%)、腹泻5例(8.93%) vs 4例(7.14%)、便秘7例(12.50%) vs 1例(1.79%);心悸2例(3.57%) vs 3例 (5.36%)、心脏毒性2例(3.57%) vs 1例(1.79%)〕。
3 讨 论
Her2阳性乳腺癌是由her2/neu癌基因扩增而定义,是乳腺癌的一种侵袭性亚型。大约20%的乳腺癌过表达her2蛋白〔15〕。以抗her2人源化单克隆抗体曲妥珠单抗为起点的her2靶向治疗大大改善了乳腺癌的预后〔16〕。在局部环境下,在辅助化疗中加入曲妥珠单抗可使复发风险相对降低50%,死亡率相对降低30%〔17〕。尽管治疗效果有所改善,但转移性肿瘤的复发及其发病率和死亡率仍然是一个临床挑战。改善局部环境下的治疗方案降低复发风险仍然是临床关注的领域。新辅助疗法(NAT)越来越多地用于局部乳腺癌的治疗,作为辅助化疗的替代方案,研究表明,两种治疗方法的长期疗效相似〔18,19〕。然而,从临床和研究的角度来看,NAT提供了更多优势。对于较大肿瘤患者,使用NAT可能会减小肿瘤大小,从而提高保乳手术的比率,减少腋窝手术的范围〔20〕。此外,新辅助治疗允许监测治疗反应,提供潜在的重要预后信息。新辅助疗法还允许在疾病进展的情况下停止不活跃的治疗,从而减少对无效和潜在毒性治疗的发生〔21,22〕。新辅助治疗后的病理CR已被证明是无病生存率和总生存率的替代标志物,特别是对于her2阳性乳腺癌〔23〕。2013年,美国食品药品监督管理局批准了帕妥珠单抗用于与曲妥珠单抗的新辅助治疗联合化疗用于局部晚期、炎症或her2阳性早期乳腺癌〔24〕。马善义等〔25〕曲妥珠单抗联合帕妥珠单抗治疗Her2过表达的乳腺癌患者临床疗效较好,安全性也可以被接受。
本研究结果表明,与单独接受曲妥珠单抗相比,基于曲妥珠单抗联合帕妥珠单抗的新辅助治疗方案具有更高的病理客观缓解率。同时本研究还发现,新辅助药物曲妥珠单抗联合帕妥珠单抗的患者比单独接受曲妥珠单抗的患者获得了明显的病理客观缓解率,同时治疗后肿瘤标志物下降水平更明显。在安全性方面新辅助药物曲妥珠单抗联合帕妥珠单抗并没有对不良反应的发生有太大影响。
综上,新辅助用药帕妥珠单抗联合曲妥珠单抗在局部晚期、炎症性或早期her2阳性乳腺癌患者中有效性更客观,安全性不被影响。

