富氧燃烧条件下Q235B钢坯氧化反应动力学
王俊博,于庆波,赵 俣,秦 勤,胡贤忠
(1.东北大学 冶金学院,沈阳 110819;2.鞍钢集团钢铁研究院,辽宁 鞍山 110078)
2021年,我国粗钢产量达到10.35亿t,钢铁工业的能源消耗约占全国总能源消耗的11%.可见,在钢铁生产过程中,节能减排技术的应用至关重要.近年来,富氧燃烧技术作为一种高效节能的燃烧技术,被越来越多地应用在轧钢加热炉中.钢坯在加热过程中与高温烟气中的O2,H2O和CO2等氧化性气体发生氧化反应的现象被称为氧化烧损[1-3].氧化烧损不但会影响钢坯的表面质量,还会增大产品的损耗率、提高去除氧化铁皮的成本[4].而富氧燃烧可通过增大烟气中氧化性气体的含量,影响钢坯的氧化速率.因此,研究富氧燃烧条件下钢坯的氧化反应动力学,对综合评判富氧燃烧技术在轧钢加热炉上的应用具有重要的现实意义.
钢坯氧化的机制可被分为两个阶段.在初始氧化阶段,钢坯氧化增重与时间近似成线性关系,氧化速率取决于气体扩散层的扩散速率和界面反应速率[5].Vielstich等[6]通过建立虚拟的边界层——Nernst扩散层,描述了边界处的扩散量.Abuluwefa等[7-8]根据此假设,使用菲克定律建立了O2的线性氧化速率表达式,并根据表面化学反应速率常数推导得到了CO2和H2O的线性氧化速率表达式.随着氧化层厚度达到0.004~0.1 mm,钢坯氧化进入第二个阶段,氧化烧损模型变为抛物线型增重,氧化速率取决于Fe2+扩散穿越氧化层速率[9].Neil等[10]使用铁离子和空位扩散理论,推导出了抛物线型的氧化速率表达式.Marston等[11]将分段的线性增重模型和抛物线增重模型简化,确定了线性抛物线混合模型.
本文中对Q235B钢坯的氧化进行热重实验,探究加热温度和气氛等因素对钢坯氧化的影响,以此确定Q235B钢坯的氧化烧损模型.
1 氧化机制和速率方程
氧化速率一般使用热重法测量,通过单位表面积的钢坯在单位时间内的增重来表达.钢坯的氧化增重模型为线性抛物线混合模型,具体表达式为[11]
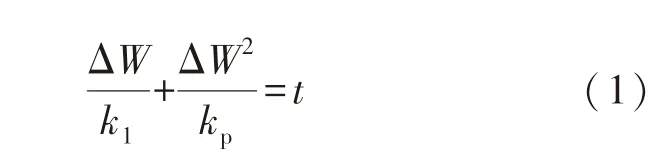
式中:ΔW为单位表面积增重,mg/cm2;k1为线性氧化速率,用来描述氧化性气体穿过气体边界层以及在表面氧化反应的速率,它与加热温度、各氧化性气体的浓度相关,mg/(cm2·min);kp为抛物线氧化速率,用来描述Fe2+在氧化层中的扩散速率,mg2/(cm4·min);t为氧化反应时间,min.
钢坯在多组分气体中的线性氧化速率为各组分线性氧化速率之和.加热炉烟气中的氧化性气体成分为O2,CO2和H2O.故三者之和为[8]
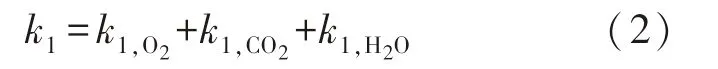
由于O2氧化性较强,能较快地与钢坯发生反应,因此钢坯表面的O2体积分数远低于烟气中O2体积分数,几乎为0.通过建立虚拟扩散层,可采用O2扩散穿过扩散层的速率来描述O2与钢坯的反应速率[7]:
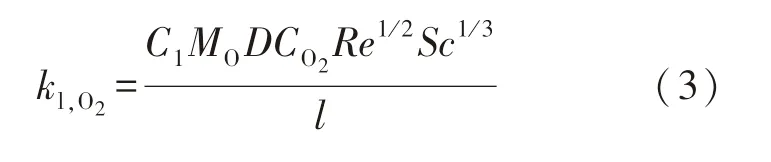
式中:C1为常系数;MO为氧原子的摩尔质量,取16 000 mg/mol;D为气体扩散常数,cm2/min;CO2为O2的摩尔浓度,mol/cm3;Re为雷诺数;Sc为施密特数;l为样品长度,cm.
CO2和H2O的氧化性较弱,与钢坯的反应速度较慢,因此钢坯表面的CO2和H2O体积分数几乎等于烟气中两组分体积分数.可采用阿伦尼乌斯公式来描述CO2,H2O与钢坯的反应速率,具体表达式分别为[8-9]

式中:KC和KH分别为CO2,H2O与钢坯反应的指前因子;QC和QH分别为CO2,H2O与钢坯反应的活化能,J/mol;aCO2和aH2O分别为CO2,H2O与Fe的反应平衡常数的倒数;PCO2和PH2O分别为CO2,H2O的气体分压,100 kPa;R为气体常数,J/(mol·K);T为加热温度,K.
抛物线氧化速率kp描述的是Fe2+在氧化层内扩散的能力,表达式为[10]
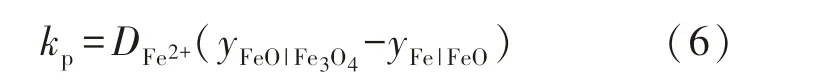
式中:DFe2+为Fe2+在氧化层的扩散速率常数,mg2/(cm4·min);yFeO|Fe3O4,yFe|FeO分别为FeO和Fe3O4交界处、Fe和FeO交界处的Fe2+空位浓度,它们随温度的变化如表1所列.由文献[12]可知,固体中扩散系数的对数与绝对温度成反比:

表1 不同温度下Fe2+空位浓度Table 1 Fe2+vacancy concentration at different temperatures

式中:D0为常系数;E为活化能,J/mol;T为加热温度,K.
上述公式即为钢坯的氧化反应动力学模型,但对于元素含量不同的钢坯来说,公式中的参数可能大不相同.下文中主要研究的是富氧燃烧条件下Q235B钢坯的氧化.
2 实验系统
实验系统如图1所示.通过质量流量计控制CO2,O2,N2等气流的流量,按照设定的比例将它们混合在一起,随后通入水浴装置中,即可得到含有CO2,O2,N2,H2O的混合气体;通过控制水浴装置的加热温度来改变水蒸气的饱和蒸气压,控制混合气体中的水蒸气含量.将混合气体通入实验炉中,使其在钢坯样品周围达到指定温度,用以模拟加热炉内烟气.钢坯通过悬丝悬挂在炉子中央,并使用电子天平实时称量钢坯的质量变化.其中,钢坯的增重为氧化过程中钢坯吸收的氧元素重量.通过实验发现[10],当钢坯加热温度高于600℃时,生成的Fe2O3,Fe3O4,FeO质量比为1∶4∶95,FeO中氧元素重量近似等于钢坯的增重,故可用来反映钢坯的氧化情况.

图1 实验系统示意图Fig.1 Schematic diagram of the experimental system
实验中使用的钢坯样品为Q235B牌号,尺寸为30 mm×20 mm×4.7 mm,在钢坯中间挖出一个直径5 mm的孔洞,用以穿过悬丝,同时打孔会使钢坯表面积增至17.045 cm2.而氧化反应在钢坯表面进行,钢坯表面积越大,可接触的氧气越多,钢坯增重就越大,因此钢坯的氧化情况可由单位表面积增重来衡量.打孔虽会增大钢坯的增重,但单位表面积增重不受影响,故打孔不影响钢坯实际氧化程度的计算.表2列出了钢坯样品的化学成分.由于镍铬丝可承受高温加热,因此悬丝采用直径0.5 mm的镍铬丝.在对照实验中,混合气体氛围下单独加热镍铬丝,发现其氧化增重几乎为0,故不会发生镍铬丝被氧化而影响随后实验精度的情况.
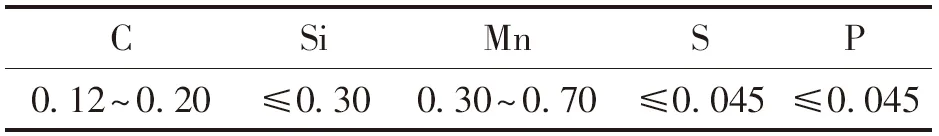
表2 钢坯样品的化学成分(质量分数)Table 2 Chemical composition of steel sample(mass fraction) %
实验过程中,在只通入N2的情况下先将钢坯加热到指定温度;随后改为通入模拟烟气恒温加热2 h,实时测量并记录钢坯质量的变化;最后在保护性气体N2的保护下,将钢坯冷却到室温.
表3列出了加热炉的煤气成分.而在不同的助燃气体O2体积分数下,燃烧产生的烟气成分大不相同.表4列出了当空气消耗系数n=1.15时,不同富氧程度下(即助燃气体O2体积分数不同)的烟气成分.本文分为拟合公式参数和验证结果两部分:拟合公式参数部分使用的是助燃气体O2体积分数40%下燃烧产生的烟气;验证部分则是对不同富氧程度下烟气成分进行实验研究,以确定拟合得到的公式参数是否准确.
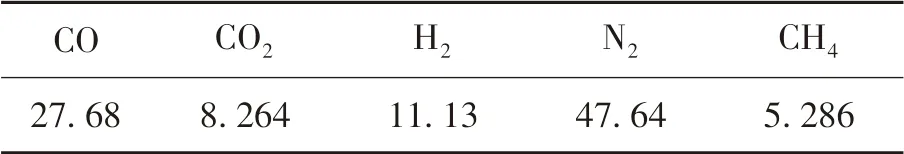
表3 混合煤气成分(体积分数)Table 3 Mixed gas composition(volume fraction) %

表4 不同富氧程度下烟气成分Table 4 Flue gas composition under different oxygen-enriched degrees %
3 结果和讨论
在钢坯氧化的初始阶段,钢坯的氧化增重与时间近似成线性关系,此时的线性氧化速率等于烟气各组分线性氧化速率之和;随着时间的推移,钢坯表面氧化层逐渐增厚,氧化速率逐渐减小,转变为抛物线型增重.本节中将依次针对富氧燃烧条件下Q235B钢坯的O2,CO2,H2O线性氧化速率和抛物线型氧化速率进行研究.
3.1 O2氧化钢坯的线性速率
通过实时记录钢坯质量的变化,得到了单位表面积的质量增重随时间变化的规律,采用式(1)即可拟合确定相应的线性氧化速率和抛物线型氧化速率.在保持CO2,H2O体积分数不变时,总线性氧化速率的变化值即为O2线性氧化速率的变化值.故确定如下实验条件:钢坯加热温度为1 200℃、CO2体积分数为21.32%、H2O体积分数为11.99%,O2的体积分数分别为1%,2%,3%,4%(根据表4中数据,确定烟气中O2的体积分数选取范围为1%~4%,选择4个水平,分别是1%,2%,3%,4%),N2的体积分数为剩余占比.图2示出了O2线性氧化速率k1,O2与O2体积分数之间关系.

图2 不同O 2体积分数下单位表面积增重随时间的变化Fig.2 Variation of weight gain per unit surface area with time under different O 2volume fractions
由图可知:在氧化的初始阶段,单位表面积增重会随时间呈线性增加,这是因为该阶段为界面反应,钢坯与氧化性气体直接接触,发生剧烈的气固反应;随着氧化反应的进行,反应速率逐渐减少,变为抛物线型增重,此时钢坯表面已形成了一层氧化膜,钢坯与氧化性气体不能直接接触,氧化反应只能通过扩散进行.同时,根据氧化增重曲线可看出,在相同的氧化时间内,随着烟气中O2体积分数的增大,钢坯氧化增重越多、氧化程度越大.
为进一步研究O2线性氧化速率,将钢坯氧化增重数据使用式(1)拟合可得到不同O2体积分数下线性增重常数k1,如表5所列.

表5 不同的O2体积分数下k1数值Table 5 k1 values under different O 2 volume fractions
实验中CO2、H2O浓度和加热温度均保持不变,因此k1,CO2,k1,H2O也保持不变.当O2体积分数变化时,k1的变化即为k1,O2变化.通过理想气体状态方程将O2体积分数转化为摩尔浓度,最终不同O2摩尔浓度下的k1,O2如图3中离散点所示.
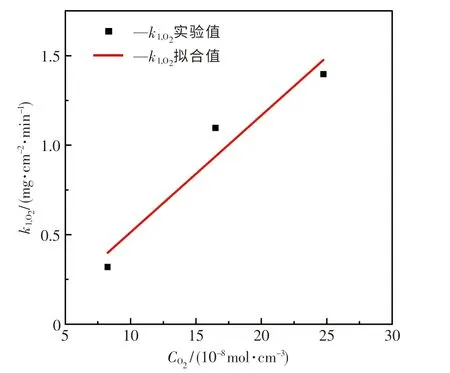
图3 k1,O2与烟气中O 2摩尔浓度的关系Fig.3 Relationship between k1,O2 and O2 molar concentration in flue gas
使用式(3)对实验数据点进行拟合,气体扩散常数D使用Fuller-Schettler-Giliding公式[13]确定,具体表达式为
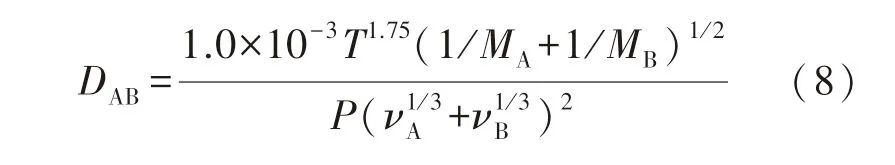
式中:P为总压力,100 kPa;T为加热温度,K;MA,MB为摩尔质量,g/mol;νA,νB为扩散体积,cm3/mol.A,B分别代表O2,N2;MA,MB分别取32,8 g/mol;νA,νB分别取6,17.9 cm3/mol.
从图3中的曲线可知,实验数据点与拟合曲线重合度较好,R2为0.925 27,这说明模型适合实验数据.拟合可得出C1=87.583,由此确定O2线性氧化速率表达式为
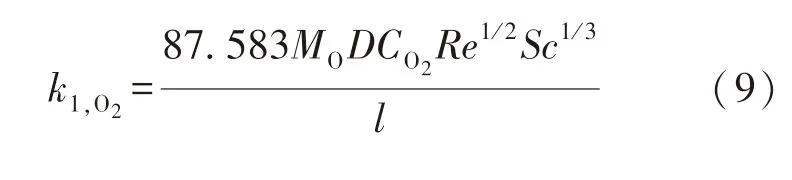
3.2 CO2,H 2O氧化钢坯的线性速率
实验中气体成分如表6所列.实验A中O2和H2O的体积分数均为0,导致k1,O2和k1,H2O均为0且k1=k1,CO2,通过改变加热温度(1 000,1 050,1 100,1 150,1 200℃)可得到k1,CO2与温度之间关系;实验B同样会导致k1=k1,H2O,从而也可通过改变温度得到k1,H2O与温度之间关系;对不同温度下k1,CO2和k1,H2O进行拟合可确定k1,CO2和k1,H2O的表达式.
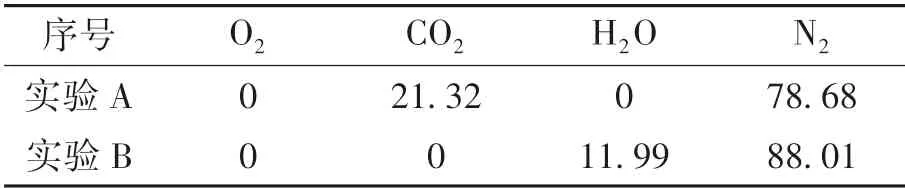
表6 CO2,H 2 O氧化钢坯实验气体成分(体积分数)Table 6 Experimental conditions of CO2,H 2O oxidation of steel billet(volume fraction) %
从图4中可看出,钢坯氧化增重和时间近似成线性关系,这是因为在指定的氧化时间内,CO2和H2O与钢坯的反应速度较慢,生成的氧化层较薄,没有对Fe2+的扩散造成阻碍,故没有转为抛物线型增重.同时,随着加热温度的升高,氧化增重逐渐增大,且温度越高,温度对氧化增重的影响越大.

图4 不同温度下单位表面积增重随时间的变化Fig.4 Variation of weight gain per unit surface area with time at different temperatures
k1,CO2(实验A)和k1,H2O(实验B)如图5中离散点所示.将k1,CO2和k1,H2O的离散实验数据点分别使用式(4)和(5)进行拟合,再通过HSC Chemistry进行计算,结果如表7所列.从图5的拟合结果可看出,实验点与拟合曲线高度重合,两次拟合的R2分别为0.992 45,0.982 68.
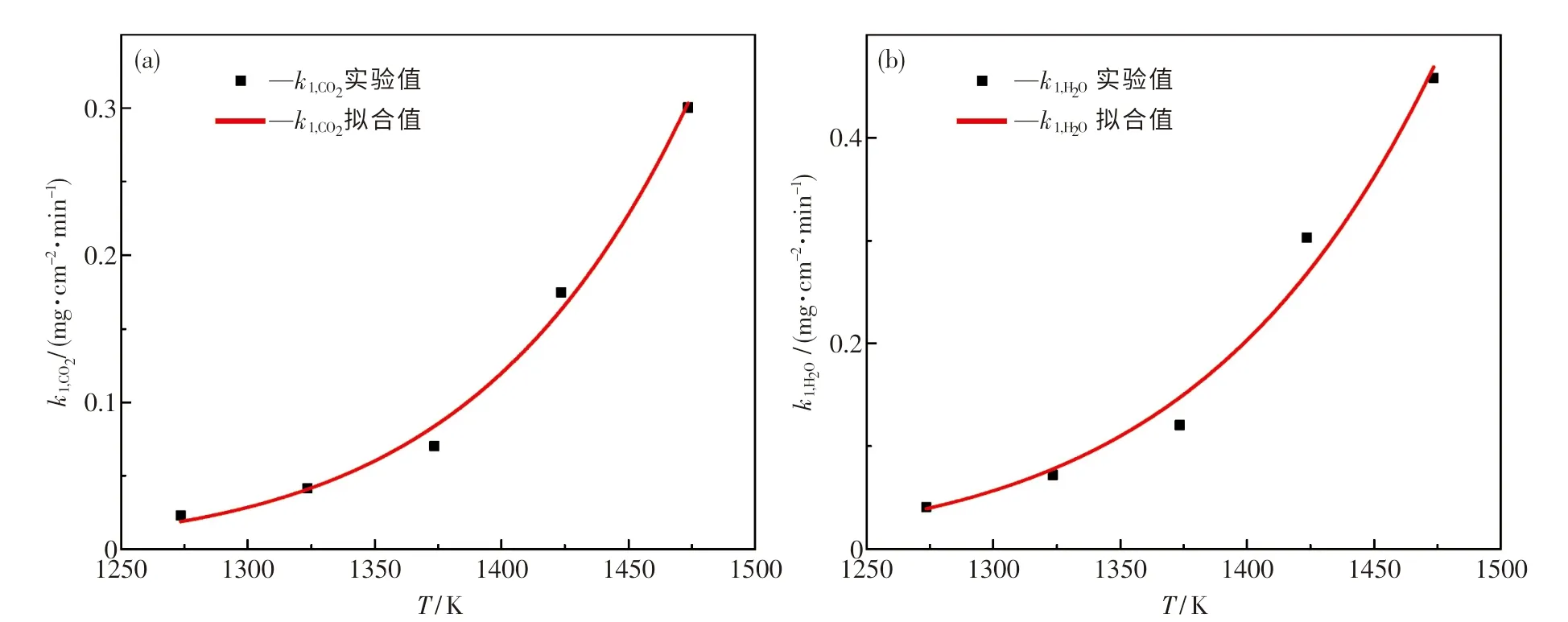
图5 k1,CO2和k1,H 2O随温度的变化Fig.5 k1,CO2 and k1,H2O as a function of temperature
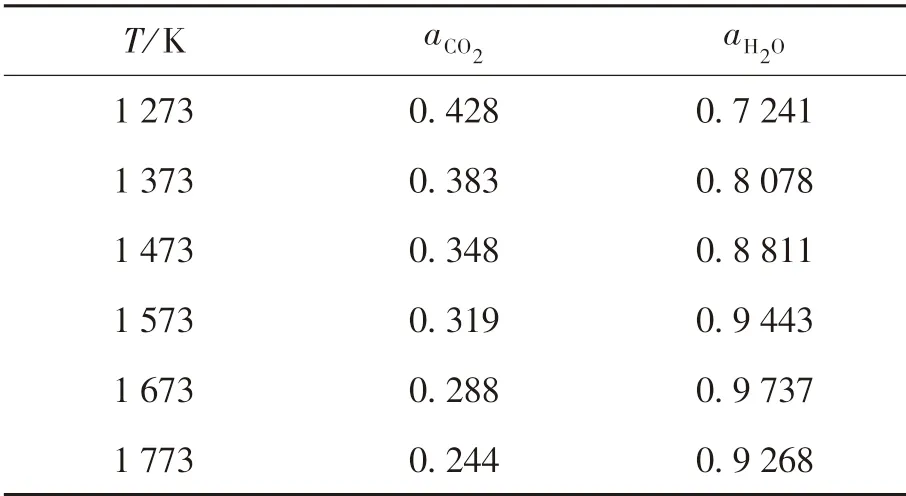
表7 不同温度下的a CO2和a H 2OTable 7 a CO2 and a H2O at different temperatures
通过拟合可确定KC=0.784,QC=204530.25J/mol,KH=3630.23,QH=203323.84 J/mol.故k1,CO2和k1,H2O表达式分别为

3.3 钢坯氧化的抛物线速率
抛物线氧化速率kp反映的是Fe2+在氧化层内扩散的能力,为加热温度的函数.本节实验中烟气成分保持不变,仅通过改变实验温度来探究kp与温度之间的关系.
实验条件如下:设定O2体积分数为2.27%,CO2体积分数为21.32%,H2O体积分数为11.99%,剩余部分为N2,实验温度分别为800,900,1 000,1 100,1 150,1 200℃.
从图6中可看出:在实验温度为800和900℃时,增重曲线近似为直线;当温度升至1 000℃以上时,增重曲线后程则变为抛物线.此现象与上一节中CO2和H2O氧化钢坯时类似,这主要是因为在温度较低时,氧化速度较慢,氧化层没有达到一定厚度,此时的氧化增重速率受表面反应和气体扩散速率控制,近似呈线性增重.

图6 不同温度下单位表面积增重随时间的变化Fig.6 Variation of weight gain per unit surface area with time at different temperatures
对钢坯增重数据进行处理可得到不同温度下的kp,如图7中离散点所示.可看出,kp随着加热温度的升高逐渐增大,且温度越高,kp受温度的影响越大.
对不同温度下kp数据点使用式(6)~(7)拟合,结果如图7中曲线所示.可看出,实验数据点与拟合曲线重合度很高,R2为0.974 15,这说明模型适合实验数据.通过拟合可得到D0=1.78×107,E=115 694.69 J/mol,故确定kp表达式为

图7 抛物线氧化速率k p与温度的关系Fig.7 Relationship between parabolic oxidation rate k p and temperature

3.4 实验验证氧化烧损模型
为确定上文中氧化烧损模型的准确性,对不同富氧程度下钢坯的氧化情况进行实验和计算.
实验条件如下:分别使用表4中的助燃气体O2体积分数为21%,30%,40%,65%,100%产生的烟气成分进行实验,实验加热温度保持1 200℃不变.
实验值和计算值如图8所示,离散点为通过实验测得的数据点,曲线为使用氧化烧损模型计算的结果.由图可知,随着助燃气体中O2体积分数的增大,钢坯的氧化烧损逐渐变严重.这是因为助燃气体中富氧程度越高,燃烧产生的烟气中氧化性气体比例越大,故氧化烧损越严重.同时,可发现离散点与曲线重合度较高,证明拟合确定的Q235B氧化烧损模型具有较高的可信度.
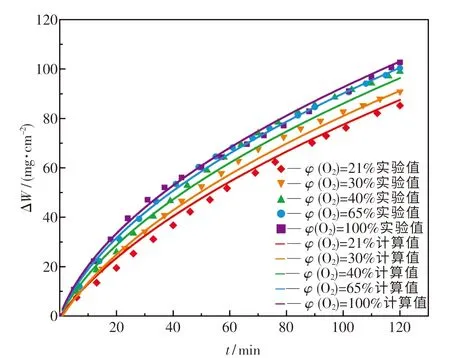
图8 不同的助燃气体O2体积分数下实验值和计算值对比Fig.8 Comparison of experimental and calculated values under different oxygen volume fractions of combustion-supporting gas
4 结 论
(1)在钢坯氧化反应的最初阶段,氧化增重急剧增加.随着时间的推移,氧化增重曲线趋于平坦,即氧化反应减缓.随着烟气中O2体积分数的增大,钢坯氧化增重不断增加.数据拟合可确定k1,O2表达式中常系数C1=87.583.
(2)在CO2和H2O氧化钢坯的实验中,氧化增重都随着温度的升高,而逐渐增加,且温度越高,温度对氧化增重影响越大.CO2,H2O与钢坯反应的指前因子分别为KC=0.784,KH=3 630.23;活化能分别为QC=204 530.25 J/mol,QH=203 323.84 J/mol.
(3)当氧化速率较小时,钢坯增重与时间近似成线性关系;当氧化速率较大时,钢坯增重曲线后程变为抛物线.通过拟合可确定kp表达式中D0=1.78×107,E=115 694.69 J/mol.助燃气体富氧程度的提高会加剧钢坯的氧化.

