Connexin43敲降对血红素诱导的星形胶质细胞凋亡和铁死亡的影响
陆聪, 桂如林, 吕广钊, 张志坚, 卢小东, 杨勇
(1. 江苏大学医学院,江苏 镇江 212013; 2. 广东省人民医院神经外科,广东 广州 510080)
星形胶质细胞(astrocyte,ASC)是中枢神经系统内数量最多的细胞,为神经元提供营养和机械支持。中枢神经系统在遭受炎症、肿瘤、损伤等情况下会出现ASC活化,也称反应性胶质增生[1-4]。ASC之间存在广泛的缝隙连接,连接蛋白(Connexin,Cx)是形成缝隙连接的分子基础,约有20种亚型,ASC、神经元和小胶质细胞分别高表达Cx43、Cx36和Cx32[5]。Cx在细胞膜上形成的同源或异源六聚体中空结构称为连接子,具有半通道功能,介导细胞与细胞外液的物质交换[6-8]。相邻细胞膜上的连接子对接形成缝隙连接通道,允许分子量在1.5 kDa以下的离子、信号分子和神经递质等小分子物质在相邻细胞间传递,形成细胞间离子和代谢物偶联,称为缝隙连接介导的细胞间通讯(gap junctional intercellular communication,GJIC)[9-10]。此外,Cx43还具有非通道相关的间接调控功能:Cx43羧基端可与β-catenin,c-Src,Cyclin E等调节蛋白以及细胞骨架结合,调控细胞的增殖、迁移、分化和细胞极性[11-13]。
铁死亡是指一种铁依赖的程序性细胞死亡。细胞外的无机铁通常是以无毒的Fe3+的形式与转铁蛋白结合,通过细胞膜上的转铁蛋白受体转运进入细胞内。血红蛋白降解产生的血红素是一种强烈的活性氧诱导剂,通过细胞膜上的转运体被转运至细胞内,释放出Fe2+参与芬顿循环,产生大量自由基引起细胞铁死亡[14-15]。
生理状态下,ASC之间通过Cx43形成广泛的细胞间缝隙连接,形成的合胞体样结构对维持中枢神经系统稳态具有重要意义[16-19]。前期研究发现,脑出血后ASC中Cx43表达下调,触发了Yes相关蛋白(YAP)核转位,介导了ASC活化过程中的表型转化[20]。但关于脑出血后ASC中Cx43表达水平对氧化血红素(hemin)诱导的细胞凋亡和铁死亡的影响迄今未见报道。
本研究通过敲降ASC中Cx43表达,观察细胞对hemin损伤作用的反应;通过生信分析,预测Cx43与铁死亡的相关性及可能涉及的信号通路,并进行验证,为后续深入的机制研究提供线索。
1 材料与方法
1.1 材料与试剂
SD红皮鼠购自江苏大学实验动物中心,本研究获得广东省人民医院医学伦理委员会批准(No.GDREC2019173A)。Cx43干扰和对照慢病毒(上海汉恒生物科技公司),具体碱基序列见表1。一步法Tunel细胞凋亡检测试剂盒和活性氧(ROS)、乳酸脱氢酶(LDH)检测试剂盒(南通碧云天生物技术公司);丙二醛(MDA)、还原型谷胱甘肽(GSH)测定试剂盒(南京建成生物技术研究所)。小鼠抗α微管蛋白抗体(武汉博士德生物公司),兔抗Cx43、YAP、Bcl-2、Caspase3、c-Caspase3抗体(美国CST公司);兔抗Bax抗体(英国Abcam公司);兔抗谷胱甘肽过氧化物酶4(GPX4)抗体(美国Affinity公司)。RIPA裂解液及HPR标记的羊抗兔二抗(南通碧云天生物技术公司)。
1.2 方法
1.2.1 ASC纯化培养 参照文献[21]的方法提取新生SD大鼠的大脑皮层ASC,取出生1~2 d的SD红皮鼠,采用5%异氟烷吸入麻醉后断头处死,75%乙醇浸泡消毒后取脑,显微镜下分离大脑皮层,去除脑膜、血管和海马。剩余的皮层组织转入0.25%的胰蛋白酶溶液中,轻轻吹打,37 ℃消化10 min。采用孔径70 μm细胞滤网过滤组织残渣,收集滤液,1 000 r/min离心5 min收集细胞沉淀,重悬于10%胎牛血清的高糖DMEM培养液中,接种于多聚赖氨酸包被的培养皿中,置于培养箱内37 ℃、95%湿度和5% CO2条件下培养。当细胞融合时,将培养瓶在37 ℃摇床上以220 r/min振荡1 h,去除小胶质细胞和少突胶质前体细胞。经免疫荧光染色鉴定,通过此法分离培养的ASC纯度超过95%,用于后续实验。

表1 Cx43干扰和对照慢病毒碱基序列
1.2.2 慢病毒感染及干扰慢病毒筛选 ASC以5×103/孔的密度接种于96孔板中,待细胞贴壁。根据病毒液滴度,分别计算感染复数(multiplicity of infection,MOI)为3,10,60和100时所需的病毒液用量,用完全培养液稀释,并加入终浓度为5 μg/mL的聚苯乙烯,每孔加入相应MOI值的含慢病毒培养液50 μL,4 h后,每孔再加入50 μL不含病毒液的完全培养液(半体积感染法)。病毒感染24 h后,弃去含有病毒液的培养液,换上新鲜的完全培养液,于37 ℃培养箱继续培养。感染72 h后,在荧光显微镜下观察绿色荧光细胞百分比,确定各MOI值的感染效率。选择合适的MOI值用于后续实验。
将ASC按照5×105/孔的密度接种于6孔板中,按照上述慢病毒感染方法,使用对应的MOI值,进行Cx43-shRNA1,Cx43-shRNA2,Cx43-shRNA3和Cx43NC感染。72 h后收集细胞,提取蛋白用于蛋白质印迹检测Cx43表达,鉴定各慢病毒的干扰效率,筛选干扰效率最高的慢病毒用于后续实验。
1.2.3 细胞分组及处理 将ASC按照5×105/孔的密度接种于6孔板中,分为对照组(Control)、溶剂对照组(Vehicle)、hemin组、Cx43NC+hemin组、Cx43KD+hemin组。待细胞贴壁后按照上述慢病毒感染操作进行Cx43-shRNA1和Cx43NC慢病毒感染,48 h后,向各组细胞中加入如下处理因素:对照组为无血清DMEM,溶剂对照组为含有同等稀释度hemin溶剂的无血清DMEM,hemin组、Cx43NC+hemin组和Cx43KD+hemin组加入终浓度为25 μmol/L hemin的无血清DMEM。对于Verteporfin(Vp,YAP抑制剂)干预实验分组:Cx43NC+hemin组、Cx43KD+hemin组和Cx43KD+hemin+Vp处理组。Vp的终浓度为5 μmol/L。
1.2.4 ROS,GSH,MDA测定和LDH释放实验检测铁死亡 上述各组接受处理12 h后的ASC,吸出培养液,加入终浓度为10 μmol/L的DCFH-DA荧光探针,37 ℃孵育20 min后去除DCFH-DA,用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。消化收集细胞,采用荧光酶标仪检测各孔荧光强度。以对照组为参照,计算各组细胞的相对ROS产生量。
收集上述各组接受处理12 h后的ASC,裂解细胞并提取蛋白,采用BCA试剂盒测定蛋白浓度,取细胞裂解蛋白样品,参照试剂盒说明书进行MDA和GSH检测,参照标准曲线计算出单位蛋白含量中MDA和GSH的含量,并以对照组为参照,计算各处理组细胞的相对MDA和GSH含量。
收集上述各组接受处理24 h后的ASC,参照LDH检测试剂盒说明书进行检测。按照以下公式计算细胞死亡率。细胞死亡率(%)=(处理组样品光密度-无细胞空白培养液对照组光密度)/(细胞最大酶活性的光密度-无细胞空白培养液对照组光密度)×100。
1.2.5 Tunel染色检测细胞凋亡 收集上述处理过12 h的细胞,PBS洗涤3次,加入4%多聚甲醛溶液固定1 h。使用一步法Tunel染色试剂盒检测细胞凋亡,参照试剂盒说明书进行Tunel染色,荧光显微镜下观察并拍照。
1.2.6 蛋白质印迹检测细胞凋亡和铁死亡相关蛋白表达 收集上述处理过的细胞,采用RIPA蛋白裂解液提取细胞总蛋白,测定蛋白浓度后,按照每泳道30 μg上样进行聚丙烯酰胺凝胶电泳、转膜,依次孵育抗体后加入超敏ECL,在凝胶成像系统中观察结果并拍照,并用ImageJ进行灰度分析。使用的一抗和二抗稀释度:α微管蛋白(1 ∶1 000),Cx43(1 ∶1 000),Bax(1 ∶1 000),Bcl2(1 ∶1 000),GPX4(1 ∶1 000),Caspase3(1 ∶1 000),c-Caspase3(1 ∶1 000);HPR标记的羊抗兔二抗(1 ∶5 000)。
1.2.7 免疫荧光染色检测YAP表达 将ASC以每孔5×104的密度接种于24孔板。按照上述加入处理因素后,将细胞用4%多聚甲醛固定1 h。PBS洗涤3次,室温下加入0.3% Triton X-100破膜15 min后加入10% BSA溶液封闭1 h。随后加入兔抗YAP抗体(1 ∶250)并于4 ℃孵育过夜。PBS洗涤后,加入驴抗兔IgG(1 ∶300),室温孵育1 h。PBS洗涤后,DAPI染色5 min。激光共聚焦显微镜下观察并拍照。
1.2.8 生物信息学分析
1.2.8.1 采用生物信息学对Cx43相关性差异基因进行分析 为了预测Cx43在脑组织中的功能,提取了GTEx数据库正常脑组织转录组数据,根据Cx43表达量对转录组表达矩阵进行分组,利用R语言pheatmap包绘制热图,当两组样本有截然不同的基因表达特征时,利用R语言limma包进行差异基因分析,Log2(差异倍数)的绝对值大于均值+2倍标准差且标准化P值小于0.05被认为是显著差异基因,基于此得出Cx43相关性差异基因以及其在不同分组中表达差异倍数,用R语言ggplot()函数绘制火山图。
1.2.8.2 采用生物信息学对Cx43相关性差异基因集富集分析 利用上述方法得到的差异表达基因及其表达变化倍数,使用R语言GSEABase包中的GSEA()函数,选择“h.all.v7.2.symbols.gmt”作为注释基因集、设定置换次数为1 000次进行基因集富集分析。结果中NES绝对值>1、NomP<0.05且FDRP<0.25被认为差异有统计学意义。最后选择显著富集到的GO基因集,包括Hippo通路基因集,铁离子通道结合基因集,脂质过氧化基因集,缺氧应激基因集等,利用GSEAplot()函数绘制富集图。
1.2.8.3 采用生物信息学构建转录调控网络并分析转录因子 转录调控网络(transcriptional regulatory network,TRN)由转录因子与其靶基因组成,转录因子识别特定DNA序列并在基因组层面上调控基因表达。基于此,提取GTEx数据库中1 141个正常脑组织转录组数据,通过sample()函数随机抽取100个转录组矩阵,将其作为标准矩阵,使用R语言RTN包tni.constructor()算法构建转录增强相关结构域(transcriptional enhanced associate domain,TEAD)转录因子家族的转录调控网络;然后利用Cx43表达量作为分组条件对这1 141个正常脑组织转录组表达数据进行分组,使用上述步骤构建好的转录调控网络,利用tni2tna.preprocess()进行转录因子调控网络富集分析,并利用tna.plot.gsea2()函数绘制富集图。
1.3 统计学分析
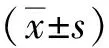
2 结果
2.1 ASC中Cx43敲降效果的验证
Cx43NC和Cx43-shRNA1慢病毒MOI=60时感染效率最高,Cx43-shRNA2和Cx43-shRNA3慢病毒MOI=100时感染效率最高。蛋白质印迹检测不同慢病毒感染后ASC中Cx43表达水平,结果显示Cx43-shRNA1的敲降效率最佳(P<0.01)。见图1。因此选择Cx43NC(MOI=60)和Cx43-shRNA1(MOI=60)慢病毒进行后续实验。

A:不同MOI下病毒感染效率(标尺为100 μm);B:不同干扰慢病毒的敲降效率验证。①: Control; ②: NC; ③: shRNA1; ④: shRNA2; ⑤: shRNA3
2.2 敲降ASC中Cx43表达后,hemin诱导的细胞凋亡减少,铁死亡增加
与对照组相比,hemin处理ASC引起细胞凋亡和铁死亡比例显著增加(P<0.01),细胞凋亡相关指标Bax/Bcl-2和c-Caspase3/Caspase3显著升高(P<0.01),铁死亡负相关指标GPX4和GSH含量显著降低(P<0.01);与hemin处理组和Cx43NC+hemin组相比,Cx43KD+hemin组凋亡细胞比例显著降低(P<0.05),细胞凋亡相关指标Bax/Bcl-2,c-Caspase3/Caspase3和铁死亡负相关指标GPX4和GSH表达量显著降低(P<0.01和P<0.05),铁死亡正相关指标ROS和MDA的产生显著增加(P<0.05),细胞铁死亡比例显著升高(P<0.05)。见图2。说明敲降ASC中Cx43表达后,细胞对hemin诱导的凋亡具有抵抗作用,而对铁死亡更敏感。


A: 蛋白印迹检测细胞凋亡和铁死亡相关蛋白表达及灰度分析; B: Tunel染色结果及凋亡细胞百分比(标尺为100 μm); C: LDH释放实验测得细胞铁死亡率及铁死亡相关指标检测结果。①: Control; ②: Vehicle; ③: hemin; ④: Cx43NC+hemin; ⑤: Cx43KD+hemin
2.3 生信分析提示Cx43通过TEAD3调控铁死亡
热图所示GTEx正常人脑组织转录组数据库中,Cx43高/低表达的样本拥有截然不同的基因特征(图3A),因此,利用此分组信息进行差异基因表达分析,发现有677个基因表达上调,872个基因表达下调(图3B);利用差异表达基因的倍数变化信息,并使用基因注释基因集对其进行基因集富集分析(图3C),得出Cx43与Hippo信号通路、铁离子结合基因集、脂质过氧化通路、缺氧应激等通路显著相关,提示Cx43可能参与调控脂质代谢以及铁死亡。进一步利用R语言RTN包进行转录因子调控网络分析(图3D、3E),得出TEAD转录因子家族中TEAD3富集结果具有统计学意义,提示TEAD3可能参与调控Cx43相关性下游信号转导通路。
2.4 ASC中Cx43敲降引起YAP核转位
对照组中YAP基本均表达于胞质内,hemin处理组少部分细胞出现YAP核转位,在Cx43KD组中可见大量的细胞存在YAP核转位现象(图4中白色箭头)。提示敲降ASC中Cx43会抑制Hippo信号通路,触发YAP核转位。
2.5 Verteporfin处理逆转Cx43敲降引起的细胞凋亡抵抗和铁死亡增敏
与Cx43KD+hemin处理组相比,Cx43KD+hemin+Vp处理组细胞凋亡率增高而细胞铁死亡率降低(图5),提示Cx43敲降对细胞凋亡和铁死亡的影响被部分逆转。

A: GTEx正常人脑组织转录组数据库中Cx43表达热图; B: Cx43高/低表达组差异基因表达分析火山图; C: 基因集富集分析; D~E: 转录因子调控网络分析

①: Control; ②: Vehicle; ③: hemin; ④: Cx43NC+hemin; ⑤: Cx43KD+hemin。标尺为75 μm

A: Tunel染色结果及凋亡细胞百分比; B: LDH释放实验测得细胞铁死亡率。①: Cx43NC+hemin; ②: Cx43KD+hemin; ③: Cx43KD+hemin+Vp
3 讨论
ASC是中枢神经系统内最重要且数量最庞大的支持细胞。ASC之间通过Cx43介导的细胞间缝隙连接形成离子和代谢物偶联,对于维持组织细胞稳态具有重要作用[16-19]。研究表明,ASC在遭受创伤、炎症、肿瘤等情况下发生活化,伴随着Cx43表达水平及其通道功能改变。
前期研究发现,Cx43介导的通道功能对于细胞凋亡和铁死亡具有重要影响:脑出血背景下Cx43 GJIC功能下降,Cx43半通道出现异常开放。维持Cx43 GJIC功能有助于缓解细胞外微环境中Fe2+负荷,并通过健康细胞向受损细胞输送GSH以及代谢底物等帮助受损细胞免于铁死亡及凋亡。ASC在遭受hemin引起的氧化应激损伤后,半通道异常开放会导致细胞膜通透性增加,细胞内的ATP外溢以及细胞外Ca2+内流,激活一系列炎症反应并引起细胞凋亡,阻断半通道有助于保护细胞免于凋亡(数据未在本文中显示)。
由于Cx43具有GJIC和半通道功能以及非通道相关的基因表达调控等多种功能,Cx43 GJIC和半通道在脑出血后继发损伤中具有截然不同的作用,为了探讨Cx43的基因表达调控功能在脑出血后继发性损伤中的作用及机制,本研究采用干扰慢病毒敲降ASC中Cx43表达,从而观察ASC对hemin诱导的凋亡和铁死亡的反应。结果显示敲减ASC中Cx43表达后,细胞对hemin诱导的细胞凋亡抵抗能力增强,而铁死亡敏感性增高。然而,Yu等[22]在顺铂诱导的急性肾损伤模型中发现,敲降Cx43表达可以抑制肾小管上皮细胞凋亡和铁死亡,但具体机制不明。这与本研究关于敲降Cx43对细胞铁死亡的影响存在分歧,可能是由于所研究的组织细胞类型以及Cx43基础表达水平差异有关。
为了研究Cx43与铁死亡的相关性及Cx43调控铁死亡的分子机制,本研究进行了GSEA分析,结果显示Cx43与铁代谢、脂氧合酶以及Hippo信号通路密切相关,并且极有可能通过Hippo通路中的TEAD3调控细胞铁死亡。Hippo通路是感知细胞外基质硬度和介导细胞接触抑制的重要信号通路,参与调控组织器官发育。YAP是Hippo通路的关键效应分子,Hippo通路的失活使原本被磷酸化而锚定于胞质中的YAP得以释放从而进入细胞核,与核内的TEAD结合形成转录复合体,调控间充质表型转化、细胞增殖及抗凋亡相关基因的表达[23]。本研究通过YAP免疫荧光染色对生信分析结果进行验证,结果发现敲降ASC中Cx43表达后出现YAP核转位,且采用YAP抑制剂可以逆转Cx43敲降对细胞凋亡和铁死亡的影响。证实了Cx43可以通过Hippo通路调控细胞凋亡和铁死亡。
在本课题组前期研究中发现,Cx43与YAP存在共定位,Cx43敲降可以触发YAP核转位,与TEAD结合启动ASC间充质表型转化[20]。本研究利用Tunel染色发现敲降Cx43表达的ASC表现出对hemin诱导的细胞凋亡的抵抗效应。然而通过检测细胞坏死及GPX4含量发现,敲降Cx43的表达增加了ASC对hemin诱导的铁死亡的敏感性。在肿瘤领域,大量研究表明间充质表型转化的肿瘤细胞增殖、迁移及抗凋亡能力增强。但最新研究表明,间充质表型的肿瘤细胞反而对铁死亡的耐受性降低,可能与Hippo通路调控NADH氧化酶NOX以及脂氧合酶LOX表达促进细胞膜脂质过氧化损伤有关[15,24-26]。本研究发现敲降ASC中Cx43表达后细胞对hemin诱导的铁死亡敏感性增加。基于前期Cx43敲降触发了YAP核转位的研究发现,结合本研究中的生信分析,提示Cx43敲降极有可能通过抑制Hippo通路,促进YAP核转位,与TEAD3结合形成转录复合体,调控细胞表型转化、抗凋亡和调控LOX、NOX等促铁死亡基因的表达而实现。本研究为后续进一步探讨Cx43调控细胞凋亡和铁死亡的机制提供了重要线索。

