淹水胁迫对开花期小麦生理生化特征的影响
申长卫,吴婷婷,陈新茹,宋艳艳,周值乐,欧行奇
(1.河南科技学院资源与环境学院,河南 新乡 453003;2.河南科技学院生命科技学院,河南 新乡 453003)
小麦在世界上分布很广泛,从北极圈附近直至南美洲大陆的南部之间的广大地区都有种植.我国是世界上最大小麦生产国,全国各地都种植小麦,其中尤以河南、山东两省种植最多.小麦在生长过程中往往受到各种自然灾害的影响,其中涝害是全球许多国家所面临的重大自然灾害之一.据统计,世界范围内受涝渍灾害影响的耕地面积大约占耕地总面积的12%[1].在中国,涝渍地主要集中在长江中下游地区及黄淮海平原地区,占全国总涝渍地的75%以上[2].
国外研究者更多关注在小麦苗期和灌浆期植物的根系和地上部分对涝灾的响应[3-4],研究者们认为植物为适应淹水环境,形成了在解剖学、形态学和生理学上一套新机制[5],包括通气组织的产生、不定根的形成、叶柄速度伸长、茎肥大、下胚层生长、增加株高、气孔关闭、蒸腾减少和抑制光合作用等[6-8],国内学者认为小麦生育期无论受淹水时间长短,均会使粒质量和产量下降[9].拔节期-灌浆期是小麦生长发育的重要时期,也是小麦对涝害的敏感时期,此时易导致根系发育不良,活力衰退,叶片光合受阻,影响成熟期干物质积累,从而降低穗粒数和千粒质量,导致产量降低[10-11].近些年研究淹水胁迫对植物的影响,了解植物的抗涝性,选育耐淹能力强的品种用于黄淮海平原及其他涝渍灾害频发地区成为首要任务,这对当地农业的健康安全可持续发展具有重要意义.
至今,国内外学者关于涝害对小麦产量和品质的影响已有较多研究,但不同生育期淹水对小麦产量和品质影响的研究结果不同,且研究多集中在苗期和抽穗期,有关花期涝害胁迫对小麦生长发育及不同耐涝资源比较的报道较少.因此本研究以耐淹性不同的两种小麦品种周麦22(ZM22,不耐淹型)和百农607(BN607,耐淹型)为试材,通过盆栽试验,在小麦开花期设置3 d的淹水处理和不淹水处理,研究淹水处理后1 d、3 d和7 d对两种基因型小麦老叶和旗叶叶绿素含量的影响,同时重点分析处理后对两种小麦各部位(根系、老叶、旗叶、籽粒)中糖分含量及乙醇脱氢酶(ADH)活性的影响.本研究旨在为小麦耐涝选育提供参考依据,并进一步完善涝害对小麦生长发育的影响.
1 材料与方法
1.1 试验材料
试验于2021年4月至6月在河南科技学院资源与环境学院试验地进行,本试验选取两种耐淹性不同的小麦品种周麦22(ZM22,不耐淹型)和百农607(BN607,耐淹型)为试验材料,在小麦拔节期选取大小、长势基本一致的麦苗移栽到温室盆中,每盆留小麦苗5株.试验土壤选取河南科技学院东区试验基地0-20 cm土壤-砂质中壤土,其土壤理化性质:碱解含氮量为43.75 mg/kg,含速效磷量为10.85 mg/kg,含速效钾量为115 mg/kg,含有机质量为1.64%,pH值为7.46.土壤经过2 mm筛后混匀,试验盆钵选用聚乙烯塑料桶,桶底中央须设有排水孔,淹水处理时另外再套一个无排水孔的塑料桶,每盆装土质量为3 kg.
1.2 试验设计
试验共设置两个处理:从小麦盛花期开始进行3 d的淹水处理(W),同时以不淹水处理(CK)作为对照.淹水处理时向花盆中注水,水面超过土壤表面至少5 cm,每隔4 h补水到统一刻度,模拟淹水处理3 d.每个处理都设置3次生物学重复.分别采集淹水处理和不淹水处理3 d后1 d、3 d和7 d时(从小麦盛花期到灌浆初期)小麦的根系、老叶、旗叶和籽粒样品,其中小麦盛花期已出现发育的籽粒.采集一部分鲜样放于4℃冰箱中用于测定老叶和旗叶的叶绿素含量,另外采集小麦各部位(根系、老叶、旗叶和籽粒)新鲜样品用于糖分含量和乙醇脱氢酶(ADH)活性的测定.
1.3 指标测定
1.3.1 叶绿素a(Chl a)、叶绿素b(Chl b)和总叶绿素(Chl a+b)含量的测定
(1)取小麦老叶和旗叶新鲜叶片,擦净叶片表面污物,去除大叶脉,剪碎组织;
(2)每个处理称取3份已经剪碎的新鲜样品各0.100 g,分别置于试管中.每个试管加入5 mL 95%乙醇,使样品完全浸泡在乙醇溶液中.置于暗处浸泡24 h;
(3)24 h后将叶绿素色素提取液加入酶标板中,以95%的乙醇为对照调零,在波长665 nm和649 nm下测定吸光度;
(4)分别计算叶绿素a和b的质量浓度(mg/L),a+b即得叶绿素总质量浓度.
公式如下

式(1)和(2)中:Ca、Cb分别为叶绿素a和b的质量浓度.叶绿素a、b在95%乙醇中最大吸收峰的波长分别为665 nm和649 nm,A665和A649分别表示叶绿素a和叶绿素b的吸光度.
(5)求得色素的质量浓度后,再计算组织中各色素的含量
含叶绿体色素量/%=(色素浓度×提取液体积)/样品鲜质量×100.
1.3.2 可溶性糖的测定
(1)从每个处理中取0.100 0 g组织鲜样(根系、老叶、旗叶和籽粒),加1 mL的蒸馏水研磨,粗提液全部转移到EP管中,12 000 r/min,常温离心10 min,上清液待测.
(2)样品制备好后,采用酶标仪,调节波长到340 nm,测定不同混合反应下样品的吸光值.
(3)结果计算

式(3)、(4)、(5)中:∆A蔗糖=(A2-A1)测定管M-(A2-A1)对照管M;∆A葡萄糖=(A2-A1)测定管N-(A2-A1)对照管N;∆A果糖=(A3-A2)测定管N-(A3-A2)对照管N;D,稀释倍数;W,样本质量.
1.3.3 乙醇脱氢酶酶活性的测定
(1)分别称取小麦根、老叶、旗叶和籽粒约0.100 0 g,加入1 mL提取液,提取时尽量在冰上进行.4℃离心20 min,上清液待测.
(2)样品制备好后,采用酶标仪,调节波长到340 nm,蒸馏水调零,分别测定空白管和测定管中样品的吸光值.
(3)空白管:在96孔板(UV板)中依次加入20μL蒸馏水、160μL试剂一和20μL试剂三,迅速混匀后于340 nm测定吸光值变化,分别记录15 s和75 s时吸光值,分别记为A1和A2,∆A空白管=A1-A2.
(4)测定管:在96孔板(UV板)中依次加入20 mL上清液、160μL试剂一和20μL试剂三,迅速混匀后于340 nm测定吸光值变化,分别记录15 s和75 s时吸光值,分别记为A3和A4、∆A测定管=A3-A4.
(5)使用96孔板按样本质量计算:
活性单位定义:25℃中每克组织每分钟氧化lμmol NADH为1个酶活单位.

1.4 数据分析
采用Microsoft Excel 2007进行数据整理;采用SPSS18.0进行方差分析并通过单因素方差分析(ANOVA)进行差异显著性分析,以不同小写字母表示达到P<0.05显著差异水平;采用Duncan's multiple range test法进行显著性检验.
2 结果与分析
2.1 两种基因型小麦叶片中叶绿素含量对淹水胁迫响应的差异
淹水胁迫对两种基因型小麦叶片中叶绿素含量的影响如图1所示.
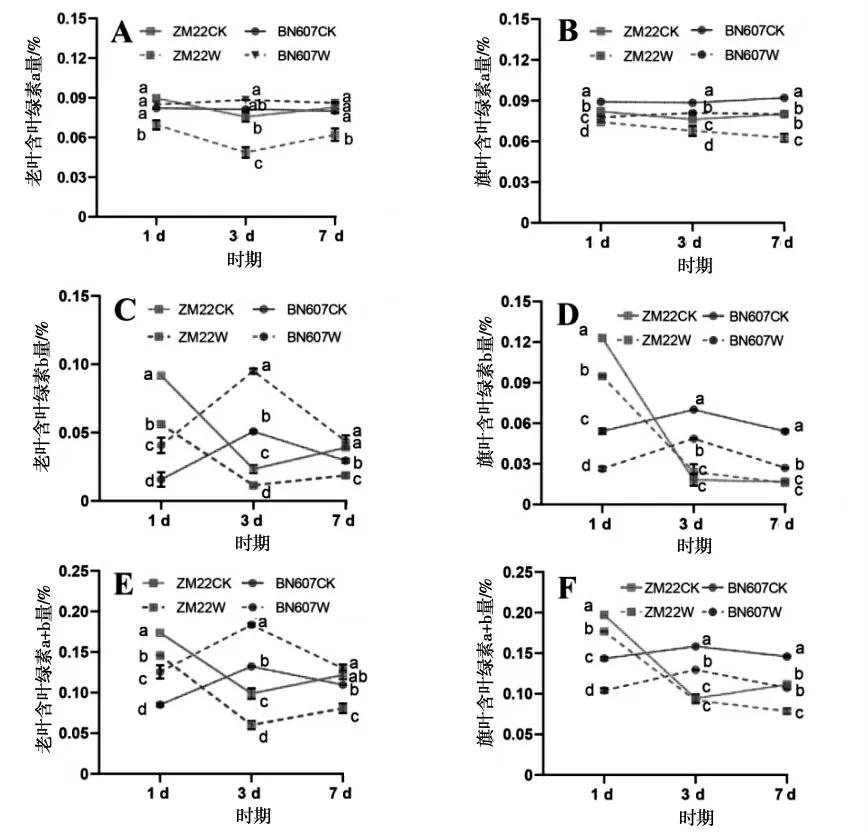
图1 淹水胁迫对小麦叶片中叶绿素含量的影响Fig.1 Effects of waterlogging stress on chlorophyll content in wheat leaves
由图1可以看出,淹水处理后1 d、3 d和7 d时,ZM22老叶中叶绿素a、叶绿素b和叶绿素a+b的含量都显著低于对照处理,而BN607老叶中叶绿素a、叶绿素b和叶绿素a+b的含量都显著高于对照处理(图1-A、图1-C和图1-E).淹水处理后1 d、3 d和7 d时,ZM22和BN607旗叶中叶绿素a含量相比对照处理都显著降低,其中7 d时ZM22和BN607旗叶中含叶绿素a量相比对照处理分别显著降低27.59%和15.00%(图1-B).淹水处理后1 d、3 d和7 d时,BN607旗叶中含叶绿素b量相比对照处理都显著降低,分别下降105.30%、43.74%和100.37%,而淹水处理后3 d和7 d时,ZM22旗叶中叶绿素b含量与对照处理差异不显著(图1-D).淹水处理后1 d、3 d和7 d时,BN607旗叶中叶含绿素a+b量相比对照处理都显著降低,分别显著下降37.75%、22.22%和36.10%.淹水处理后1 d和7 d时,ZM22旗叶中含叶绿素a+b量相比对照处理都显著降低,分别下降11.54%和41.73%(图1-F).
2.2 两种基因型小麦各部位糖分含量对淹水胁迫响应的差异
2.2.1 淹水胁迫对小麦根系中糖分含量的影响
淹水胁迫对两种基因型小麦根系中糖分含量的影响如图2所示.
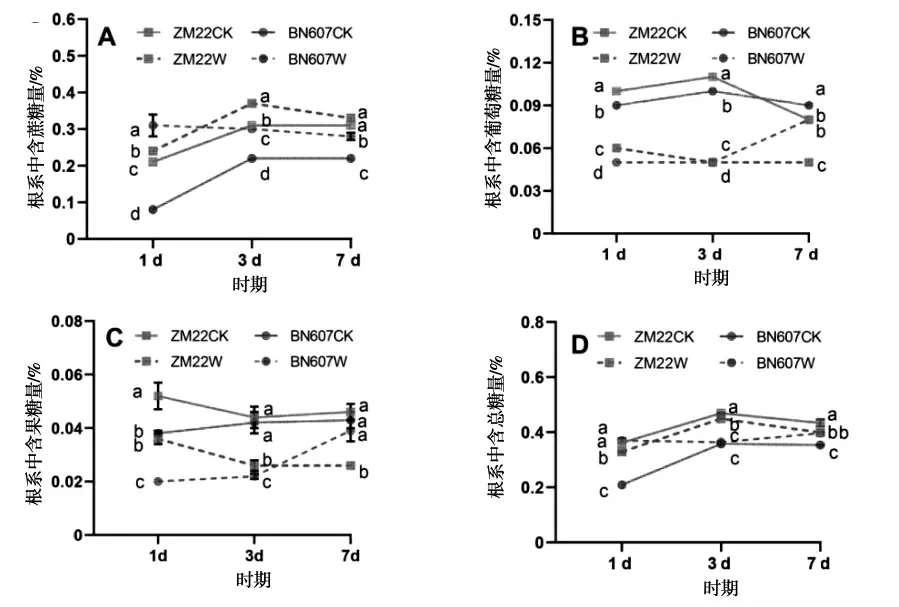
图2 淹水胁迫对小麦根系中糖分含量的影响Fig.2 Effects of waterlogging stress on sugar content in wheat roots
由图2可以看出,淹水处理后1 d、3 d和7 d时,BN607根系中含蔗糖量相比对照处理分别显著提高72.00%、27.00%和22.00%.淹水处理后1 d和3 d时ZM22根系中含蔗糖量相比对照处理分别显著提高12.00%和16.00%.淹水处理后ZM22和BN607根系中含葡萄糖量都显著低于对照处理.淹水处理后7 d时,ZM227和BN607根系中葡萄糖含量相比对照处理分别显著降低63.84%和14.89%.淹水处理后1 d和3 d时,ZM22和BN607根系中果糖含量相比对照处理都显著降低.整体来看,淹水处理后1 d、3 d和7 d,ZM22根系中总糖含量都显著低于对照处理,而除了淹水处理3 d外,其他两个时期时BN607根系中总含量糖都显著高于对照处理.
2.2.2 淹水胁迫对小麦老叶中糖分含量的影响
淹水胁迫对两种基因型小麦老叶中糖分含量的影响如图3所示.
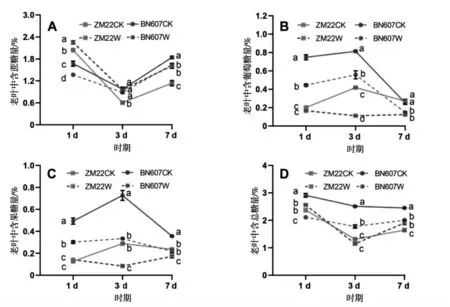
图3 淹水胁迫对小麦老叶中糖分含量的影响Fig.3 Effects of waterlogging stress on sugar content in old leaves of wheat
由图3可以看出,淹水处理后1 d、3 d和7 d时,ZM22老叶中蔗糖含量显著高于对照处理,而除淹水处理后3 d外,其他时期BN607老叶中含蔗糖量显著低于对照处理,分别显著降低18.25%和10.97%(图3-A).淹水处理后1 d、3 d和7 d时,BN607老叶中含葡萄糖量相比对照处理分别显著降低40.64%、31.57%和41.67%,除淹水处理后1 d外,其他时期ZM22老叶中含葡萄糖量相比对照处理分别显著降低73.44%和54.07%(图3-B).淹水处理后1 d、3 d和7 d时,BN607老叶中含果糖量相比对照分别显著降低38.74%、54.06%和38.76%,淹水处理后3 d和7 d时,ZM22老叶中含果糖量相比对照处理分别显著降低70.93%和27.54%(图3-C).整体来看,淹水处理后BN607老叶中含总糖量显著低于对照处理,分别显著降低27.47%、29.27%和18.16%,而淹水处理后1 d和3 d时ZM22老叶中总糖含量与对照处理差异不显著(图3-D).
2.2.3 淹水胁迫对小麦旗叶中糖分含量的影响
淹水胁迫对两种基因型小麦旗叶中糖分含量的影响如图4所示.
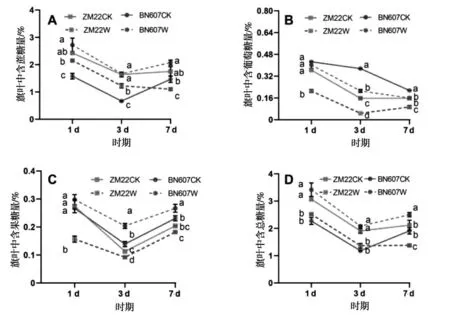
图4 淹水胁迫对小麦旗叶中糖分含量的影响Fig.4 Effects of waterlogging stress on sugar content in flag leaves of wheat
由图4可以看出,淹水处理后1 d、3 d和7 d时,ZM22旗叶中蔗糖含量和果糖含量都显著低于对照处理,而BN607旗叶中蔗糖含量和果糖含量却都显著高于对照处理(图4-A和图4-C).淹水处理后1 d、3 d和7 d时,ZM22旗叶中含葡萄糖量相比对照处理分别降低42.19%、69.62%和40.51%,BN607旗叶中含葡萄糖量相比对照处理分别降低5.63%、43.62%和25.58%(图4-B).总体来看,淹水处理后1 d、3 d和7 d时,ZM22旗叶中含总糖量相比对照处理分别降低17.87%、28.53%和34.91%,而BN607旗叶中含总糖量相比对照处理分别显著增加50.59%、76.60%和31.05%(图4-D).
2.2.4 淹水胁迫对小麦籽粒中糖分含量的影响
淹水胁迫对两种基因型小麦籽粒中糖分含量的影响如图5所示.
由图5可以看出,淹水处理后1 d、3 d和7 d时,ZM22籽粒中含蔗糖量相比对照处理分别显著提高133.22%、121.63%和45.50%,BN607籽粒中含蔗糖量相比对照处理分别提高68.80%、45.86%和22.46%(图5-A).淹水处理后1 d、3 d和7 d时,BN607籽粒中含葡萄糖量相比对照处理分别显著提高12.15%、9.87%和8.44%,而ZM22籽粒含葡萄糖量相比对照处理分别降低54.51%、28.57%和2.10%(图5-B).淹水处理后1 d、3 d和7 d时,BN607籽粒中果糖含量相比对照处理差异不显著.淹水处理后3 d时,ZM22籽粒含果糖量相比对照处理显著降低17.02%(图5-C).整体来看,淹水处理后ZM22和BN607籽粒中总糖含量相比对照处理都显著提高,淹水处理后1 d、3 d和7 d时,ZM22籽粒中含总糖含量相比对照处理分别显著提高20.88%、26.11%和17.16%,BN607籽粒中含总糖量相比对照处理分别显著提高5.43%、20.98%和17.73%(图5-D).
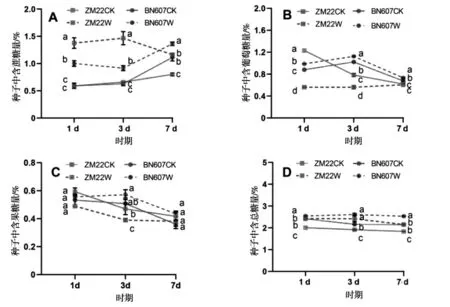
图5 淹水胁迫对小麦籽粒中糖分含量的影响Fig.5 Effects of waterlogging stress on sugar content in wheat grain
2.3 两种基因型小麦各部位ADH酶活性对淹水胁迫响应的差异
淹水胁迫对两种基因型小麦各部位ADH酶活性的影响如图6所示.
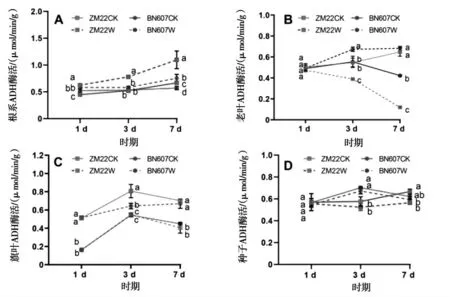
图6 淹水胁迫对小麦各部位ADH酶活性的影响Fig.6 Effects of waterlogging stress on ADH enzyme activity in various parts of wheat
由图6可以看出,淹水处理后1 d、3 d和7 d时,ZM22根系中ADH酶活性相比对照处理分别显著提高39.60%、48.95%和64.32%,而BN607根系中ADH酶活性相比对照处理差异不显著(图6-A).除淹水处理后1 d外,其他两个时期中ZM22老叶中ADH酶活性相比对照处理分别显著降低28.88%和81.79%,而BN607老叶中ADH酶活性相比对照处理分别显著提高21.70%和61.61%(图6-B).淹水处理后1 d、3 d和7 d时,ZM22旗叶中ADH酶活性相比对照处理分别显著降低68.30%、31.97%和42.31%,而BN607旗叶中ADH酶活性相比对照处理分别显著提高215.95%、18.60%和49.33%(图6-C).淹水处理后ZM22籽粒中ADH酶活性相比对照处理逐渐降低,淹水处理后7 d时,相比对照处理显著降低15.29%,而BN607籽粒中ADH酶活性相比对照处理差异不显著(图6-D).
3 结论与讨论
叶绿素不仅是吸收和运输光能的载体,同时也是电子传递过程中不可或缺的电子传递体,其含量的高低可以反映光合能力与叶片的生长状况[12].通常情况下淹水胁迫会造成植物叶绿素含量的下降,但有研究表明淹水初期叶绿素含量及其相关组分会上升,这是植物增强耐涝性的表现[13].本研究发现淹水处理后造成ZM22老叶中叶绿素a、叶绿素b、叶绿素a+b的含量以及旗叶中叶绿素a含量的严重下降,BN607旗叶中叶绿素a、叶绿素b、叶绿素a+b的含量都下降,但是BN607老叶中叶绿素a、叶绿素b、叶绿素a+b的含量反而都上升.说明两种耐淹性不同的小麦不同部位叶片响应淹水胁迫的内在反应存在差异.有研究表明不同品种之间叶绿素含量响应淹水胁迫下存在差异[14],尤其是叶绿素b,它主要起到与捕光蛋白复合体结合收集光能的作用[15],这也进一步说明在淹水胁迫下,相比ZM22品种,BN607品种的老叶在维持叶片光合结构,提升光合能力方面起着重要作用.
植物体内糖分含量的变化是植物适应淹水胁迫的重要指标.蔗糖是植物地上部光合作用的产物,同时它要经由韧皮部运输到根系,是根系生长和呼吸代谢的物质基础[16].在根系有氧呼吸代谢过程中,蔗糖经由糖酵解和三羧酸(TCA)循环等途径被分解为简单物质.但在缺氧环境下,电子受体(氧)缺少导致电子传递受阻,抑制ATP合成和氧化型辅酶再生.ATP是根系细胞分裂、矿质营养吸收同化和运输等众多生理代谢的能量基石.蔗糖的合成和分解受阻就会影响到ATP的供给[17].有研究表明在氧化磷酸化受阻的情况下,氧化型辅酶再生减少使糖酵解和TCA循环受到抑制,导致小麦植株中非结构性碳水化合物(如蔗糖)大量积累.有研究发现渍水3 d后小麦地上部分蔗糖含量提高2倍,渍水6 d后根系中蔗糖含量提高4倍[18-19].本研究也发现淹水处理后两种耐淹性不同小麦根系中蔗糖含量都上升,但是BN607小麦根系中蔗糖含量相比对照增加幅度更高.淹水处理后两品种根系中的葡萄糖和果糖含量相比对照处理都降低.这进一步说明根系在受到淹水胁迫下蔗糖供应能力的多少对根系的生长和呼吸代谢起重要作用.本研究还发现淹水处理后老叶和旗叶中蔗糖含量存在相反的现象,淹水处理3d后ZM22老叶中蔗糖含量相比对照处理显著提高,旗叶蔗糖含量相比对照处理显著降低,而BN607老叶中蔗糖含量相比对照处理降低,旗叶中蔗糖含量相比对照处理显著提高.说明淹水胁迫下BN607旗叶中合成的蔗糖向下运输受阻,而老叶合成的蔗糖更多的向根系或者其他部位进行运输,这一点与前面提到的BN607旗叶中叶绿素a、叶绿素b、叶绿素a+b的含量都下降,但是BN607老叶中叶绿素a、叶绿素b、叶绿素a+b的含量反而都上升相一致.此外,还发现ZM22和BN607籽粒中蔗糖含量在淹水处理后都显著上升,这说明淹水胁迫下叶片合成的光合产物在向根系运输受阻后会加速向籽粒的转运.
ADH酶活性的高低可以判断植物对外界淹水环境下的适应能力.在缺氧环境下,植物体内会通过糖酵解过程直接生成ATP,但低氧环境下糖酵解过程所需的氧化型辅酶合成减少,所需的氧化型辅酶主要在无氧呼吸途径中由丙酮酸转化为乙醇的过程中合成,所以植物会提高丙酮酸脱羧酶(PDC)和ADH酶活性[20],以无氧呼吸维持细胞生长和代谢的能量供应[21].Da-Silva等[22-23]发现大豆幼苗淹水处理6 h后根系中ADH酶活性急剧上升.这与本研究中发现淹水处理3 d后ZM22根系中ADH酶活性显著高于对照处理相一致,但是淹水处理3 d后1 d和3 d时BN607根系中ADH酶活性与对照处理差异不显著.说明在遇到外界淹水胁迫时ZM22品种根系对外界不良环境比较敏感,根系需要消耗更多的能量物质(蔗糖)来维持生命活动.这一点也与淹水处理下ZM22根系中蔗糖含量的增幅小于BN607根系中蔗糖含量的增幅相吻合.此外,不同品种在淹水胁迫下ADH酶活性以及ADH基因的表达量都存在差异性,例如水稻KH139和TN14幼苗中淹水胁迫下,ADH1基因的相对表达量显著高于对照处理,而TN11、TK9和TNG71品种在淹水胁迫下幼苗ADH1基因的相对表达量差异不显著[23].本研究发现淹水处理下ZM22老叶和旗叶中ADH酶活性显著低于对照处理,而BN607老叶和旗叶中ADH酶活性显著高于对照处理,这说明在淹水胁迫下BN607品种相比ZM22品种叶片中能更多的提供所需能量物质.
总体来看,淹水胁迫下BN607更能较好地适应环境变化,而ZM22对淹水胁迫比较敏感.

