超声造影血流灌注定量参数与肿瘤组织氧分压相关性:实验研究
冯玉仪,何杨成,金 海,何 艳,胡志文,罗 琼,丘丹霞,柳建华
(华南理工大学附属第二医院超声医学科,广东 广州 510000)
肿瘤微环境对于治疗肿瘤具有重要作用。肿瘤组织内血管结构异常,细胞快速增长,导致肿瘤长期处于缺氧状态,组织氧分压(oxygen partial pressure,PO2)<10 mmHg[1],影响药物或放射治疗效果;同时肿瘤微环境又与肿瘤转移、复发等密切相关[2-3]。治疗前评估肿瘤微环境缺氧情况有助于制定个体化治疗方案。近年来,超声造影(contrast enhanced ultrasound,CEUS)快速发展,可实时、连续、多次观察活体肿瘤组织内的血流灌注情况,并能定量分析肿瘤组织血流灌注强度[4-6];其定量参数包括峰增强(peak enhancement,PE)、曲线下面积(area under curve,AUC)、肿瘤组织原始曲线增强上升斜率(Grad)及达峰时间(time to peak,TTP)等。本研究观察CEUS定量参数与肿瘤组织PO2间的相关性。
1 材料与方法
1.1 仪器与材料 GE LOGIQ E9超声诊断仪,内置造影时间-强度曲线(time-intensity curve,TIC)分析软件,配备ML6-15高频线阵探头。针式组织PO2测量仪主机购自上海塔望公司,PO2传感器购自德国Presens公司。CEUS造影剂脂氟显由陆军军医大学第二附属医院超声科研制,外观为乳白色凝乳状,核心气体为全氟丙烷,平均粒径2 μm,浓度为(4~9)×109/ml。微泡使用前由振荡器振荡45 s,CEUS用量为0.01 ml/kg体质量。HIF-1α抗体(NB100-105)购自NOVUS公司。
1.2 动物模型 30只雌性新西兰大白兔购自广东省实验动物中心,平均体质量(2.5±0.5)kg,在24~26℃和45%~55%湿度下饲养7天及以上再行接种。VX2肿瘤组织购自中山大学细胞库,于室温条件下将二代肿瘤组织切成小块(1 mm3),与无菌生理盐水混合形成VX2肿瘤组织悬浊液,取5 ml肌内注射至兔左后肢大腿外侧浅肌层。在植入瘤块后约第10天、肿瘤大小约10 mm时开始实验。本研究方案由华南理工大学实验动物委员会批准。
1.3 超声引导下置入组织PO2传感器 经耳缘静脉注入2%戊巴比妥钠20 mg/kg体质量麻醉荷瘤兔,待兔角膜反射消失后进行实验。侧卧位保定荷瘤兔,于左后肢外侧备皮、消毒、铺巾,以二维超声观察肿瘤大小、回声等基础情况;选择显示肿瘤最大切面,于超声引导下以组织PO2传感器进行穿刺,使传感器针尖位于肿瘤外周,保持针尖与探头平行,并以针尖标记观察切面,固定超声探头(图1)。
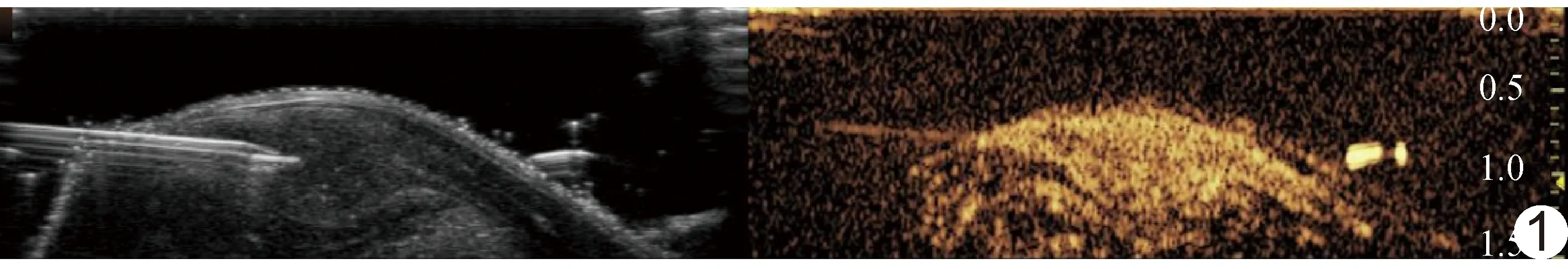
图1 超声引导下以组织PO2传感器穿刺荷瘤兔左后肢外侧肿瘤处,将针尖与探头平行切面作为CEUS观察切面
1.4 CEUS 选择造影模式,调节增益至仅可见包膜,深度为肿瘤下缘约1 cm,将焦点置于肿瘤下缘;自耳缘静脉注入造影剂,采集全程动态图像,观察肿瘤血流灌注(图1)。
1.5 测定组织PO2待肿瘤组织内造影剂廓清后,将PO2传感器套管针移至靠近肿瘤中心的ROI,将针尖内的PO2传感器推出,约10 s待数值平稳后进行取值;再将针尖和传感器整体推进至远离肿瘤中心的ROI,待数值平稳后进行取值,获得2个ROI的组织PO2。
1.6 TIC分析 以二维超声确定组织PO2传感器所在ROI的位置,通过设备内置造影分析软件进行TIC分析,分别获得2个ROI的血流灌注PE[PE=PI(peak intensity)-BI(base intensity)]、AUC、Grad及TTP(图2)。以0≤PE<10 dB为低灌注,10 dB≤PE<20 dB为中灌注,PE≥20 dB位高灌注。

图2 荷瘤兔肿瘤ROI区域TIC分析图
1.7 免疫组织化学染色 剥除肿瘤组织后以甲醛固定,行石蜡包埋、切片,按照说明书对肿瘤组织进行HIF-1α免疫组织化学染色。
1.8 统计学分析 采用Graphpad Prism 8.0统计分析软件。以Pearson相关性分析评价CEUS PE、AUC及Grad与肿瘤组织PO2的相关性;采用Spearman相关性分析评价TTP与PO2的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 二维超声 兔VX2肿瘤包膜完整,边界较清晰,平均长径(10.96±0.95)mm,短径(5.13±0.99)mm,内部回声多呈均匀实质性低回声;部分肿瘤内可见点状强回声钙化灶,少数可见不规则无回声区。
2.2 CEUS 兔VX2肿瘤CEUS呈“快进快出”模式,大部分在动脉期呈整体显著增强,部分肿瘤内因液化坏死而呈现充盈缺损;其TIC上升支陡直,快速达峰,后迅速下降,约2 min廓清。肿瘤内ROI的PE值范围为1.10~27.65 dB,坏死区PE值接近0;CEUS中,10个肿瘤ROI呈低灌注,35个呈中灌注,15个呈高灌注(图3A~3C)。
2.3 肿瘤组织PO2肿瘤组织内PO2分布不均,邻近血管区域PO2较高,远离血管区域PO2下降明显。60个肿瘤组织ROI 的PO2范围为0.39~10.49 mmHg,平均(3.98±2.62)mmHg(图3D~3F),坏死区域的组织PO2约为0。
2.4 HIF-1α免疫组织化学检查 经HIF-1α免疫组化染色后, VX2肿瘤组织中的棕褐色代表阳性表达。肿瘤组织内存在不同程度缺氧,且缺氧区域分布不均匀(图3G~3I)。

图3 荷瘤兔肿瘤CEUS、PO2及HIF-1α的免疫组织化学结果 A~C.分别为CEUS图示肿瘤组织呈低、中、高灌注(黄圈),PE值分别为2.04、15.93及25.75 dB;D~F.分别对应图A~C中黄圈区域组织的PO2,其测值分别为0.39、4.88及7.72 mmHg;G~I.分别为低、中、高灌注肿瘤组织HIF-1α免疫组织化学染色图(×20)
2.5 CEUS定量参数与肿瘤组织PO2的相关性 60个肿瘤组织ROI的 PE范围为1.10~27.65 dB,平均(15.19±6.25)dB;AUC范围为10.36~769.50 mm2,平均(315.10±202.90)mm2;Grad范围为0.05~2.71,平均1.02±0.50;TTP范围为6.68~56.52 s,平均(16.41±6.54)s。相关性分析显示,CEUS所示 PE、AUC及Grad与肿瘤组织PO2均呈正相关(r=0.822、0.638、0.445,P均<0.05),TTP与PO2无明显相关性(P=0.693)。
3 讨论
现有评估肿瘤组织缺氧程度方法主要分为直接测量法和间接测量法;前者又包括氧电极极谱法及荧光淬灭法,氧电极极谱法会消耗组织内氧气,无法重复测量。本研究采用的荧光淬灭法基于氧分子对荧光物质的淬灭效应进行测量,不消耗氧气,但仅适用于浅表肿瘤,且有创,探针会破坏肿瘤微环境而不能重复测量[7]。间接测量法种类繁多,主要检测缺氧指标,如缺氧特异性荧光探针法[8]、缺氧诱导因子HIF-1α免疫组织化学染色法[9]等;还包括影像学检测血流灌注,如利用18F标记FMISO PET扫描[10-11]、动态对比增强MRI(dynamic contrast enhanced MRI,DCE-MRI)[11-12]、灌注CT[13],以及利用氧合血红蛋白和脱氧血红蛋白不同的光学性质,通过光声成像测定组织中氧饱和度的光声成像系统等[14]。
治疗肿瘤具有氧依赖性,常常需要在不损伤组织的前提下获取肿瘤的氧合信息;而肿瘤组织PO2与血流灌注、组织耗氧等因素息息相关,血流灌注丰富区域缺氧程度相对轻,反之亦然[15],故定量分析肿瘤血流灌注情况可反映肿瘤微环境缺氧情况。在评估肿瘤微环境氧合情况的众多方法中,缺氧特异性荧光探针法、缺氧诱导因子HIF-1α免疫组织化学染色法仅能针对术后标本进行检测;光声成像受肿瘤深度限制。相比之下,无创成像技术用于初步评估肿瘤缺氧情况及程度具有巨大发展空间,CEUS可实时评估活体肿瘤内缺氧情况,是安全、简便、成本低且有效评估肿瘤内缺氧情况的方法,可重复性佳,易于推广,有助于临床根据肿瘤缺氧情况制定个体化治疗方案,以改善患者预后。
CEUS可动态、连续观察不同器官或肿瘤组织的血流灌注模式,通过定量分析CEUS曲线图可获得不同区域的血流灌注强度。考虑到肿瘤血流分布不均,本研究对每个瘤灶随机采集2个ROI,以评估其血流灌注情况,结果显示肿瘤PE值范围为1.10~27.65 dB(包括坏死区域)。为观察肿瘤血流灌注与组织PO2的关系,本研究测量CEUS取样相同区域肿瘤组织的PO2,发现其PO2范围为0.39~10.49 mmHg;相关性分析显示,CEUS 所示肿瘤组织PE与相应区域PO2的相关系数为0.822,AUC、Grad与相应区域PO2的相关系数分别为0.638和0.445,均呈正相关,与DCE-MRI[11-12]及灌注CT[13]观测结果相符。以上结果提示,定量分析CEUS曲线可为CEUS无创、精准评估肿瘤PO2提供科学依据;AUC、Grad与PO2的相关性稍弱,可能原因在于TIC参数中,AUC、Grad反映造影全过程,而PO2则为选定时间点的测值,也可能与样本量小有关。
本研究的局限性:①不同造影剂组织灌注时间存在差异,而本研究未能利用多种造影剂对组织氧合进行对比评估;②未能对肿瘤区域缺氧情况免疫组织化学结果与组织PO2测值进行点对点对比;③仅针对浅表肿瘤组织监测其PO2。有待后续进一步完善。
综上所述,CEUS定量参数PE、AUC及Grad与肿瘤组织PO2呈正相关;通过CEUS TIC分析和进一步拟合PE-PO2曲线方程,可推测肿瘤组织氧合情况,评估肿瘤组织是否缺氧及其程度。

