苦马豆素历史、来源及生物活性研究进展
黄睿杰,马永嘉,赵世姣,王 帅,吴晨晨,路 浩,赵宝玉*
(1.西北农林科技大学 动物医学院,陕西 杨凌 712100;2.阿拉善左旗动物疫病预防控制中心,内蒙古 阿拉善 750300;3.昌都市畜牧总站,西藏 昌都 854000)
苦马豆素(swainsonine,SW)是20世纪70年代由澳大利亚学者COLEGATE等[1]首次从有毒植物灰苦马豆(Swainsonacanescens)中分离出的毒性生物碱,并以其植物名称而命名。随后,众多研究证实苦马豆素是疯草(locoweed)类有毒植物的主要毒性成分,能够特异性的抑制动物有机体α-甘露糖苷酶的活性,当动物通过采食疯草而摄入一定量的苦马豆素后,可引起动物出现精神萎靡、运动障碍、共济失调等神经功能紊乱为特征的慢性中毒,以及母畜流产、死胎、公畜不育等生殖障碍,严重时导致动物死亡[2]。所谓疯草是指含有苦马豆素,且能引发采食动物出现疯草病(locoism)典型神经症状与病理变化的一类有毒植物的统称,主要涉及棘豆属、黄芪属、苦马豆属、番薯属和黄花稔属等植物,这类有毒植物广泛分布于世界各地的天然草地,尤其在中国、美国、加拿大、巴西和澳大利亚等国家的退化草地分布较为广泛,且形成优势种群,每年均有放牧家畜疯草中毒造成重大经济损失的报道[3-4]。然而,苦马豆素具有两面性,一方面作为疯草毒性成分使家畜中毒甚至死亡,影响畜牧生产,造成经济损失;另一方面作为植物体内次生代谢产生的天然产物,大量研究表明具有抗肿瘤、抗病毒和免疫调节等多种药理活性,已引起相关领域学者的研究兴趣[5]。苦马豆素从发现至今已经有40多年的历史,研究涉及学科领域十分广泛,包含兽医学、毒理学、植物学、微生物学、植物化学和临床医学等众多领域,特别是有关药理活性的研究已成为人们关注的热点[6]。现根据国内外苦马豆素相关研究文献,从其研究历史、来源、毒性与毒理及药理活性研究等方面进行综述,并对今后的研究方向作以展望,以期为人们较全面地掌握苦马豆素的历史、最新研究进展和科学认识苦马豆素的两重性提供理论参考。
1 苦马豆素研究历史
回顾苦马豆素的研究历史可追溯到20世纪70年代末,根据前人文献资料,可将苦马豆素的研究大致分为分离鉴定及来源研究、毒性与毒理确证和药理活性研究3个阶段。
第1阶段:苦马豆素分离鉴定及来源研究。起始于1979年COLEGATE等[1]从澳洲灰苦马豆中分离出生物碱并对其化学结构进行鉴定,并首次将该生物碱命名为“苦马豆素”(图1),这个极其有意义的发现,从此开始了苦马豆素物理特性、化学特性及来源的研究。苦马豆素化学命名为吲哚里西啶三醇,在吲哚里西啶环1,2,8碳位上各有1个羟基,故又被命名为1,2,8-三羟基八氢吲哚里西啶,属吲哚里西啶类生物碱,易溶于各种有机溶剂,具有极强的吸水性和水溶性。而有关苦马豆素的来源,截至目前主要有植物来源、微生物来源和人工合成3种途径。继从灰苦马豆中发现苦马豆素后,国内外学者陆续从斑荚黄芪(Astragaluslentiginosus)、密柔毛黄芪(Astragalusmollissimus)、变异黄芪(Astragalusvariabilis)、茎直黄芪(Astragalusstrictus)、兰伯氏棘豆(Oxytropislambertii)、绢毛棘豆(Oxytropissericea)、黄花棘豆(Oxytropisochrocephala)和小花棘豆(Oxytropisglabra)等黄芪属与棘豆属有毒植物中发现,并确证是其主要毒性成分,随后相继又从Ipomoeacarnea、Turbinacordata和Jacquemontiacorymbulosa等植物中发现苦马豆素,认为这类有毒植物是产生苦马豆素的主要植物来源[4,7]。SCHNEIDER和HINO先后在1982和1985年报道引起豆科牧草及植物黑斑病的豆类丝核菌(Rhizoctonialeguminicola)和具有广谱杀虫作用的金龟子绿僵菌(Metarhiziumanisopliae)具备产生苦马豆素的能力,打破了植物是苦马豆素唯一天然来源的观点。随后,大量文献报道疯草内生真菌(Undifiumnoxytropis)同样具备产生苦马豆素的能力,证实植物内生真菌也是产生苦马豆素的重要微生物来源[8]。随着苦马豆素药理活性的发现和研究的深入,从植物提纯或微生物发酵获取苦马豆素的数量有限,不能满足人们对苦马豆素药物研发的需求,由此推动了有机合成领域学者对苦马豆素化学合成的兴趣。1984年YASUDA人工全合成苦马豆素获得成功,这是历史上首次全合成苦马豆素的报道,之后国内外化学工作者相继研发苦马豆素人工合成新方法,为批量获取苦马豆素提供了崭新途径。
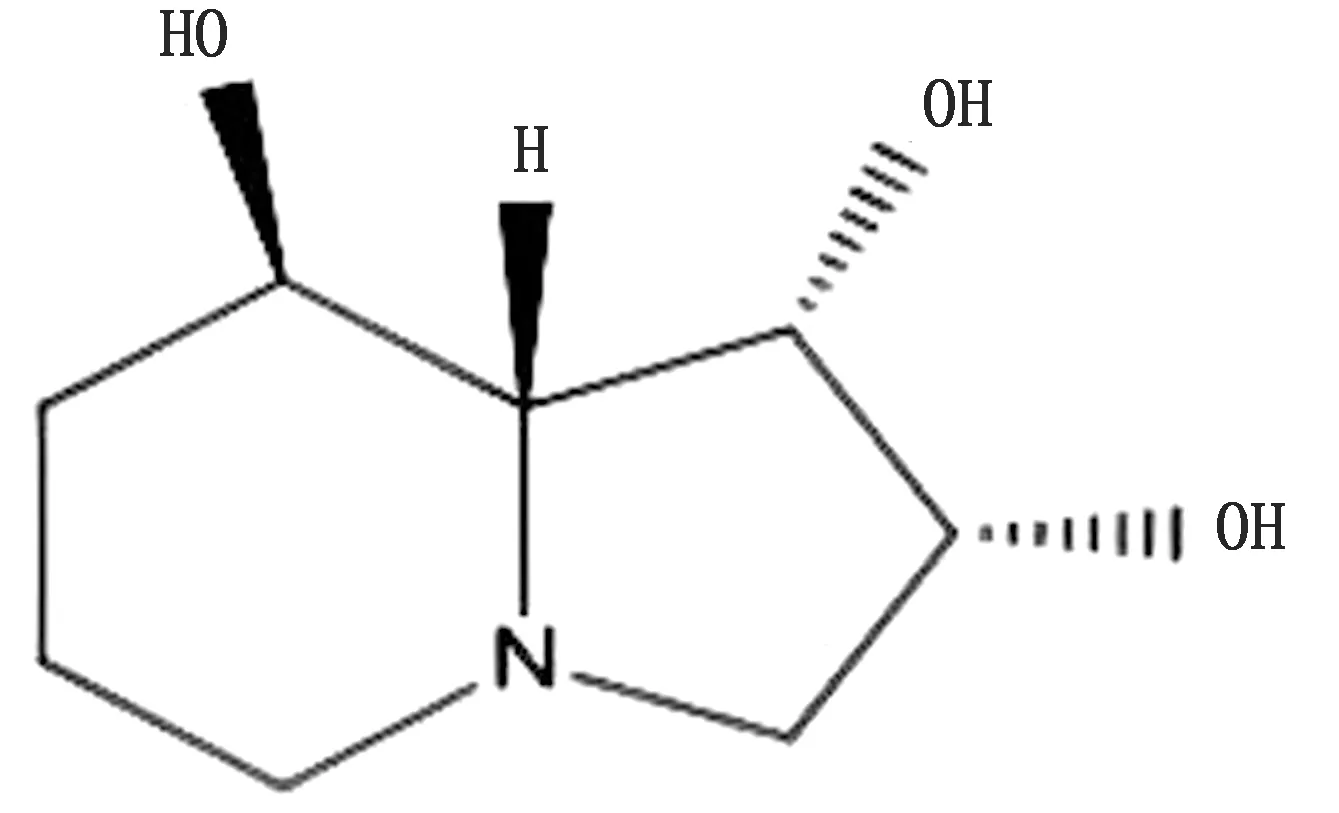
图1 苦马豆素分子结构式
第2阶段:苦马豆素毒性与毒理确证。纵观人类对苦马豆素毒性与毒理的研究历史,大致可分为整体及器官水平、细胞水平和分子水平3个研究层次。最早人们发现动物采食某些黄芪属或棘豆属有毒植物可出现神经功能紊乱、运动障碍、脏器衰竭、细胞空泡变性等疯草病典型表现。DORLING研究表明苦马豆素对细胞溶酶体α-甘露苷酶(α-mannosidase,AMAN)活性具有特异性抑制作用,随后又证实对高尔基体α-甘露糖苷酶Ⅱ、内质网/胞质体α-甘露糖苷酶活性也有抑制作用。MOLYNEUX在1982年证实,黄芪属或棘豆属有毒植物之所以能够造成动物中毒,且出现疯草病典型症状,其实质是这些植物所含苦马豆素在发挥主导作用。近年来人们对苦马豆素的毒理研究多集中在分子水平上,LU等[9]和WANG等[10]分别从细胞凋亡和细胞自噬角度,探究了苦马豆素致SD大鼠神经元细胞和原代肾小管上皮细胞损伤的分子机制,证明苦马豆素可通过诱导细胞凋亡和自噬而发挥毒性作用。
第3阶段:苦马豆素药理活性研究。该阶段始于20世纪80年代并一直延续至今。随着对苦马豆素毒性认识的深入,人们逐渐意识到单纯地将苦马豆素视为有毒化学物质的认知,既不全面也不科学,苦马豆素可能还是具备良好药理活性的天然药物,来治疗人类某种疾病。ELBEIN于1982年发现苦马豆素可阻止流感病毒血凝素低聚糖链的加工,从而发挥抗流感病毒的功效,这是首次发现苦马豆素具有抗病毒活性的报道;1985年HINO证实苦马豆素是免疫调节剂,能增强小鼠免疫系统活性;同年KINO首次证实苦马豆素可阻碍肿瘤细胞生长及转移,具有良好的抗肿瘤活性;BOWEN于1993年通过对苦马豆素体内药代动力学研究,测得血浆苦马豆素半衰期小于20 h;GOSS在1994年进行了苦马豆素治疗肿瘤患者Ⅰ期临床试验,对用药的有效性和安全性进行评估。近年来,有关苦马豆素其他方面的药理活性也相继被证实。苦马豆素研究历程中的重要发现见表1。

表1 苦马豆素研究历程
2 苦马豆素来源研究
大量研究表明,苦马豆素不仅具有毒性,而且还有很好的药理研究价值,同时也是作为糖代谢及其糖基化修饰研究领域工具酶α-甘露糖苷酶的特异性抑制使用,但由于苦马豆素产量低、价格昂贵等原因,限制着苦马豆素相关科研的进展。因此,人们对苦马豆素的来源展开研究,试图寻找一种成本低、产量大的苦马豆素获取途径。截至目前,苦马豆素的来源主要归纳为植物来源、微生物来源和人工合成3种途径。
2.1 植物源途径目前全世界已报道含苦马豆素的植物主要涉及豆科棘豆属、黄芪属、苦马豆属和沙耀花豆属,旋花科番薯属、盘蛇藤属和小牵牛属,锦葵科黄花稔属3科8属73种植物(表2)[2-3,11-24]。其中,含苦马豆素植物亚洲至少已探明黄芪属3种、棘豆属8种和苦马豆属1种;北美洲黄芪属22种和棘豆属4种;南美洲番薯属9种、黄芪属16种和黄花稔属2种;大洋洲沙耀花豆属9种和番薯属1种;欧洲至今没报道含苦马豆素的植物,虽然欧洲曾有马匹苦马豆素中毒的报道,但引发马匹中毒的植物并未查明;非洲至今未见含苦马豆素植物或疯草病病例的报道。不同种属的植物苦马豆素含量差异很大,全球范围内苦马豆素含量较高的植物有沃顿黄芪、密毛黄芪、萨珠肯氏黄芪、异色黄芪、变异黄芪、黄花棘豆和甘肃棘豆等,这些植物动物采食后可引起疯草病典型症状[17]。因此,有学者根据苦马豆素含量的不同,将疯草类有毒植物的种群分为2种化学类型,第1种类型是苦马豆素含量较高的疯草,动物采食后足以引起中毒甚至死亡;第2种类型是苦马豆素含量较低的疯草,动物采食后可引起轻度中毒,但很少引起死亡[25]。

表2 全世界已报道含苦马豆素植物种群分布

续表2
植物源苦马豆素可通过2种提取工艺获取。一是植物样品通过冷浸或热回流的生物碱传统工艺;二是在传统工艺基础上利用超声、微波、酶解等现代技术加以辅助。目前,国内苦马豆素的主流提取手段大致包括植物醇浸膏提取、醇浸膏酸化碱化、有机溶剂萃取、总生物碱正相或反相柱层析分离得到苦马豆素粗品,最后升华获得苦马豆素纯品[26]。国外学者多采用GARDNER等[27]报道的方法或改良版,即植物样品用氯仿和2%乙酸混合溶剂连续萃取、酸水液离子交换树脂、收集碱水液洗脱部分、碱水液氯仿连续萃取得到苦马豆素粗品,再经重结晶得到苦马豆素纯品。从植物中提取苦马豆素是目前最经典的获取方法,提取成本低、价格相对便宜,但提取周期长、提取率低,只适合小批量生产。
2.2 微生物源途径目前已报道能产生苦马豆素的微生物主要包括植物病原真菌豆类丝核菌、昆虫病原真菌金龟子绿僵菌以及疯草内生真菌3类,其中,产苦马豆素疯草内生真菌有7种[8,28-30](表3)。此外,LU等[30]采用薄层色谱与气相色谱在疯草根系土壤中分离到裂褶菌属(Schizophyllum)真菌的次生代谢物中检测到苦马豆素。余永涛等[31]从斜茎黄芪中分离到甘肃波状芽管孢(Undifilumgansuense)亦被证明产生苦马豆素,但其产苦马豆素能力要远弱于疯草内生真菌,因此直立黄芪没有被划分为疯草范畴。
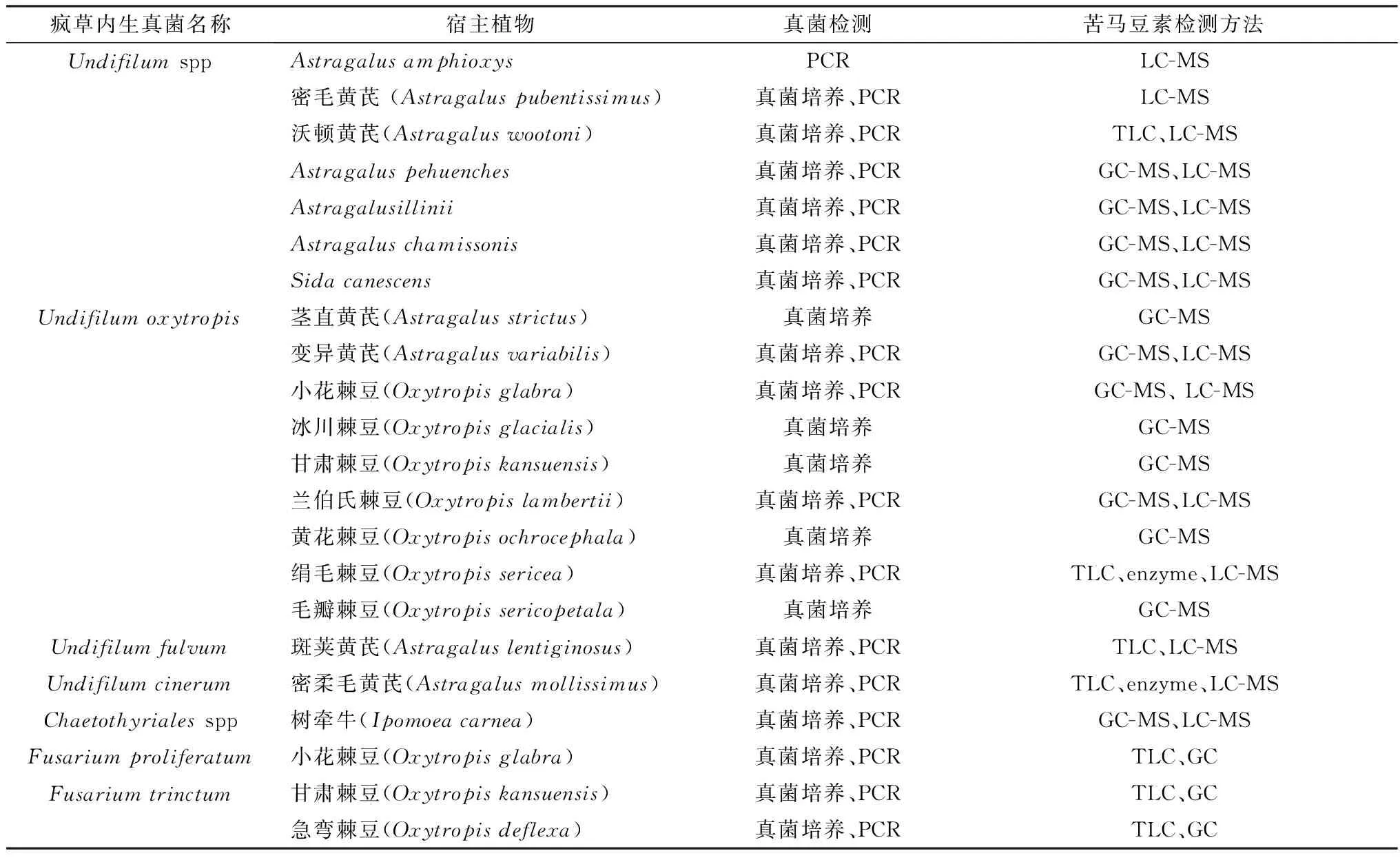
表3 已报道产生苦马豆素的疯草内生真菌种属及其宿主
为此人们对真菌合成苦马豆素的相关基因以及合成通路展开研究,目前已知真菌调控苦马豆素合成的相关基因主要有swnA、swnH1、swnH2、swnK、swnN、swnR、swnT和酵母氨酸还原酶基因等。COOK等[32]经过对比不同种属产苦马豆素真菌基因组,发现这些真菌都有1个由swnA、swnH1、swnH2、swnK、swnN、swnR、swnT等区域组成的高度同源基因簇,并将该基因簇命名为SWN,且证实swnK失活突变体不能产生苦马豆素,而当突变体和野生型基因互补后,则恢复苦马豆素合成的能力。萨如拉等[33]利用HPLC-MS技术分析了野生型OW7.8真菌和酵母氨酸还原酶基因缺失突变株M1真菌菌体内苦马豆素含量,结果显示前者苦马豆素含量高于后者,提示酵母氨酸还原酶在苦马豆素生物合成中起关键作用。与此同时,大量研究表明豆类丝核菌、金龟子绿僵菌和疯草内生菌苦马豆素生物合成途径各有不同,豆类丝核菌生物合成途径从L-赖氨酸起始,依次经酵母氨酸、α-氨基乙二酸半醛、6-羟基-哌啶酸(P6C)、哌啶酸、乙酸哌啶、1-酮基-吲哚里西啶、(1R,8aS)-羟基吲哚里西啶,再经羟化反应合成苦马豆素[34];金龟子绿僵菌以L-赖氨酸为前体,在酵母氨酸还原酶作用下生成酵母氨酸,酵母氨酸在酵母氨酸氧化酶作用下氧化生成哌啶酸或α-酮戊二酸,α-酮戊二酸经一系列反应生成α-氨基已二酸半醛,再通过非酶促环化反应形成哌啶酸,由哌啶酸转化为苦马豆素;疯草内生真菌生物合机制尚未完全探明,近期有研究推测苦马豆素生物合成途径有2条,即6-羟基-哌啶酸途径与2-羟基-哌啶酸途径[35]。利用真菌发酵获取苦马豆素具有提取效率高、条件易控制、产量大、溶剂消耗少、提取成本低、且绿色环保等优点,与传统制药相比,生物发酵制药是目前重点发展方向,若能与现代生物技术、酶工程技术、基因工程技术有机结合,培育出苦马豆素高产菌株,应用前景十分广阔。
2.3 人工合成途径苦马豆素显著地抗肿瘤、抗病毒及免疫调剂等药理活性,也引起化学界广泛的关注,但从植物提纯或通过微生物发酵获取苦马豆素的数量有限,不能满足人们对苦马豆素药物研发的需求,由此推动了苦马豆素化学合成研究的进程。YASUDA在1984年人工全合成苦马豆素获得成功,之后国内外化学工作者相继开展苦马豆素人工合成方法研究。聂礼飞于2009年对之前报道的人工合成苦马豆素方法进行系统总结,将它们分为经吲哚里西啶环合成、经二环内酰胺化合物合成、经环烯胺化合物合成和经吡喃酮化合物合成4类。2013年,DHAND在利用Huisgen反应获得关键中间体的基础上实现苦马豆素全合成,是当前所有路线中最短,全程仅6步反应,且使用的原料价格低,但反应条件要求较高。TRAJKOVIC等[36]利用氨基酸催化二恶烷酮衍生物发生还原胺化反应,从而制备苦马豆素,全程9步反应,用材低廉,条件要求宽松,总产率为24%。CHEN等[37]利用分枝型二环氮杂糖合成路线,通过9步反应,合成出苦马豆素及其衍生物6种类双环生物碱,总产率28%。
人工合成苦马豆素,虽然获取效率高,但苦马豆素分子有4个手性碳原子,合成时会产生大量手性异构体,手性全合成难度大,成本较高。自苦马豆素首次全合成以来,已报道超过40种化学合成路线,步骤从6~20步不等。回顾这些化学合成路线,不难发现都存在步骤长、原料昂贵、反应条件苛刻、分离难度大、总产率较低等局限,很难满足工业化生产的需求。因此找到一条合成步骤少、原料便宜、反应条件温和、总产率高、环境污染小的理想合成路线一直是化学工作者所追求的目标。将来随着新手性催化剂和反应的出现,适合工业化的苦马豆素及其衍生物的合成路线有望被发现,这将为探究苦马豆素与其衍生物药理活性提供极大便利。
3 苦马豆素毒性与毒理
3.1 毒性作用有关苦马豆素毒性作用的研究,前期已经做了大量的研究工作,从文献资料报道的结果看,主要分为整体器官水平和细胞与分子水平2个毒性作用层次。到目前为止已经证实苦马豆素具有神经毒性、生殖及发育毒性。动物种属不同其毒性表现存在差异,其中马、牛、羊对苦马豆素敏感性最高,而小鼠、鼠兔、家兔等啮齿类动物对其有一定耐受性[38]。
从整体器官水平看,动物苦马豆素中毒主要呈现慢性过程,典型临床症状表现为头部震颤、运动障碍、共济失调等神经症状,以及流产、死胎、精子卵子产生减少等生殖障碍,严重时引起动物死亡。血常规可观察到红、白细胞数、血红蛋白量以及红细胞比容下降,中期与后期外周血淋巴细胞或单核细胞出现空泡;血清中α-甘露糖苷酶活性降低,AST、ALT和ALP活性增强[24]。中毒动物组织病理学特征是神经细胞和实质器官细胞广泛的空泡变性,尤其是小脑浦肯野氏细胞变化最为明显[39]。大多数器官组织病变是可逆的,在动物停止摄入苦马豆素后不久就可消失,而神经组织的病理变化却是不可逆的。WU等[40]通过探究苦马豆素对小鼠生殖和发育的潜在毒性,发现随着染毒剂量的增加小鼠发情周期增长,发情次数减少,子代生殖能力明显降低,表明摄入一定剂量的苦马豆素可影响雌性动物的生殖功能以及胎儿发育;LIU等[41]研究发现妊娠母鼠苦马豆素染毒后,子代大脑海马齿状回的神经发育受到干扰,导致齿状回功能障碍,从而表现出运动和记忆功能紊乱。
随着细胞生物学和分子生物学技术的飞速发展,苦马豆素毒性作用研究也从传统的基于动物试验的整体器官水平迈向细胞和分子水平。LU等[9]用不同浓度苦马豆素处理体外培养的大鼠肝脏细胞,发现苦马豆素能显著降低AMAN活性、以及MAN2A1和MAN2B1 mRNA和蛋白水平表达,且呈时间-剂量效应关系,从而导致苦马豆素诱导的肝毒性损伤。WU等[42]以中国仓鼠卵巢细胞为模型,结果提示苦马豆素可经PI3K/AKT信号通路改变卵巢细胞17beta-雌二醇分泌。ZHENG等[43]通过探讨苦马豆素对大鼠心肌细胞凋亡的影响及其机制,研究表明苦马豆素可通过线粒体介导的信号通路诱导细胞凋亡。WANG等[10]证实苦马豆素可经PI3K/AKT/mTOR信号通路诱导原代肾小管上皮细胞发生自噬,揭示自噬在细胞空泡变性形成中发挥重要作用。
3.2 毒性作用机理苦马豆素水溶性极强,在酸性环境完全电离成阳离子,其半椅式构象和α-甘露糖苷酶底物结构相似,从而对α-甘露糖苷酶产生竞争性抑制作用。有学者认为苦马豆素极强特异性抑制作用离不开3个羟基的存在,推测顺式苦马豆素分子1号和2号碳羟基主要负责识别酶的糖基化阳离子,8号碳羟基提高与甘露糖苷酶底物的相似度[38]。α-甘露糖苷酶是一种糖苷水解酶,在人、鼠、牛、羊、昆虫等动物和植物真核细胞的溶酶体、内质网、高尔基体及胞浆中广泛存在,主要参与蛋白质糖基化和糖蛋白聚糖水解修饰,在低聚糖降解和糖蛋白成熟过程中发挥重要作用[44]。大量研究表明,苦马豆素通过抑制细胞溶酶体α-甘露糖苷酶、高尔基体α-甘露糖苷酶-Ⅱ和内质网/胞质α-甘露糖苷酶活性,使细胞内蛋白N-糖基化合成、加工、转运以及富含甘露糖寡聚糖代谢等过程发生障碍,造成细胞内低聚糖蓄积以及蛋白质糖基化修饰异常,影响细胞黏附、细胞迁移、细胞生长及细胞分化等生理病理过程,引起组织器官细胞发生空泡变性,导致动物机体各系统障碍,尤其是神经系统功能障碍[39]。由此可见,苦马豆素对α-甘露糖苷酶的特异性抑制作用,是苦马豆素发挥毒性作用及其机制的关键所在。
4 苦马豆素药理活性
苦马豆素在发现初期,人们研究的重点主要是关注其毒性,但随着对苦马豆素研究的深入,苦马豆素良好的药理活性逐渐被发现,截至目前,大量研究证实苦马豆素具有良好的抗肿瘤、抗病毒和免疫调节作用,是一种极具研发前景的天然药物,将来可用于人类某些疾病的治疗。
4.1 抗肿瘤活性癌症是全球范围内严重危害人类健康的疾病,据相关报道,2018年全球新增癌症超1 800万例,而中国癌症发病率和死亡率远高于世界平均水平,2015年我国新增癌症392.9万例,平均每分钟就有7.5例癌症确诊[45]。采用化疗、放疗等传统治疗手段对抗癌症副作用大,因此,寻找不良反应和毒性作用相对较小的天然抗癌药物,将为癌症的治疗提供新思路。高尔基α-甘露糖苷酶是N聚糖加工过程中的关键酶,抑制该酶是一种已知的抗癌策略,而苦马豆素作为该酶特异性抑制剂,自然是采取这种策略所选择的药物靶标。20世纪80年代,KINO首次证实苦马豆素能够抑制癌细胞生长、转移,随后人们注意到苦马豆素及其衍生物抗癌效果显著。路浩于2009年通过对苦马豆素抗肿瘤研究文献归纳,将苦马豆素抗肿瘤作用分为直接作用与间接作用。直接作用是指苦马豆素能够特异性抑制高尔基体中α-甘露糖苷酶Ⅱ,从而使癌细胞中糖蛋白、多糖等合成障碍,最终使肿瘤细胞死亡。同时,苦马豆素还可弱化癌细胞的黏附能力,并通过控制基因表达、改变钙离子浓度等诱导癌细胞凋亡,从而有效抑制肿瘤细胞生长,降低其浸润以及转移能力。间接作用是指苦马豆素能够增加动物淋巴细胞、巨噬细胞杀伤并抑制肿瘤细胞的能力,加强化疗药物治疗效果。近年来,苦马豆素一些新抗癌机制或抗癌效果陆续被发现,MA等[46]发现苦马豆素可通过下调Twist1和失活PI3K/AKT信号通路来抑制食管癌细胞侵袭和上皮细胞-间质细胞转换;SUN等[47]证实苦马豆素能够抑制miR-92a表达和失活PI3K/AKT/mTOR信号通路,进而对胶质瘤细胞产生抑制作用;SHI等[48]证实苦马豆素与抗PD-L1在抑制肿瘤生长方面有协同作用,提出将两者结合是克服肿瘤免疫逃避的潜在疗法。
4.2 抗病毒活性有研究显示内质网α-甘露糖苷酶可作为病毒控制的潜在靶点,目前已有多篇文献报道提示苦马豆素具有抗病毒活性。ELBEIN最早发现苦马豆素能够干扰流感病毒寡糖链的加工,从而影响流感病毒血凝素的合成,达到抗流感病毒的效果;2006年TANAKA研究证明苦马豆素通过对内质网α-甘露糖苷酶抑制,导致内质网功能丧失,阻止病毒表面蛋白血凝素神经氨酸酶和融合蛋白的表达,降低病毒侵染细胞能力,从而达到抗病毒效果。张为民等[49]证实苦马豆素对猪传染性胃肠炎病毒体外增殖有抑制作用;HAO等[50]体外试验结果显示,苦马豆素可通过使游离病毒失活或阻碍病毒增殖,而发挥抗牛病毒性腹泻病毒活性。此外,有文献报道苦马豆素对人肉瘤病毒、荨麻疹病毒、朊病毒等都有一定抑制作用。
4.3 免疫调节活性在一定剂量范围苦马豆素能够促进免疫细胞增殖、以及骨髓细胞增殖与分化,从而提高机体的免疫力,被证实是一种免疫调节剂。之前提到的苦马豆素间接抗癌活性与其免疫调节作用密不可分。YAGITA在1990年证实苦马豆素可增强人大颗粒淋巴细胞(large granular leukocyte,LGL)对抗NK结肠癌细胞系的细胞毒性,而且当把LGL和白介素2共培养时,苦马豆素可加强淋巴因子激活的杀伤细胞增殖。2003年OREDIPE发现苦马豆素可增强小鼠骨髓细胞增殖,认为苦马豆素具有克服癌症化疗药物和放疗骨髓抑制作用的潜力。张志敏在2008年报道了低浓度苦马豆素能够增强一氧化氮合酶活性,刺激TNF-α和H2O2生成,从而强化巨噬细胞吞噬、杀伤作用,但高浓度苦马豆素则起弱化作用。吴延磊于2011年报道含苦马豆素真菌代谢产物单独或与脂多糖、植物血凝素P协同使用可促进脾淋巴细胞增加,推测苦马豆素是真菌代谢物中促成这种结果的有效成分。张建军等[51]试验发现低浓度苦马豆素有益于T淋巴细胞增殖,增强机体免疫力,中或高浓度苦马豆素短时间内也有相同效果,但长时间会起到反作用,与张志敏的研究结果相似。SILVEIRA等[52]在肿瘤相关巨噬细胞的体外试验中发现,苦马豆素可调节巨噬细胞表型,减少CCL2的分泌,抑制IL-10和IL-6上调,通过调节抗肿瘤免疫反应,抑制肿瘤细胞生长。但目前免疫调节机制仍然不明了,需要进一步研究。
4.4 其他药理活性苦马豆素除上述3种主要药理活性外,近年来还发现一些新的有趣的药理活性。LI等[53]在探究苦马豆素对胚胎成纤维细胞增殖与胶原合成作用及其可能的分子机制时,发现苦马豆素可通过下调miR-21表达,抑制PI3K/AKT和NF-κB通路,使成纤维细胞增殖和胶原合成降低,提示苦马豆素可用于增生性瘢痕的治疗。FAN等[54]在研究高原鼠兔肠道菌群多样性及其对植物次生化合物响应时,发现高原鼠兔从田间转移到实验室饲喂单一饲料时,肠道微生物群落多样性降低、肠道型优势细菌组成改变,而在饲料中添加苦马豆素后,肠道微生物多样性和优势属丰度均有部分恢复。LV等[55]证实苦马豆素可经p38MAPK/NF-kappa B通路下调miR-429的表达,保护大鼠心肌细胞免受脂多糖诱导的细胞凋亡和炎症损伤,发挥其在脂多糖诱导大鼠心肌细胞中的抗凋亡和抗炎作用,提示苦马豆素在小儿心肌炎中有潜在应用价值。
5 展望
苦马豆素从人类发现命名至今,已经有40多年的研究历史,最初认为是疯草类有毒植物的主要毒性成分,研究重点主要是集中在毒性与毒理方面。但随着苦马豆素抗肿瘤、抗病毒和免疫调节等生物活性的发现,有关苦马豆素药理作用的研究也引起了人类医学领域学者的关注和兴趣。由此可见苦马豆素和其他物质一样,无不具有两重性的特征。世界上的一切物质都具有两重性,毒物也不例外,在一定条件下毒物可变成药物,药物亦可变成毒物。因此,科学认识苦马豆素的两重性,充分发挥苦马豆素的药物治疗作用,同时避免或减少不良反应的发生,实现苦马豆素“以毒攻毒、化毒为利”将是今后研究的主要方向。一是虽然苦马豆素的抗肿瘤、抗病毒和免疫调节等方面的效果显著,但其作用机制目前尚不明确,尤其是在细胞与分子水平上的作用靶点和代谢通路等研究鲜有报道,需要开展深入系统地研究,揭示其及作用机制,发挥苦马豆素在人类疾病治疗中的潜能;二是苦马豆素来源是制约其发展和应用的瓶颈,植物体内苦马豆素含量低、提取工艺复杂、提取效率低,人工合成成本高、步骤繁琐、产物分离纯化难度大、产率低。可利用现代基因工程、合成生物学、蛋白质组学和微生物诱变等技术,将调控苦马豆素合成的关键基因导入目标载体或诱变获得高表达菌株,通过发酵解决其来源短缺问题将成为今后关注的重点。

