绵羊骨髓间充质干细胞分离培养与鉴定
楼梦雨,潘欠欠,敬 敬,韦进波,万赛罗,凌英会*
(1.安徽农业大学 动物科技学院,安徽 合肥 230036;2.安徽地方畜禽遗传资源保护与生物育种省级实验室,安徽 合肥 230036;3.安徽开放大学 农业工程系,安徽 合肥 230022)
间充质干细胞(mesenchymal stem cells,MSC)是一种具有自我更新和多潜能的成体干细胞。通常从骨髓中获得,但也可以从其他组织中分离出来,如皮下脂肪、骨骼肌、羊水和胎盘等。经过连续传代培养和冷冻保存后仍具有多向分化潜能[1-3],通常分离骨髓间充质干细胞(bone marrow mesenchymal cells,BMSC)和脂肪间充质干细胞(adipose derived mesenchymal stem cell,ADMSC)作为理想的种子细胞应用于细胞疗法、再生医学等领域[4-7]。
目前,体细胞克隆和转基因技术已经在绵羊育种技术中得到应用。供体细胞的类型是提高核移植成功率和转基因效率的关键[8-9]。许多研究中,已使用MSC作为供体细胞[10-11]。研究证实,同胎儿成纤维细胞相比,BMSC作供体细胞能提高体细胞核移植胚胎内细胞团的形成率,降低囊胚的凋亡率[12]。利用BMSC作为核供体,已成功培育出克隆牛和猪[13-14]。本研究旨在分离培养和鉴定绵羊骨髓间充质干细胞(sheep bone marrow mesenchymal stem cells,SBMSC),建立SBMSC的细胞系,为相关研究提供种子细胞。
1 材料与方法
1.1 材料与主要试剂、仪器2日龄绵羊来自安徽省庐江祥瑞养殖有限公司。α-MEM培养基(HyClone);胎牛血清(Gibco);磷酸盐缓冲液PBS(HyClone);胰蛋白酶(HyClone);CCK-8试剂(索莱宝);地塞米松(Sigma);3-异丁基-1-甲基黄嘌呤IBMX(Sigma);吲哚美辛(Sigma);ITS液体培养基补充剂(Sigma);丙酮酸钠(Sigma);胰岛素(Sigma);维生素C(Sigma);油红O染色液(Sigma);茜素红染色液(Sigma);4%多聚甲醛(白鲨生物科技);牛血清白蛋白BSA(Sigma);CD73抗体(R&D);CD90抗体(R&D);CD105抗体(R&D);山羊抗鼠594标记二抗(Jackon Immuno Research);驴抗绵羊594标记二抗(Jackon Immuno Research)。
二级生物安全柜(Thermo Fisher Scientific);CO2细胞培养箱(Thermo Fisher Scientific);荧光倒置显微镜(Olympus);酶标仪(Biotek instruments);离心机(Eppendorf)。
1.2 SBMSC分离与培养对2日龄绵羊麻醉处死后,取1根胸部肋骨放置于碘伏中浸泡2 min,75%酒精浸泡30 s后置于含有5%双抗的PBS中,转移至生物安全柜后取出肋骨,用含5%双抗的PBS反复冲洗后置于无菌培养皿中。骨剪剪开双侧骨端,剪开骨髓腔,利用含15%胎牛血清的α-MEM培养基反复冲洗,将骨髓液用离心管收集,1 000 r/min、离心5 min,去上清液。以2×106个/mL细胞接种于100 mm培养皿中,置培养箱中培养,每天观察细胞状态,初期每3 d换液,当细胞汇和度达到50%以上,每2 d换液,待细胞生长为80%~95%连续单层时,冻存细胞。
1.3 细胞形态学观察相差显微镜下,逐日观察接种在含15% FBS的α-MEM培养基中SBMSC的生长状态、传代后的形态变化及贴壁情况,并拍照保存。
1.4 生长曲线的绘制消化收集P3代对数生长期SBMSC,以1×104个/mL接种至96孔板中间6行7列。每列分别标记为1,2,3~7 d,培养24 h。每日依次向各列孔中加入10 μL CCK-8溶液,孵育3 h;用酶标仪测定波长450 nm处吸光度值,利用GraphPad Prism 8.0绘制生长曲线图。
1.5 细胞免疫荧光试验消化收集P3代对数生长期SBMSC,以5×104个/mL接种至12孔板中。待细胞汇和度达到50%~60%时,用PBS缓冲液洗涤;再使用4℃预冷的4%多聚甲醛固定20 min,PBS缓冲液漂洗3遍;加入1% BSA,室温封闭2.0 h;除去封闭液,用1% BSA稀释一抗后移至细胞培养皿中,孵育0.5 h后,吸走抗体再重新加入,4℃孵育14.0~16.0 h吸净一抗,加入PBS缓冲液漂洗3×5 min;加入80 μL二抗工作液室温孵育1.0 h;除去二抗,细胞用PBS缓冲液漂洗3×5 min,加入DAPI工作液,室温避光孵育10 min,倒置荧光显微镜下观察并拍摄试验结果。
1.6 SBMSC成软骨诱导分化鉴定取P3代对数生长期SBMSC,接种至6孔板中,每孔接种1×105个细胞,当细胞汇合度达到80%时更换成软骨诱导培养基。成软骨诱导培养基为α-MEM添加10%FBS、l μmol/L 地塞米松、50 mg/L 维生素C、0.5 mmol/L 丙酮酸钠、0.01 mol/L ITS。每3 d换液,诱导培养21 d。4%多聚甲醛固定后包埋切片,阿利新蓝染色鉴定。
1.7 SBMSC成脂诱导分化鉴定取P3代对数生长期SBMSC,接种至6孔板中,每孔接种1×105个细胞,当细胞汇合度达到80%时更换成脂诱导培养基。成脂诱导培养基为α-MEM添加10%FBS、10 mg/L 胰岛素、l μmol/L 地塞米松、0.5 mmol/L IBMX、0.5 mmol/L 吲哚美辛。每3 d换液,诱导培养21 d。4%多聚甲醛固定15 min,PBS洗3次,油红O染色鉴定。
1.8 SBMSC成骨诱导分化鉴定取P3代对数生长期SBMSC,接种至6孔板中,每孔接种1×105个细胞,当细胞汇合度达到80%时更换成骨诱导培养基。成骨诱导培养基为α-MEM添加10%FBS、1 μmol/L 地塞米松、50 mg/L 维生素C、0.01 mol/L β-磷酸甘油钠。每3 d换液,诱导培养21 d。4%多聚甲醛固定后,茜素红染色鉴定。
2 结果
2.1 SBMSC形态学观察为确定分离获得细胞类型,对分离细胞进行形态学观察,并拍照。结果显示分离获得SBMSC具有MSC长梭形、星形或纺锤形,边缘轮廓清晰的典型形态,并且能够在含15%FBS的α-MEM培养基中稳定生长(图1)。将获得的SBMSC扩增后冻存,用于后续试验。
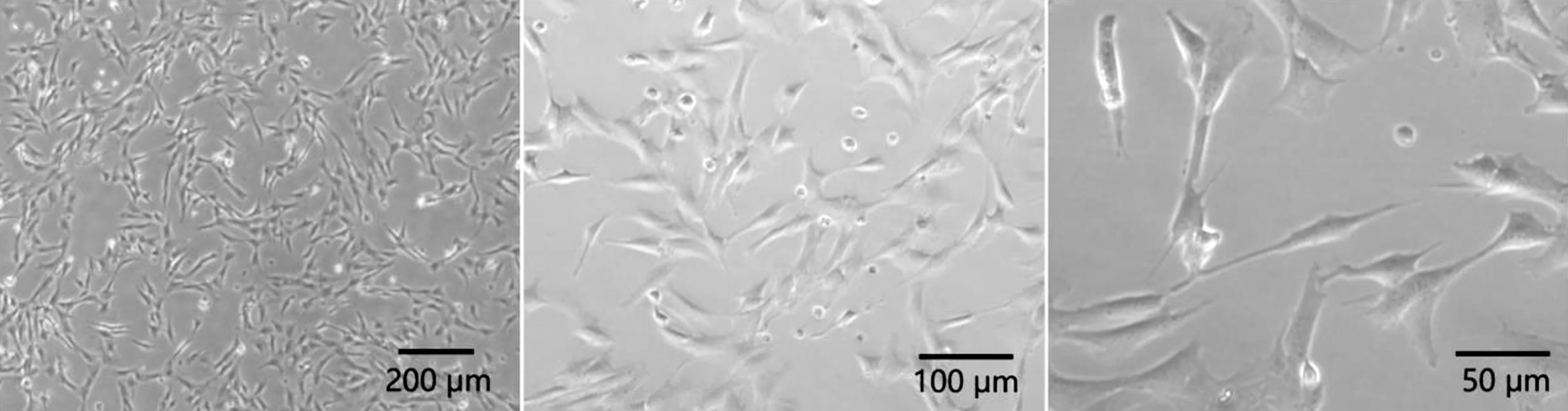
图1 SBMSC体外培养的形态特征
2.2 SBMSC生长曲线的绘制为测定SBMSC体外培养生长速度,将分离获得的BMSC接种于含15% FBS培养基中进行传代培养,选取P3代对数生长期细胞进行生长曲线的测定和绘制。如图2所示,第3代SBMSC生长曲线呈“S”型,1~2 d为潜伏期,2~4 d为对数生长期,第4 天细胞数量达到最大。
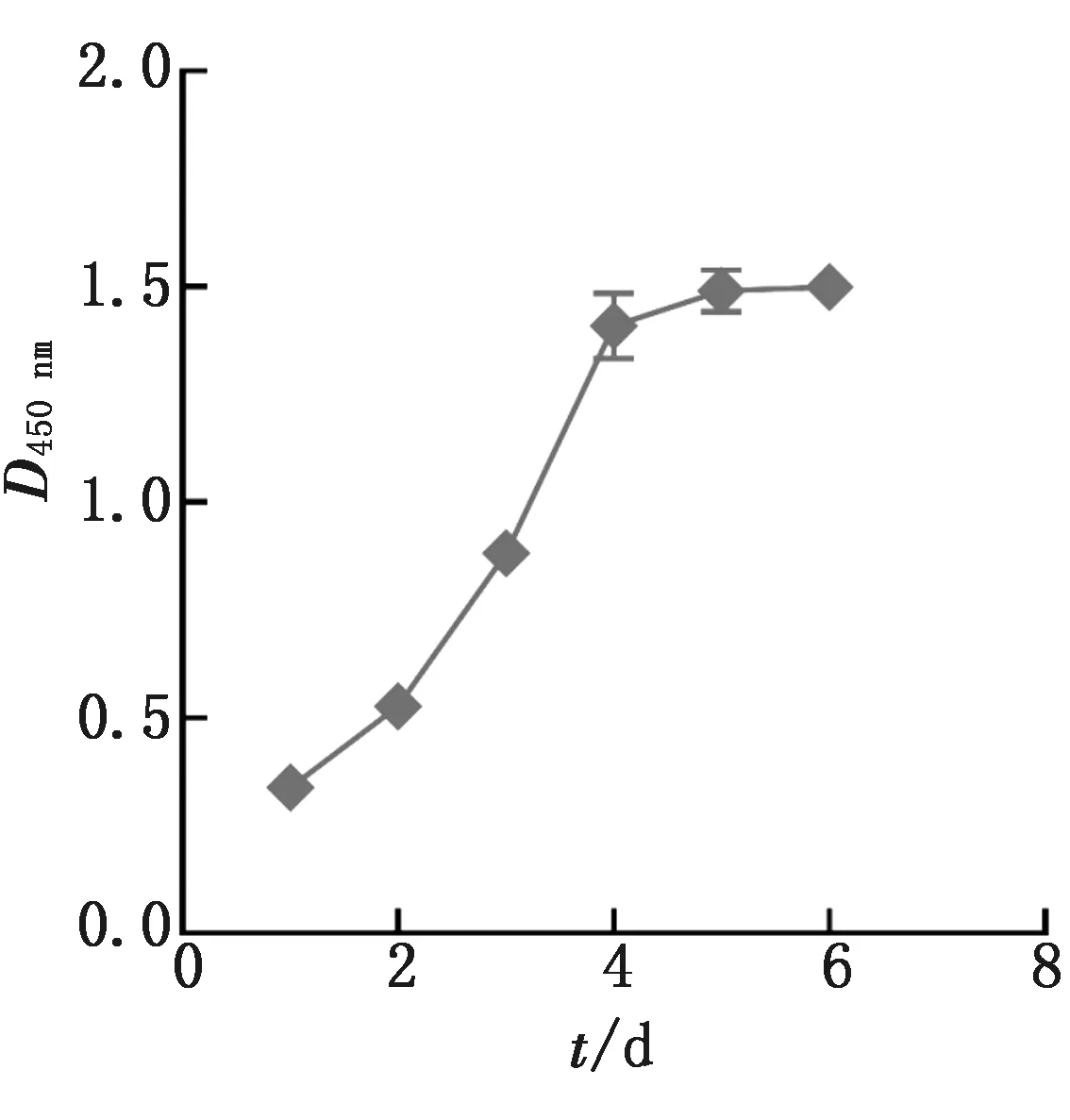
图2 SBMSC细胞生长曲线
2.3 SBMSC免疫荧光染色为鉴定分离所获得细胞类型,对SBMSC进行免疫荧光染色。据以往研究,间充质干细胞可以阳性表达CD90、CD73、CD105等表面特异性抗原,阴性表达CD106等表面特异性抗原。使用CD90、CD105、CD73、CD106等一抗分别对SBMSC进行免疫荧光染色,结果如图3所示,可见分离获得细胞与CD90、CD105、CD73等蛋白结合良好,蛋白处于细胞膜上,表明SBMSC阳性表达CD90、CD73、CD105等表面特异性抗原,阴性表达CD106表面特异性抗原,符合BMSC表型。

图3 SBMSC细胞免疫荧光染色
2.4 SBMSC成软骨诱导分化鉴定取P3代SBMSC软骨诱导培养,经软骨诱导的SBMSC起初贴壁生长,诱导4~5 d时细胞连成一片呈膜状,10 d左右慢慢脱离皿底,肉眼可见乳白色细胞膜。诱导培养21 d后,细胞膜卷曲折叠为细胞团, 4%多聚甲醛固定后包埋切片,经阿利新蓝染色,可见细胞呈亮蓝色(图4),表明SBMSC诱导分化为软骨细胞。
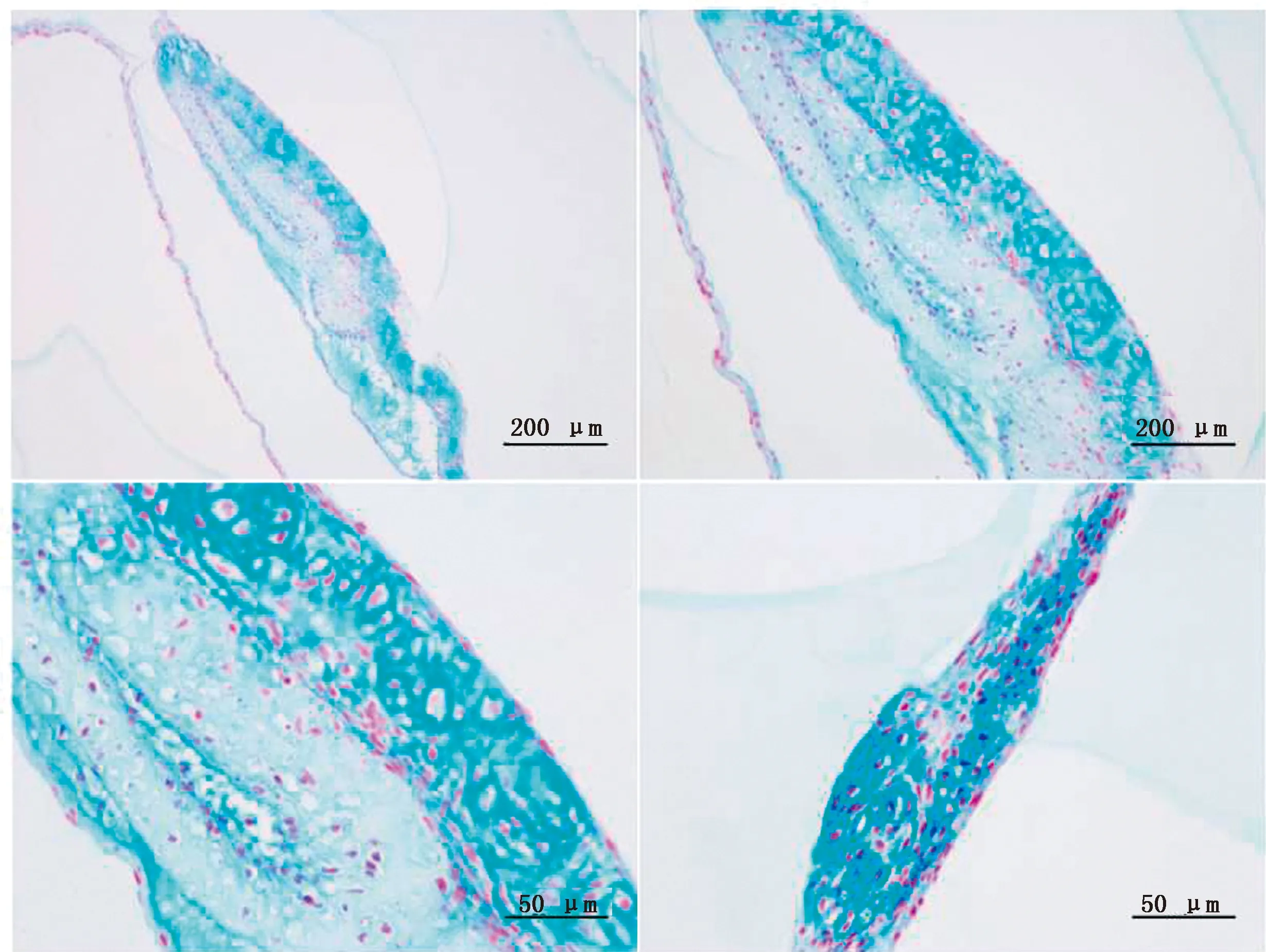
图4 SBMSC阿利新蓝染色
2.5 SBMSC成脂诱导分化鉴定取P3代SBMSC成脂诱导培养,诱导分化7 d,显微镜下可观察到细小的脂滴;诱导培养14 d,脂滴数量增多,体积增大;诱导培养21 d,4%多聚甲醛固定,油红O染色,可见红色脂滴(图5);表明SBMSC诱导分化成脂肪细胞。

图5 SBMSC油红O染色
2.6 SBMSC成骨诱导分化鉴定取P3代SBMSC成骨诱导培养,成骨诱导7 d,显微镜下可观察到沉积的细小钙化结节;随诱导时间的延长,钙化结节范围增大,数量增多;经茜素红染色,可见橘红色结节,说明有矿化基质沉积(图6);表明SBMSC具有成骨分化潜能。
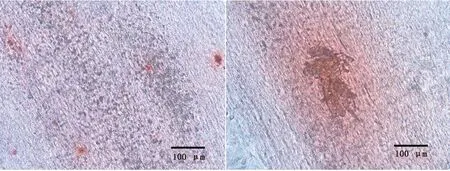
图6 SBMSC茜素红染色
3 讨论
间充质干细胞是一类存在于各种组织和器官中的成体干细胞[15]。由于间充质干细胞具有多向分化潜能,数量丰富,使用方便,已成为组织工程的重要种子细胞[16-17]。随着体细胞核移植技术的发展和成体干细胞在细胞组织工程中的应用,细胞克隆的首选供体细胞不再是单一的胎儿成纤维细胞。有研究使用成体干细胞作为供体细胞,更多使用间充质干细胞[8,18]。BMSC已从多种哺乳动物中分离出来,广泛应用于细胞疗法、再生医学、动物育种等方面,因此我们拟建立SBMSC完整的体外培养体系,为绵羊育种、组织再生等方面提供种子细胞。
BMSC在骨髓中含量仅0.001%~0.100%,分离方法主要包括免疫磁珠法、流式细胞仪法、梯度密度离心法和全骨髓贴壁培养法,以上分离方法各有优缺点,至今尚无最佳分离培养方案[6,19-20]。免疫磁珠法、流式细胞仪法等新方法分离细胞纯度较高,但对实验室仪器设备要求高并且对细胞活性损伤较大,未能广泛应用。密度梯度离心法根据骨髓中各类淋巴细胞、血细胞等细胞比重不同,通过添加percoll液或淋巴细胞分离液分离相对较纯的BMSC,但反复离心,破坏了骨髓微环境,不利于BMSCs生长。全骨髓贴壁培养法是目前操作最简单有效的方法,试验要求较低,能广泛使用。利用BMSC的贴壁生长特性,反复更换培养液,去除悬浮细胞,从而大量分离BMSC。因此我们选择采用全骨髓贴壁培养法分离SBMSC。
标准国际细胞治疗协会(International Society for Cellular Therapy,ISCT)制定了鉴定MSC的3条最低标准:塑料黏附性、特定的细胞表面抗原表达和多向分化潜能[11,21-22]。形态学观察发现:SBMSC在培养24 h后大部分细胞发生了贴壁现象,细胞形态均表现为较均一的长梭形、纺锤状,并呈漩涡状生长;表明在体外培养扩增体系下,SBMSC具有贴附塑料皿壁生长的能力。依据鉴定MSC细胞表面抗原表达的最低标准,本试验进行免疫荧光试验,验证MSC的表面特异性抗原CD105、CD90、CD73和CD106符合间充质干细胞的表型,从而证实了细胞是MSC。MSC的另一重要特征是多向分化能力。在特定的诱导分化培养下,MSC可向不同细胞分化。本试验显示SBMSC具有成软骨、成脂、成骨的分化能力。综上所述,本研究成功分离培养了SBMSC。
本研究基本掌握了较为稳定的SBMSC分离、体外培养扩增及定向诱导分化的方法,分离获得绵羊的BMSC,在体外培养时表现出较高的增殖速率和多向分化潜能。对于今后利用SBMSC构建自体细胞组织工程化奠定了必要的基础,为绵羊相关基因功能以及分子育种等方面研究提供了种子细胞。

