珍珠龙胆石斑鱼对7种蛋白源的表观消化率
郑朝中 曹俊明 董晓慧, 迟淑艳, 章 双, 杨奇慧, 刘泓宇, 邓君明, 张 卫, 谭北平, * 谢诗玮, *
(1.广东海洋大学水产学院水产动物营养与饲料实验室, 湛江 524088; 2.农业农村部华南水产与畜禽饲料重点实验室, 湛江524088; 3.广东省水产动物精准营养与高效饲料工程技术研究中心, 湛江 524088; 4.广东省农业科学院动物科学研究所农业农村部华南动物营养与饲料重点实验室, 广州 510640)
珍珠龙胆石斑鱼(Epinephelus fuscoguttatus♀ ×Epinephelus lanceolatus♂)是由马来西亚沙巴大学在2007年将褐点石斑鱼(E.fuscoguttatus)和鞍带石斑鱼(E.lanceolatus)进行杂交培育出来的品种, 俗称龙虎斑或珍珠斑[1]。它是一种海洋肉食性鱼类,因生长迅速、抗病能力强和胶原蛋白含量高等特点在水产养殖业中具有巨大的经济价值[2—4]。现今全球石斑鱼养殖主要集中在亚洲东部和东南部地区, 中国和印度尼西亚是主要产区, 我国珍珠龙胆石斑鱼养殖主要集中在广东、海南和福建等省份[5]。近年来, 石斑鱼饲料已经成功开发和迅速普及[9]。然而石斑鱼饲料蛋白水平较高, 约45%—50%, 同时饲料中鱼粉的比重也相对较高[10]。由于在过去的20年中水产养殖发展迅猛以及鱼粉产量逐渐下降,供不应求的鱼粉资源成为了行业发展的瓶颈[11,12]。
目前已有部分蛋白原料应用于水产饲料以降低鱼粉使用量, 如动物蛋白源(血球蛋白粉和畜禽副产物)[13,14]、植物蛋白源(发酵豆粕和棉粕)[15,16]及单细胞蛋白源(酿酒酵母)[17]。近几年, 一些新型蛋白源逐渐进入研究者们的视线。以黄粉虫(Tenebrio molitormeal, TMM)[18,25]和黑水虻(Hermetia illucensmeal, HIM)[19,29]为代表的昆虫蛋白, 以棉籽浓缩蛋白(Cottonseed protein contentrate, CPC)[4,41,43]为代表的植物蛋白源, 以小球藻(Chlorella vullgarismeal, CVM)[20,33]为代表的单细胞蛋白, 以及以乙醇梭菌蛋白(Clostridium autoethanogenumprotein,CAP)[21,44,45]和荚膜甲基球菌蛋白(Methylococcus capsulatusmeal, MCM)[22,47]为代表的工业细菌蛋白等都是潜在的石斑鱼饲料鱼粉替代品。
黄粉虫是一种易于饲养和加工的昆虫, 含有23%—47%的粗脂肪及44%—69%的粗蛋白[23]。此外, 黄粉虫还含有多种必需氨基酸, 亮氨酸、苏氨酸和组氨酸等含量甚至高于鱼粉[24]。黑水虻能够通过食用动物粪便和厨余垃圾来将低值的有机废物转化为动物蛋白质, 为动物所食用[26—28]。小球藻具有营养价值高、培养时间短和免疫调节能力强等特点[30—32]。尽管小球藻的蛋白含量高达50%—70%, 然而其厚厚的细胞壁和丰富的胞外多糖阻止了动物对小球藻的消化和吸收, 使得在水产饲料中的利用率表现出好坏参半的结果[34—36]。棉籽粕是可替代鱼粉的植物性蛋白源之一, 但因其必需氨基酸组成不平衡、含有抗营养因子而难以被广泛应用[5,37,38]。棉籽浓缩蛋白是以棉籽粕为原料通过乙醇溶液处理来制备的, 能有效减少可溶性碳水化合物和抗营养因子的含量[39,40]。乙醇梭菌蛋白是由乙酸梭菌(C.autoethanogenum)发酵生产工业乙醇的一种副产物, 是一款绿色、环保的新型蛋白。荚膜甲基球菌蛋白也是由天然气发酵产生的单细胞蛋白, 含有比鱼粉更高的粗蛋白和氨基酸组成[46]。目前, 这些新型蛋白源在水产饲料中都已开展了初步的应用研究。秘鲁鱼粉在本研究也作为其中一种试验蛋白原料, 为其他6种蛋白源的对比提供更直观的参照。表观消化率(ADCs)反映了动物的消化能力、评估了动物对饲料中营养物质的利用效率。ADCs这一指标在20年前就被推荐采用, 如今越来越多地被用于评估饲料原料和饲料配方[48]。
本实验旨在评估7种蛋白原料: 黄粉虫粉(TMM)、黑水虻虫粉(HIM)、乙醇梭菌蛋白(CAP)、荚膜甲基球菌蛋白(MCM)、小球藻粉(CVM)、棉籽浓缩蛋白(CPC)和秘鲁鱼粉(PFM)对珍珠龙胆石斑鱼的干物质、粗蛋白、粗脂肪和氨基酸表观消化率的影响,为寻找替代鱼粉的新型蛋白原提供参考。
1 材料与方法
1.1 试验饲料配方
秘鲁鱼粉、豆粕和小麦谷朊粉作为饲料主要蛋白源, 配制干重下粗蛋白水平为52.6%、粗脂肪水平为10.5%的基础饲料。本研究设置1个基础组(BD)和7个试验组(TMM、HIM、CAP、MCM、CVM、CPC和PFM)。每组试验饲料都由70%基础饲料和30%的试验蛋白原料组成(以干物质计)。试验饲料配方见表1。7种蛋白原料和试验饲料的营养组成和氨基酸组成见表2和表3。所有饲料原料用锤式粉碎机(SF-320, 苏中制药机械有限公司, 中国江苏)粉碎, 过60目筛, 霍巴特式搅拌机(M-256,华南理工大学, 中国广州)中充分混合。预混料按重量采用逐级混匀法添加到混合物中, 并且添加0.1%氧化钇(Y2O3)为指示剂。将各组所需的油与水均匀掺入原料混合物后, 添加。最后由双螺杆挤出机(F-26, 华南理工大学, 中国广州)将湿润混合物压制成直径2.5 mm的饲料, 在室温下干燥至含水量约为10%, 按组别分装在密封袋中, 储存在–20℃备用[56]。
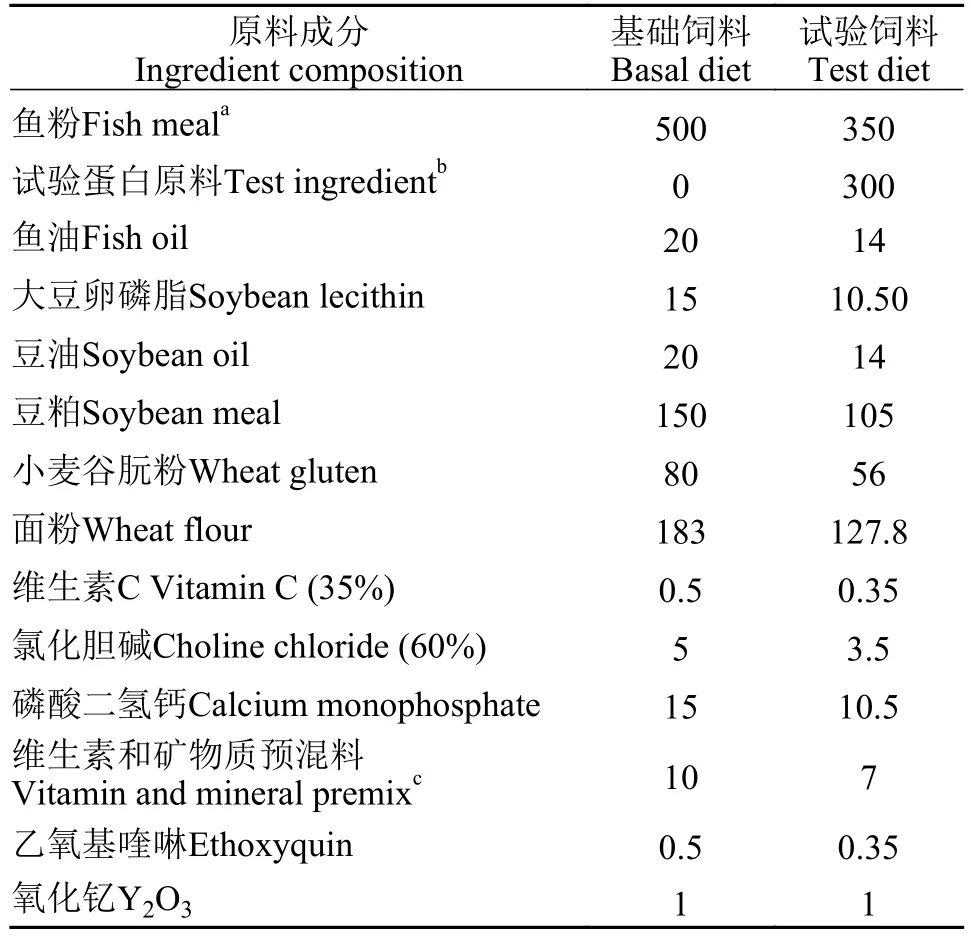
表1 试验饲料配方Tab.1 Formulation of diets used in this study (dry matter basis,g/kg)

表2 七种试验蛋白原料的营养成分和氨基酸组成Tab.2 Proximate and amino acid compositions of test ingredients (dry matter basis, %)

表3 试验饲料的营养成分和氨基酸组成Tab.3 Proximate and amino acid compositions of test diets (dry matter basis, %)
1.2 试验鱼与养殖条件
养殖试验所用珍珠龙胆石斑鱼幼鱼购于广东省湛江市麻章区东海岛养殖场, 养殖试验在广东海洋大学研究基地进行。使用商品饲料(广东海大集团, 粗蛋白55.0%, 粗脂肪10.0%)饲喂石斑鱼以达到驯化目的。健康、大小均一的试验鱼[初始体重为(9.95±0.50) g]被随机分在0.3 m³的玻璃钢养殖桶中,每种饲料处理组设置3个平行, 每个平行放置30尾鱼。养殖期间, 为每个养殖桶每日1次更换60%海水, 以保持水质稳定。海水水温为26℃—28℃, 盐度为27‰—30‰, 溶解氧为7.0 mg/L以上, pH为7.6—8.1, 亚硝酸盐在0.02 mg/L左右, 氨氮在0.03 mg/L以下。
1.3 饲喂方法与粪便收集
首先投喂5d试验饲料, 观察发现鱼排便高峰集中在喂食后3—4h 。之后正式收集粪便, 每天8点和15点给投喂试验饲料。进食结束1h后, 清理饲料残渣和鱼体分泌物。每天12点和19点, 使用虹吸法收集沉淀在桶底的新鲜粪便, 沥干至无明显水滴后转入–20℃冰箱内冷冻暂存。粪便收集实验共持续30d。粪便样品在70℃下烘干, 干燥至恒重(±0.01) g后, 用200目粉碎机(DFY-400C, Linda机械有限公司, 浙江温岭, 中国)粉碎粪便样品。然后放入密封袋中, 在4℃下保存。
1.4 样品分析和计算公式
按照AOAC标准方法[57]对试验蛋白原料、试验饲料和粪便进行营养成分分析。水分含量通过105℃烘干测定; 粗蛋白含量用Primacs100 analyzer(Skalar, 荷兰) 通过杜马斯定氮法进行测定; 粗脂肪含量通过索式浸提法测定; 氨基酸含量是利用氨基酸分析仪(L-8800, 日立公司)根据GB/T 18246-2019测定; 饲料和粪便中的Y2O3含量通过电感耦合等离子体质谱仪(ICP-MS, 7500-CX, Agilent Technologies, Santa Clara, CA, USA)测定。
根据Cho & Kaushik[58]的方法, 试验饲料中干物质、粗蛋白、粗脂肪和氨基酸的ADCs计算公式如下:

式中,F是该营养成分在粪便中的含量,D是该营养成分在饲料中的含量,FY是Y2O3在粪便中的含量,DY是Y2O3在饲料中的含量。
试验蛋白原料ADCs (%)=ADCt+[(ADCt–ADCr)×(0.7×Nb/0.3×Ni)]式中, ADCt是试验饲料中营养成分的ADCs (%),ADCr是基础饲料中营养成分的ADCs (%), 0.7是基础饲料在试验饲料中的含量, 而0.3是试验蛋白原料在试验饲料中的含量, Nb是营养成分在基础饲料中的含量, Ni是营养成分在试验蛋白原料中的含量。
1.5 统计方法
本研究所有数据均使用SPSS®V.24(IBM, 美国)进行统计分析, 结果表示为平均值±标准差(mean±SD)。采用单因素方差分析(One-way ANOVA)进行统计分析, 图基检验(Tukey’s multiple test)用于比较不同处理间的平均值。当P<0.05时,认为差异具有显著性。
2 结果
2.1 七种试验蛋白原料的干物质、粗蛋白、粗脂肪ADCs
如表4所示, 7种试验蛋白原料的干物质ADCs为53.25%—68.74%。CVM组的干物质ADCs明显高于HIM组、MCM组和PFM组(P<0.05), 但与TMM组、CAP组和CPC组没有显著差异(P>0.05)。在干物质ADCs中, 从高到低分别是CVM组、TMM组、CAP组、CPC组、HIM组、MCM组和PFM组。
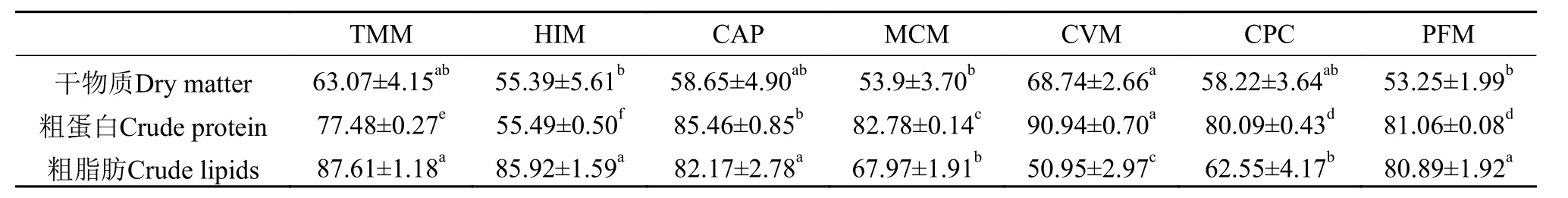
表4 试验蛋白原料的干物质、粗蛋白和粗脂肪的表观消化率Tab.4 Apparent digestibility coefficients for DM, CP and CL of test ingredients (%)
7种试验蛋白原料的粗蛋白ADCs为55.49%—90.94%。只有TMM组和HIM组的粗蛋白ADCs低于80%。其中, CVM组的粗蛋白ADCs显著高于其他组(P<0.05), 随后从高至低分别是CAP组、MCM组、PFM组、CPC组、TMM组和HIM组。
TMM、HIM、CAP和PFM4组的粗脂肪ADCs值都在80%以上, 且4组之间无显著差异性(P>0.05),但显著高于MCM组、CPC组和CVM组(P<0.05)。CVM组的粗脂肪ADCs显著低于其他各组(P<0.05)。
2.2 七种试验蛋白原料的氨基酸ADCs
如表5所示, 7种试验蛋白原料对每种氨基酸的ADCs为51.26%—96.50%。而总氨基酸(Total amino acid)ADCs 为67.72%—91.71%, 从高到低依次为CVM组、CAP组、CPC组、PFM组、MCM组、HIM组和TMM组, 这与粗蛋白ADCs的趋势很相似。

表5 试验蛋白原料的氨基酸表观消化率Tab.5 Apparent digestibility coefficients for amino acids of test ingredients (%)
CVM组和CPC组的精氨酸ADCs显著高于其他组(P<0.05), 而且除TMM组外其他试验蛋白原料的精氨酸ADCs都高于80%。PFM组的组氨酸ADCs显著高于除MCM组外其他组(P<0.05)。CAP组和CVM组的异亮氨酸、亮氨酸、苏氨酸和缬氨酸ADCs显著高于其他组(P<0.05)。CAP的赖氨酸ADCs明显高于其他组(P<0.05), 并且除CPC组外其他组的赖氨酸ADCs都在70%以上。7组的蛋氨酸ADCs都在74%以上, CVM组的蛋氨酸ADCs显著高于除PFM组外其他组(P<0.05)。CVM组的苯丙氨酸ADCs显著高于其他组(P<0.05)。TMM组的精氨酸、异亮氨酸、亮氨酸、苏氨酸和缬氨酸显著低于其他组(P<0.05)。CVM组的天冬氨酸ADCs显著高于除CAP组外其他组(P<0.05), 而其胱氨酸ADCs显著高于除CPC组外其他组(P<0.05)。对于谷氨酸、丙氨酸、甘氨酸、脯氨酸、丝氨酸和酪氨酸, CVM组的ADCs显著高于其他组(P<0.05)。
3 讨论
目前, 许多关于新型蛋白源替代鱼粉的研究仅分析了蛋白源的营养成分并没有评估原料的消化率, 因此可能对新型蛋白源的精准利用造成不利影响。ADCs这一指标是通过饲料和粪便中惰性标志物的比率来计算, 间接测定了对原料或饲料中营养成分的生物利用率[59]。试验饲料是由70%的基础饲料和30%的试验蛋白原料组成[60], 蛋白原料各种营养成分的ADCs能够反映珍珠龙胆石斑鱼对营养物质的真实消化情况。
一直以来, 氧化铬(Cr2O3)是测定陆生动物和鱼类表观消化率最常用的外源标志物[49]。然而,Y2O3在中性条件下溶解度很低(在mg/kg范围内)且可以通过原子吸收来测量[52], 这一点优于Cr2O3。一些鱼类的表观消化率研究显示了Y2O3的优越性,如虹鳟(Oncorhynchus mykiss)[53,54]和黄鳍鲷 (Sparus latus)[55]。因此, 在本研究选用Y2O3作为表观消化率的外源标志物。
3.1 干物质表观消化率
干物质ADCs直观展现了鱼对每种蛋白原料的总体消化利用能力, 因此, 干物质ADCs被认为是最重要的一项消化率指标之一[61]。在本研究中,CVM组的干物质ADCs较高, 这与美国鲶[62]和欧洲鲈[63]的研究结果相似。尽管小球藻细胞壁的高纤维素含量会阻碍鱼对小球藻的消化和吸收, 但在饲料压制过程中可能会产生破壁作用, 提高鱼对其的消化率。这一假设在Tibbetts等[64]在大西洋鲑的研究中得到证实, 饲料中添加破碎后的小球藻粉的干物质ADCs明显高于未经处理的小球藻粉。较低的干物质ADCs通常表明饲料中存在大量的不可消化的物质[65]。PFM组的干物质ADCs较低, 这可能与PFM组饲料中较高的灰分含量有关。鱼粉含有较多的骨骼及矿物元素, 这是粗灰分的主要组成部分。金头鲷(Sparus aurata)[66]、白对虾(Penaeus setiferus)[61]和尼罗罗非鱼(Oreochromis niloticus)[67]等研究结果都表明, 灰分含量较高的饲料可能会导致营养成分ADCs下降。同时, HIM组和MCM组的干物质ADCs与PFM组没有显著差异。Dumas等[68]的研究结论与本研究类似, 研究表明黑水虻虫粉的干物质ADCs与鱼粉没有明显差异。HIM组的干物质ADCs较低可能归咎于昆虫含有难以消化的几丁质[69]。此外, Storebakken等[70]用荚膜甲基球菌蛋白替代大西洋鲑饲料鱼粉的研究表明, MCM的干物质ADCs显著低于鱼粉。这可能是细菌细胞膜的结构性非淀粉多糖起作用, 但这需要通过更多的研究来佐证。一项斜带石斑鱼(E.coioides)的研究测定了25种传统饲料原料的表观消化率的研究结果显示,棉籽粕的干物质ADCs相对较低(61.48%), 这与本研究的结果中CPC的干物质ADCs(58.22%)相近, 表明石斑鱼对植物蛋白的利用率不高[71]。
3.2 粗蛋白表观消化率
蛋白质作为水产动物的重要营养素, 其ADCs是评定蛋白原料可利用性的重要指标。蛋白质含量高且氨基酸组成均衡的饲料往往具有更高的营养价值, 而饲料中缺乏必需氨基酸会导致蛋白质利用效率下降从而使动物生长不良[72]。除TMM组和HIM组外, 其他各组的粗蛋白ADCs都在80.08%—90.94%, 显著高于TMM组(77.48%)和HIM组(55.49%),这说明石斑鱼对黄粉虫和黑水虻两种昆虫蛋白的粗蛋白消化能力有限。应用于动物饲料的昆虫蛋白通常含有一定的几丁质, 这是昆虫类和甲壳类特有的一种物质[73]。据报道, 几丁质会降低陆生和水生动物的饲料干物质和粗蛋白的ADCs[74,75]。Sanchez-Muros等[76]的研究称, 昆虫蛋白的消化率为45.00%—66.90%, 低于大多数植物蛋白的消化率,这可能是由于几丁质干扰了蛋白质的消化利用。由于几丁质的限制, 昆虫蛋白在水产饲料中的添加量一般在30%以下[77]。Huang等[78]的研究也显示,HIM替代10%饲料鱼粉便会损伤珍珠龙胆石斑鱼肠道, 降低营养吸收的能力。这表明, 几丁质含量对于昆虫蛋白在石斑鱼饲料中的应用非常重要。需要注意的是, HIM组的粗蛋白ADCs远低于其他6种试验蛋白原料。其中的原因之一可能是其过高的脂肪含量导致的。有研究表明脂肪含量较高的鸡肉粉显示出比鱼粉更低的粗蛋白ADCs[79]。此外,HIM组饲料中的粗蛋白含量也比其他6种试验蛋白原料低得多。以往的一些消化率研究都指出一个共同的结论: 原料中粗蛋白ADCs与原料中的粗蛋白含量呈正相关[80—82]。
3.3 粗脂肪表观消化率
鱼类可以有效地利用膳食脂肪[83,84]。在本研究中, TMM组、HIM组、CAP组和PFM组的粗脂肪ADCs都高于80%。一些研究表明, 大菱鲆对于HIM的粗脂肪ADCs较高(约78%)[85], 用TMM代替金头鲷饲料中的鱼粉也能够使粗脂肪ADCs提高(>82%)[86]。原因可能是石斑鱼对昆虫脂肪的消化能力比植物脂肪更好。在大口黑鲈[87]和乌苏里拟鲿(Pseudobagrus ussuriensis)[88]上的研究都表明, 动物蛋白源的粗脂肪ADCs比未经发酵的植物蛋白源更高。本研究CAP组的粗脂肪高消化率的原因尚未探明, 需要在更多的水产动物中进行研究。以往的研究表明, 斜带石斑鱼对于鱼粉的粗脂肪ADCs分别为91.55%[71]和92.39%[89], 这表明石斑鱼可以高效利用鱼粉中的脂肪。与高消化率的成分相比,CVM的粗脂肪ADCs仅为50.95%。Tibbetts等[64]的研究表明, 小球藻粉替代24%鱼粉会导致大西洋鲑鱼对棕榈酸、亚油酸和亚麻酸等脂肪酸ADCs降低从而使粗脂肪ADCs显著降低。据研究表明, 脂肪酸链长度、饲料脂肪含量和脂肪酸组成都会影响粗脂肪ADCs[90]。
3.4 氨基酸表观消化率
一般来说, 氨基酸ADCs也反映着鱼类对饲料原料的粗蛋白的消化率。在本研究中, 比起其他5种蛋白原料, CVM组和CAP组的氨基酸消化能力较高。这表明, 珍珠龙胆石斑鱼对两种单细胞蛋白(CVM和CAP)的氨基酸利用率较高。CAP是一种由乙醇发酵产生的单细胞蛋白, 具有替代水产饲料鱼粉的潜力。与传统的植物源蛋白相比, 细菌蛋白不含抗营养因子; 与动物来源的蛋白质相比, 具有沙门氏菌感染率低、生物胺含量低等优点[21,47]。在以往的CAP替代少量饲料鱼粉(<50%)的研究中,黑鲷(Acanthopagrus schlegelii)[21]、建鲤(Cyprinus carpiovar.Jian)[91]和草鱼(Ctenopharyngodon idella)[92]都呈现出安全性和有效性。然而, CAP与MCM都是细菌发酵类蛋白源, 粗蛋白含量包含一定的非蛋白氮, 因此这两种蛋白原料的粗蛋白含量往往高于17种氨基酸总含量。对于细菌蛋白在水产动物上的应用, 在氨基酸上的研究价值往往高于在粗蛋白上。据报道, 赖氨酸通常是水产饲料中的第一限制性氨基酸[93]。与鱼粉相比, 缺乏赖氨酸和蛋氨酸是单细胞蛋白的缺点之一[94]。然而, 不同于MCM和CVM, CAP的赖氨酸和蛋氨酸水平比鱼粉更高(表2)。在研究中, CAP、MCM和CVM的赖氨酸ADCs分别为93.19%、88.09%和86.58%。研究表明, 细鳞鲳(Piaractus mesopotamicus)和虹鳟对同为单细胞蛋白的酿酒酵母(Saccharomyces cerevisiae)的赖氨酸ADCs分别高达88.30%和 89.80%[95,96]。这些研究表明, 尽管原料的赖氨酸含量高低不一,鱼类对单细胞蛋白的赖氨酸消化能力普遍较高。蛋氨酸对器官生长和正常繁殖非常重要, 饲料中缺乏蛋氨酸会大大降低动物的生长速度[6,97]。在7种试验蛋白原料中, CVM的蛋氨酸ADCs最高(90.66%)。据报道, 大西洋鲑对小球藻的蛋氨酸ADCs为92.30%[64], 非洲鲶则高达99.52%[62]。这些结果表明, 小球藻粉中的蛋氨酸可以被鱼类有效地消化和利用。蛋氨酸亦是大部分水产动物的限制性氨基酸之一, 特别是配方中的植物性蛋白比例较高的情况下。在本研究中, 珍珠龙胆石斑鱼对CPC的赖氨酸和蛋氨酸ADCs明显低于其他蛋白原料。在一般情况下, 由于抗营养因子的存在, 鱼类难以提高对植物性原料的氨基酸ADCs。王文娟[71]的研究表明,斜带石斑鱼对棉粕的赖氨酸(75.88%)和蛋氨酸(78.44%)的ADCs低于其他传统蛋白。因此, CPC不适宜作为珍珠龙胆石斑鱼饲料的鱼粉替代蛋白。苏氨酸通常被认为是赖氨酸和蛋氨酸之后的第三限制性必需氨基酸[7]。在7种试验蛋白原料中, 石斑鱼对CAP和CVM的苏氨酸ADCs明显高于其他试验蛋白原料。值得注意的是, 大西洋鲑对CVM的苏氨酸ADCs高达87.40%[64]。而斜带石斑鱼对酵母蛋白的苏氨酸ADCs值仅为72.98%[89]。影响动物对苏氨酸的消化率的因素有很多, 包括饲料的苏氨酸水平[8]或氨基酸谱的组成[43]、鱼种的不同[50]、甚至养殖水温和盐度[51]等。
4 结论
综上所述, 通过比较干物质、粗蛋白、粗脂肪和17种氨基酸的表观消化率数据, 本研究所使用的乙醇梭菌蛋白和小球藻粉是较为理想的珍珠龙胆石斑鱼饲料蛋白源。本研究的表观消化率研究有助于为这些新型蛋白源在珍珠龙胆石斑鱼饲料的应用提供参考, 也有助于突破国内水产饲料业可持续发展的瓶颈、促进水产养殖业健康发展。

