丁苯酞对急性脑梗死患者血清中OPN、IL-1、CX3CL1和HCY水平的影响
李 攀,高晓娟
急性脑梗死是指脑组织血液循环突然中断造成的脑损伤,有高伤残率、高复发率、高死亡率的三高特点[1]。在急性脑梗死的防治进程中,丁苯酞因其具有重构微循环、保护线粒体、改善细胞能量代谢、调节细胞凋亡的作用[2],但目前对于丁苯酞在炎症方面的研究还很欠缺。本研究运用基因芯片技术,筛选出了与正常人相比有明显差异的炎性细胞因子OPN、IL-1、CX3CL1,再用qRT-PCR技术对靶基因的结果进行验证。通过联合检测OPN、IL-1、CX3CL1和HCY的水平,分析神经功能受损程度与OPN、IL-1、CX3CL1、HCY之间的关系,探讨丁苯酞对以上炎性指标的影响及对急性脑梗死的临床疗效,并对神经功能的改善与OPN、CX3CL1、IL-1、 HCY水平进行相关性分析,现报告如下。
1 资料与方法
1.1 一般资料:选取2020年10月至2022年月4于本院神经内科住院治疗的急性脑梗死患者70例为研究对象,诊断符合《中国急性脑梗死诊治指南》中的标准[3]。按随机数字表法分为常规组和观察组各35例,并选取35名健康体检者作为正常对照组,见表1。常规组和观察组在性别、年龄、危险因素(高血压、糖尿病和高脂血症)、入院时NIHSS评分上差异无统计学意义(P>0.05),入组时基本情况大体相等,有可比性。本研究经医院医学伦理委员会审核批准。

表1 2组患者入组时的基本资料比较
1.2 纳入标准:①CT或MRI扫描显示急性脑梗死的早期病灶;②首次发病,可在卒中发病后48 h内开始试验药物治疗;③无意识障碍、视听力障碍,能够配合进行认知及语言量表测试;④签署知情同意书。
1.3 排除标准:①心源性脑栓塞或因其他原因导致的脑梗死;②其他重要脏器功能障碍者;③合并严重感染的患者。
1.4 治疗方法:根据《中国急性脑梗死诊治指南》对患者均进行改善脑血液循环的治疗,包括降颅压、改善脑水肿、抗血小板聚集、营养脑神经等常规治疗。观察组在常规组治疗的基础上给丁苯酞氯化钠注射液(石药集团恩必普药业有限公司)100 mL/次,2次/d静脉输注。2组患者均连续治疗14 d,治疗过程中根据病情需要给予对症处理。
1.5 研究方法:通过基因芯片筛选出差异性最明显的三个因子作为研究对象。所有患者均于入院后24 h内及治疗14 d后空腹抽取静脉血2 mL,同时抽取35名健康体检者空腹肘静脉血2 mL,离心取上清液用酶联免疫吸附法(ELISA)检测血清中OPN、IL-1、CX3CL1的水平,HCY在全自动生化仪上用酶循环法进行测定。
1.6 观察指标:根据美国国立卫生研究院卒中量表(NIHSS)[4]对脑梗死患者入院时和治疗后第14 d的情况进行评分,评价内容包括意识水平、凝视、视野、面瘫、上下肢运动、共济失调、感觉、语言、构音困难、消失和忽视共11个项目,总分0~42分。分值越高表示被检者神经功能损伤越严重,其中NHISS>7分为存在神经功能损伤。出院时患者NIHSS评分为0~2分或较入院时减少≥4分为好转。根据Barthel指数(ADL)[5]以患者日常实际表现作为依据对治疗前后的独立生活能力进行评分,根据总分评定其功能有无明显障碍。最后分析神经功能的改善与OPN、CX3CL1、IL-1、HCY水平变化的相关性。
2 结果
2.1 基因芯片结果和qRT-PCR验证结果:检测炎症因子及其受体基因共84条。急性脑梗死炎症基因表达谱中差异表达的基因共45条,其中上调基因29条,下调基因16条。差异最大的包括OPN、IL-1、CX3CL1。用qRT-PCR对基因芯片结果进行验证,急性脑梗死患者OPN、IL-1的mRNA水平较正常对照组上调,CX3CL1的mRNA水平较正常对照组下调,与基因芯片结果一致。
2.2 2组患者治疗前和治疗后第14 d NIHSS及ADL指数分值比较:常规组和观察组均无失访者,2组患者在入院时进行评分比较差异无统计学意义(P>0.05)。治疗14 d,常规组和观察组较治疗前NIHSS评分降低,ADL指数升高(P<0.05)。观察组治疗后评分比常规组治疗后评分变化更明显(P<0.05),说明加用丁苯酞治疗可以改善神经功能损伤,起到更好的治疗效果,见表2。
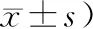
表2 2组患者治疗前后NIHSS和ADL的比较(分,
2.3 治疗前急性脑梗死患者与正常对照组血清中OPN、IL-1、CX3CL1、HCY水平比较:治疗前,脑梗死组血清中OPN、IL-1、HCY水平较正常对照组明显增高(P<0.05),而血清中CX3CL1水平较正常对照组明显降低(P<0.05),见表3。

表3 治疗前急性脑梗死组与正常对照组HCY、OPN、CX3CL1、IL-1水平比较
2.4 常规组和观察组患者治疗前后血清中OPN、IL-1、CX3CL1、HCY水平比较:治疗前,常规组和观察组OPN、IL-1、CX3CL1、HCY水平差异无统计学意义。治疗14 d后,2组OPN、IL-1、HCY水平较治疗前下降,CX3CL1水平较治疗前升高,观察组比常规组四个因子水平变化更明显,差异有统计学意义(P<0.05),见表4。

表4 常规组和观察组治疗前后血清中OPN、IL-1、CX3CL1、HCY水平的比较
2.5 临床疗效与OPN、IL-1、CX3CL1、HCY的相关性分析:临床疗效指标NIHSS评分、ADL指数评分与OPN、IL-1、HCY呈显著正相关性(P<0.05),与CX3CL1呈显著负相关性(P<0.05),见表5至表6。

表5 NISSH评分与OPN、IL-1、CX3CL1、HCY的相关性分析

表6 ADL评分与OPN、IL-1、CX3CL1、HCY的相关性分析
3 讨论
随着居民不健康生活方式的流行和社会老龄化形势的加快,急性脑梗死患病率不断呈上升趋势,给患者造成巨大的健康和经济后果,并且这种趋势在未来还将继续增长。除了发病率高外,公认的有效治疗方法也很有限。临床研究发现,血管内炎症反应在急性脑梗死发展中具有重要作用[6],早在脑缺血后数小时,增加的氧化应激会激活内皮细胞和相关蛋白质,使其在缺血核心区和周围组织中升高。激活的内皮细胞还促进白细胞在脑血管的黏附、积累、渗透,导致神经血管单元内的炎症加剧,加速梗死扩张。可以说炎症反应在脑梗死的发生、发展及预后的整个过程中都发挥着重要作用[7],故可通过检测炎性相关因子水平变化来评估急性脑梗死病情进展情况。由于丁苯酞治疗对于OPN、IL-1、CX3CL1、HCY水平的影响及疗效的关系并不明确,在此方面还有待深入研究。
OPN是一种分泌性基质细胞炎性细胞因子,其作用是触发不同的白细胞,引起功能性反应,诱导细胞因子分泌,从而促成整个免疫反应[8]。在急性和慢性缺血时会高度上调,其功能中有一部分是作为一种炎症细胞因子,可以促进多种炎症细胞的募集,从而调节炎症反应。NBP可有效地抑制小胶质细胞的激活,使OPN水平降低。NBP还可以有效的抑制氧化应激反应,抑制OPN的升高。IL-1在急性中风后早期,对脑血流量有不利的作用,可加重脑缺血[9]。本次实验结果也显示,急性脑梗死患者IL-1水平明显高于正常人,丁苯酞治疗较常规治疗后IL-1水平下降更明显,推测丁苯酞很可能从多途径抑制了IL-1的水平,对大脑起到了保护作用。CX3CLl是目前已知CX3C趋化因子亚家族的唯一成员,其通过与脑组织小胶质细胞上的受体CX3CR1结合,能够激活信号转导通道或直接介导白细胞黏附、趋化及聚集,从而参与各种炎症反应,抑制小胶质细胞的激活[10]。NBP在抗炎方面的作用和CX3CLL有异曲同工之妙,可有效地抑制小胶质细胞的激活和随后促炎性细胞因子的释放,还可通过一些信号通路降低机体炎症反应,最终改善CX3CLL水平,提升治疗效果。高HCY引起的氧化应激、内皮功能障碍、炎症、平滑的肌肉细胞增殖等,被认为在包括动脉硬化、急性脑梗死在内的多种疾病的发病机制中发挥了重要作用[11]。本研究结果也显示,治疗14 d后急性脑梗死患者HCY水平均较治疗前显著下降,且加用丁苯酞治疗后的HCY水平降低更显著,说明丁苯酞可能作用于急性脑梗死致病机制的多个环节,抑制了炎症的发生,降低了患者体内HCY水平,达到了治疗的目。
在本研究中,丁苯酞治疗组患者的OPN、IL-1、HCY水平较对照组显著降低,CX3CLI水平升高,它们均有可能在急性脑梗死病程中发挥其作用。高水平的OPN、IL-1、HCY均有可能与脑梗死高复发率和不良预后有关。在本研究中,采用 NIHSS评分、Barthel指数评定独立生活能力,结果表明丁苯酞组NIHSS评分显著低于正常对照组,ADL指数显著高于正常对照组(P<0.05)。
综上所述,丁苯酞的治疗效果优于常规治疗,能显著降低急性脑梗死患者血清中OPN、IL-1、HCY水平,使CX3CLI水平升高;OPN、IL-1、HCY与丁苯酞的治疗疗效呈正相关性,CX3CL1与丁苯酞的治疗疗效呈负相关性。因此,丁苯酞对治疗脑梗死,促进脑梗死后神经系统损伤的修复,改善脑梗死后肢体运动功能障碍、言语障碍等,以及预防二次中风具有十分重要的意义。

